1 总论:RNA 治疗行业春风已至,将迎药物革命新浪潮
前言:新冠疫情在全球范围内暴发,mRNA 疫苗在新冠疫苗的研发竞赛中 一枝独秀,为防控疫情提供了有力的支持。mRNA 疫苗也逐渐走入大众的 视野,学术、产业与资本等多方对 RNA 治疗领域表现出了极大的兴趣和 热情。借此契机,国金证券医药团队在对 RNA 治疗行业的梳理与研究基础上,撰写了本篇 RNA 治疗行业的深度报告,报告共分为上、下两篇,上篇重点介绍 mRNA 疫苗行业,下篇重点介绍小核酸药物行业,旨在帮助 各位投资者加深对 RNA 治疗行业的理解。
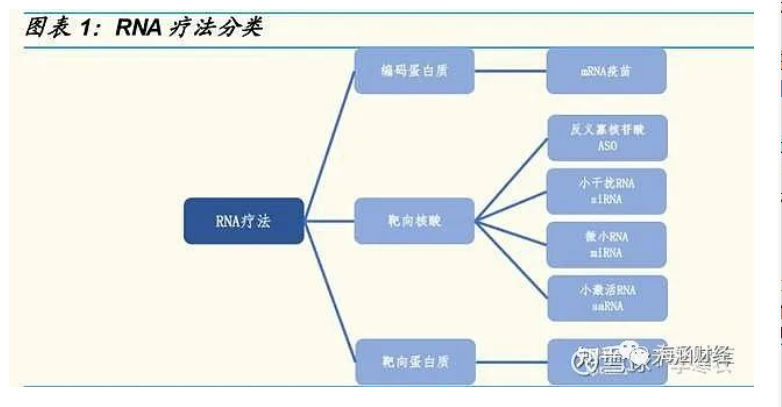
RNA 疗法主要分三类,可调控致病基因的表达。RNA 疗法是指利用具有 治疗疾病功能的核酸从根源上调控致病基因表达的疗法。RNA 疗法按作用 机制分为三类:
1)编码治疗性蛋白或抗原的 mRNA 疗法;
2)以核酸为靶 向,抑制致病性 RNA 活性或激活基因活性的小核酸疗法,包括反义寡核 苷酸(ASO)、小干扰 RNA(siRNA)、微小 RNA(miRNA)、小激活 RNA(saRNA)等疗法;
3)以蛋白质为靶向,调控蛋白质活性的核酸适 配体(Aptamer)疗法。
RNA 疗法具备多重优势。1958 年,克里克提出中心法则:遗传信息从 DNA 传递到 RNA,再传递到蛋白质,即转录和翻译。传统小分子药物与 抗体药作用靶点是蛋白质,通过调控已生成蛋白质的功能来发挥疾病治疗 的作用;小核酸药物的作用靶点是 RNA,可以调节蛋白质的生成;mRNA 疫苗则可以在进入人体后直接表达目标蛋白。与基因疗法相比,RNA 疗法 安全性更高,因为没有进入细胞核插入基因组的风险;与以蛋白质为靶点 的传统药物相比,RNA 疗法具有设计简便、研发周期短、候选靶点丰富等 多种优势,因此成为科学研究和产业界关注的新型疗法。
RNAi 机制曾获诺奖。1978 年 ASO 的概念被首次提出;1998 年首款 ASO 药物福米韦生(Fomivirsen)于美国获批上市;20 世纪 90 年代至 21 世纪初,研究人员又相继提出了 RNA 适配体、mRNA、siRNA 和 saRNA 等疗 法;2006 年 RNA 干扰(RNAi)机制研究获得了诺贝尔生理学或医学奖; 2018 年首款 siRNA 药物成功获得 FDA 批准;2020 年以 ASO 药物 Milasen 为代表的超个体化药物技术,入选 MIT Technology Review 十大 突破技术。
关键技术取得突破,多款药物获批上市。由于体内稳定性、靶向性、免疫 原性等问题,RNA 疗法早期应用受到限制。近年来,化学修饰及递送系统 取得一定突破,RNA 疗法取得积极进展,已可应用于罕见病、肿瘤、感染 性疾病、神经系统疾病、心血管疾病、代谢疾病、眼病等疾病的治疗。自 新冠暴发以来,目前已有多款新冠 mRNA 疫苗凭借着出色的保护率成功获批上市。此外,已有多款 RNA 疗法产品获批,RNA 疗法将逐渐进入成果 收获期。
2 ,mRNA 疫苗技术介绍 技术原理:mRNA是连接基因与蛋白质的桥梁
蛋白质是生命活动的承担者,mRNA 是连接基因与蛋白质的桥梁。1958 年,克里克提出中心法则:遗传信息从 DNA 传递到 RNA,再传递到蛋白 质,即转录和翻译。mRNA(信使 RNA)是一类单链核糖核酸,它由 DNA 的一条链作为模板转录而来的、携带遗传信息并且能指导蛋白质的合成。与长度小于 60nt 的小核酸药物相比,mRNA 的长度更长,一般约为 500 至 5000nt。mRNA 作为疫苗或者药物,可在人体内表达目标蛋白。因 为 mRNA 在细胞内翻译且不进入细胞核,所以无整合进人体 DNA 的风险。同时,它也可作用于传统小分子药物以及抗体药物等无法触及的胞内靶点,因此具有更广阔的应用空间。
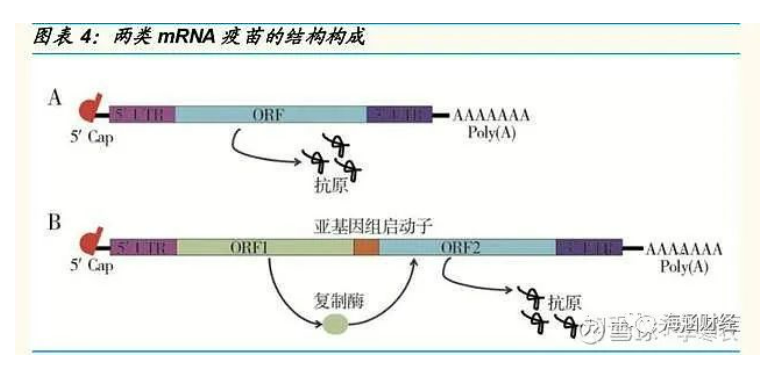
mRNA疫苗主要分为两类,均具有预防和治疗疾病的作用。
1)病毒衍生的自我扩增型 mRNA 疫苗(SAM):不仅可以编码目标抗原,还可以编码病毒的复制机制。因此自我扩增 mRNA 疫苗编码的遗传信息会 被放大很多倍,从而使得相对低剂量的疫苗就可以产生较高水平的抗原表 达;但缺点是 mRNA 体积较大,生产过程复杂,而且编码蛋白可能会诱导 非预期的免疫反应,如复制机制产生的复制酶,理论上会限制其技术平台 在同一人体中的重复使用。
2)非复制型 mRNA 疫苗(NRM):优势在于结构简单,mRNA 体积小,对插入开放阅读框(ORF)中目标抗原转录本的大小限制更少。目前,非 复制 mRNA 疫苗的研发进展较快,已有多个品种处于临床试验中;而自扩 增 mRNA 疫苗尚未在临床研究中进行验证。
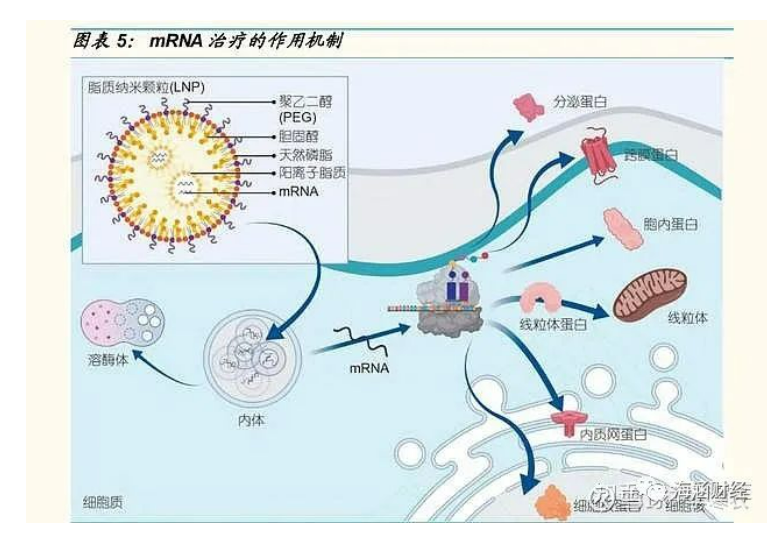
mRNA 疫苗发挥作用需要经过以下几个步骤:1)mRNA 被各种递送载体 包裹;2)注射进入人体;3)包裹 mRNA 的脂质体胞吞进入细胞;4)mRNA 在细胞内释放,利用人体的细胞器翻译表达抗原蛋白,刺激人体产 生免疫反应。
发展历程:关键技术的突破使得 mRNA疫苗未来可期
早期技术缺陷使 mRNA 疫苗研究进展缓慢。1961 年,首次发现 mRNA; 1990 年,Wolff 等人发现在小鼠肌肉组织中注射含有特定基因的质粒 DNA 或 mRNA,小鼠组织局部会产生该基因编码的蛋白产物,此后多项研究发 现用核酸免疫动物,可以诱导机体产生针对该核酸编码抗原的免疫力。起 初,mRNA 因其高免疫原性、低稳定性、在组织内易被降解、细胞吸收率 低以及生产制备的局限,发展较为缓慢。
新技术发展使得 mRNA 疫苗重新得到重视。近年来随着 mRNA 合成、化学修饰和递送技术的发展,mRNA 的稳定性和翻译效率大幅提高,免疫原 性逐步可控,在肿瘤免疫治疗领域和突发传染病领域显示出巨大的商业价 值,因此 mRNA 疫苗重新受到重视。
独特优势:mRNA疫苗具备显著优势,未来发展潜力巨大
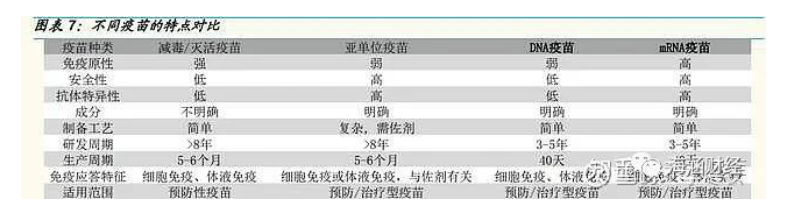
mRNA疫苗在研发和生产等方面具备显著优势。
1)研发周期短、抗原选择范围广。与传统疫苗相比,mRNA 疫苗的研发 只需要在成熟技术平台上更换抗原序列即可,因此研发周期较短,在防控 突发传染病等方面有巨大优势;在抗原序列方面,理论上任何可成蛋白的 抗原序列均可被选择(包括原先不可成药的胞内靶点),因此可选范围广阔,应用范围也更广阔,如:蛋白替换疗法、肿瘤免疫以及传染病疫苗等,mRNA 疫苗发展潜力巨大。
2)安全性高。mRNA 能够被正常的细胞自然降解,半衰期与免疫原性等 可通过修饰和递送系统来人工调节,因此 mRNA 疫苗安全性较高;此外,与 DNA 疫苗相比,mRNA 不存在感染或插入突变的风险。
3)有效性高且稳定。多种修饰后的 mRNA 更稳定,在细胞质中被高效摄 取和表达;mRNA 疫苗具备自我佐剂特点,因此表现更强的免疫原性,有 效性更高;此外,mRNA 是最小的遗传载体,因此避免了抗载体免疫,可 以重复接种 mRNA 疫苗。
4)生产难度低、速度快且安全。mRNA 疫苗不依赖细胞培养技术,现有 的体外转录技术能够非常快速、廉价地大规模生产 RNA 疫苗;相比于传 统疫苗的 5-6 个月的生产周期,mRNA 疫苗只要掌握了病毒基因序列就可 以在 40 天内完成疫苗样品的生产制备;整个生产过程仅涉及生物化学合 成,因此无病毒感染风险,难度低且更安全。此外,mRNA 作为疫苗可以 同时激活体液免疫和细胞免疫,效果显著。
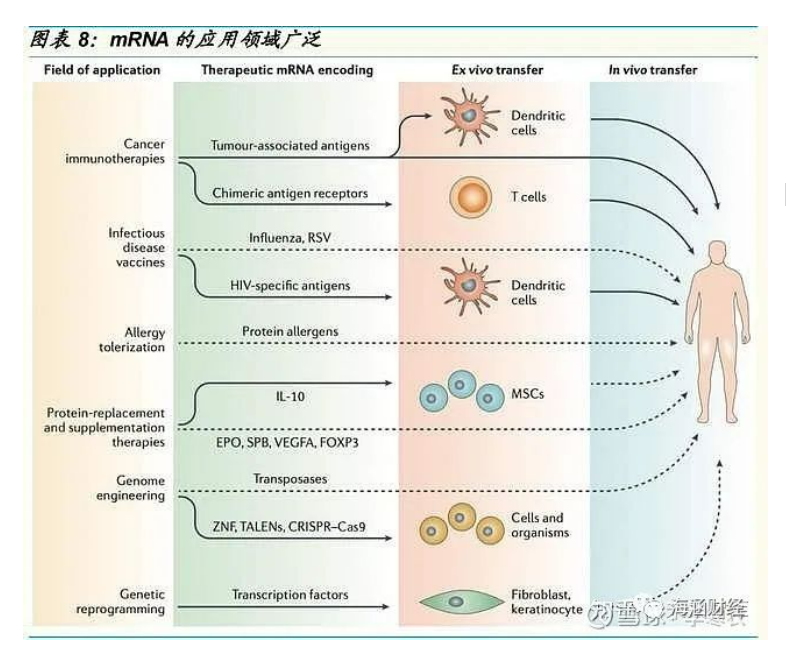
应用领域:应用范围广阔,传染病、肿瘤、蛋白代替疗法
mRNA 作为疫苗,可以被广泛应用于传染病、肿瘤以及蛋白替换疗法等领 域,应用范围较为广阔。
1)传染病领域。针对传染性病原体开发预防性疫苗是控制和阻止传染性 疾病大规模流行的关键。mRNA 疫苗能够靶定病毒的保守区域,直接在细 胞中表达产生特定抗原,激活机体的免疫应答产生抗体,从而达到预防传 染性疾病的目的。目前开发的传染病 mRNA 疫苗主要针对流感、呼吸道合 胞病毒、HIV 等。
2)抗肿瘤领域。抗肿瘤 mRNA 疫苗根据作用机理一般分为两类,基于树 突状细胞(DC)给药的 mRNA 疫苗和直接注射的 mRNA 疫苗。如: Moderna 的针对实体瘤的 mRNA-4157 与 BioNTech 的针对转移性黑色素 瘤的 BNT122。
3)蛋白替代疗法领域。通过将人体变成自身蛋白加工厂,从而可以用来 治疗一些罕见病。如 Moderna 公司用于治疗甲基丙二酸血症(MMA)的 mRNA-3704 和治疗丙酸血症(Propionic Acidemia,PA)的 mRNA-3927 等。
研发生产:关键技术在于化学修饰与递送系统
mRNA 疫苗的研发环节包括:抗原的选择、基因测序、选定编码目标抗原 的基因序列并进行优化、修饰核苷酸的筛选、递送体系的优化、免疫效果 评价、安全性评估等。
mRNA 疫苗的生产流程包括:1)mRNA 的合成修饰、递送;2)在中试 车间中进行疫苗生产、纯化、制剂、检测等;3)在 GMP 生产车间中进行 放大生产。开发难点和关键技术点在于合成修(提高 mRNA 分子的稳定性,防降解)和递送系统(提高进入人体细胞的效率,使得产生抗原刺激人体 产生免疫反应)。mRNA 疫苗的工艺优势在于研发、生产速度快。因为 mRNA 疫苗的研发过程较为类似,所以在研发过程中可进行高通量筛选,从而提高研发速度,此外 mRNA 疫苗的生产工艺可直接放大,成药快;而 传统疫苗生产过程中,每个蛋白表达都存在差异性,需要筛选优化。
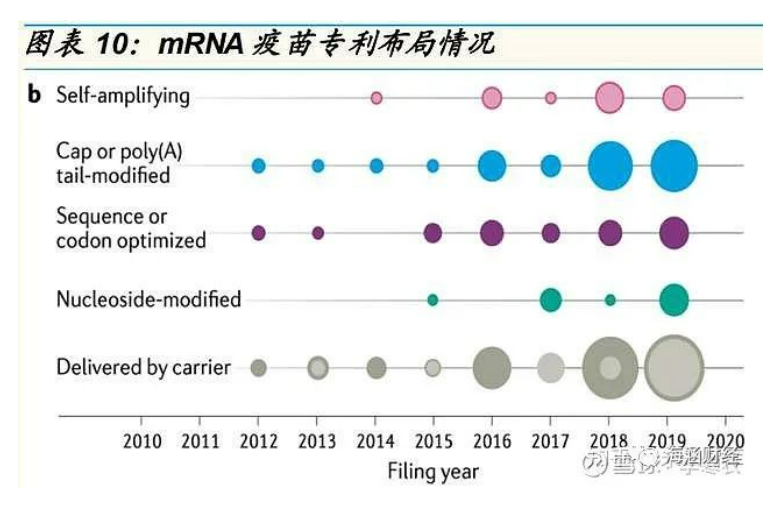
专利布局:重点布局递送和修饰,新冠 mRNA疫苗专利关系复杂
自 2014 年开始,mRNA 疫苗的专利申请数量快速增加,其中适应症为传 染病和癌症的相关专利申请数量增加较为突出;而自 2017 年开始,适应 症为传染病的专利申请数量超过了癌症,可能与 MERS、Ebola 和新冠疫 情的暴发有关。总体来看,目前专利重点布局递送系统和化学修饰领域,Moderna、CureVac、BioNTech 和 GSK 共同拥有近一半的 mRNA 疫苗专 利申请。
新冠 mRNA 疫苗的专利保护与许可交易关系错综复杂。相比于长度较小 的小核酸,mRNA 的长度较长,同时还具备复杂的二级结构,因此 mRNA 对与递送系统有着更高的要求,所以我们需要重点关注递送系统以及其专 利问题。以新冠 mRNA 疫苗的递送系统为例,BioNTech 不得不将其原有 的 LPX 递送系统更换为 LNP,而 Moderna 则冒着被诉讼的风险直接启用 了专利属于 Arbutus 公司的 LNP 递送系统。事实上,目前 LNP 递送系统 几乎都可以追溯到同一 IP 来源。
mRNA 分子修饰的关键专利壁垒较高。2005 年,Katalin 和 Drew 等人发现用假尿苷去替换 mRNA 中的尿苷,不但能够让合成的 mRNA免受免疫 系统的攻击,而且显著增强了 mRNA 表达蛋白的能力。这一突破性的发现 结果发表在 Immunity 杂志上,解决了 mRNA 临床应用的最大难题,从此 揭开了 mRNA 临床应用的序幕。目前,mRNA 分子修饰的专利壁垒较高,专利的源头 Katalin、Drew 以及美国宾夕法尼亚大学独家授权给 mRNA Ribo Therapeautics,该公司随后将专利二次授权给 Cellscript。
随后,Cellscript 又将专利二次授权给 Moderna 和 BioNTech。Moderna 与 BioNTech 的新冠 mRNA 疫苗使用 N1-methylpseudouridine (1mψ)取代尿 苷(U)进行核苷修饰,显著降低了 mRNA 的先天免疫应答。相比之下,作 为 mRNA 三巨头之一的 CureVac 或许因为在 mRNA 分子修饰方面存在专利问题,所以采用了未经修饰的尿苷,通过序列优化和选择非翻译区 (UTRs)来增强 mRNA 的翻译,因此导致免疫原性较高、剂量较小、效 果较差。
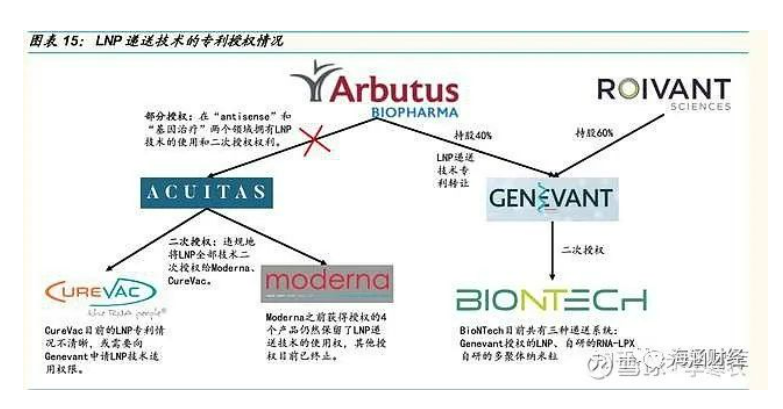
LNP 递送技术原本用于递送 RNAi 药物。Arbutus 是 LNP 递送技术的开山 鼻祖,是一家专注于乙肝的小型生物制药公司,发明 LNP 递送技术的目的 主要是用于递送乙肝 RNAi 药物。该公司在取得专利后将 LNP 递送技术授 权给 Alnylam,Alnylam 利用 LNP 递送技术成功上市了第一个治疗 ATTR 的 RNAi 药物。然而,Alnylam 后来开发了带有葡萄糖乙酰胺靶向配体、靶向肝脏的 RNAi 技术,该技术安全性更好、给药周期更长、更方便。随 后,Arrowhead 公司马上跟进该技术,研发了首个治愈乙肝潜力的 RNAi 药物,并授权给强生开发。此时,乙肝 RNAi 药物的递送技术已经从 LNP 转到靶向配体,Arbutus 的乙肝 RNAi 药物的开发进度已经有所落后。但后 来,LNP 递送技术被多家开发 mRNA 的公司所青睐,如:Moderna、Curevac、BioNtech 等。他们通过间接授权获得 LNP 递送技术,但目前产 生了一定的专利纠纷。
LNP 递送技术壁垒高,专利问题尚存纠纷。Arbutus 将 LNP 递送技术(专 利号:US8058069)部分转移给加拿大公司 Acuitas,并规定 Acuitas 只 在“antisense”和“基因治疗”两个领域拥有 LNP 技术的使用和二次授 权权利。2016 年,Acuitas 却违规地将 LNP 全部 技术二次授权给 Moderna 以及 CureVac。但 Arbutus 并不认可此次的二次授权并向法院提 起诉讼。根据法院判决,Moderna 只被允许在 4 种病毒疫苗的研发上继续应用 Arbutus 的 LNP 递送系统,其余的应用授权都无效。
2017 年,Arbutus 终止了 Acuitas 继续使用和二次授权 LNP 递送技术的权益。2018 年,Arbutus 与 Riovant 公司共同成立了 Genevant,并将 LNP 递送技术的 权益转移给 Genevant。Genevant 拥有 LNP 递送系统专利,包括纳米颗 粒制备专利和阳离子脂质(MC3)专利,其中 MC3 专利预计 2030 年到期。BioNTech 从 Genevant 得到 Arbutus 的专利授权,使用 Arbutus 的 LNP 递送系统是因为已经有使用该技术的药物被 FDA 审批通过,递送系统的安全性有保证,并能够加速审批时间。此外,Moderna 从 2018 年开始挑战 Arbutus 的 LNP 专利,包括当年授权给 Acuitas 的 US8058069,但是该专 利挑战失败。
此外,Moderna 也开始自主研发 LNP 递送技术。但 Arbutus不依靠 Arbutus 专利的情况下开发出有效的脂质体递送技术。目前,Moderna 之前获得授权的 4个产品仍然保留了 LNP 递送技术的使用权,其他授权目前已终止。Moderna 新冠疫苗 mRNA-1273 采用自研的 LNP 递 送系统。BioNTech 目前共有三种递送系统:Genevant 授权的 LNP、自研 的 RNA-LPX、自研的多聚体 纳米粒,其中新冠疫苗 BNT162 采用 Genevant 授权的 LNP。CureVac 目前的 LNP 专利情况不清晰,或需要向 Genevant 申请 LNP 技术适用权限。(报告来源:未来智库)
现存挑战:重点关注 mRNA疫苗的安全性、有效性与稳定性
mRNA 疫苗或药物创新程度较高,应重点关注 mRNA 疫苗的安全性、有 效性与稳定性。
1)安全性:mRNA 疫苗成分复杂、生产及制剂工艺难度高,所以对安全 性有较高的要求。安全性风险主要来自于 mRNA 和递送系统两个方面,应 重点关注与脂质相关的毒性问题,如:阳性聚合物材料自身的毒性或安全 性、制剂及贮存期间产生的降解产物以及各类杂质累积的安全性风险等;
2)有效性:mRNA 疫苗的有效性主要由递送效率、翻译效率以及免疫原 性等因素决定;
3)稳定性:mRNA 稳定性较弱,在人体内极易被酶降解,半衰期仅有 7 小时;此外,作为递送系统的脂质也应保证一定的稳定性,从而保证高效 稳定的递送效率。
从 mRNA疫苗的研发生产流程来看,应重点关注下列问题:
1)序列选择:应重点关注目标抗原的选择、序列的优化、核苷酸的化学 修饰、表达效率、免疫原性、二级结构、稳定性等。
2)mRNA:应重点关注 mRNA 的修饰比例、加帽/尾效率、去磷酸化程度、mRNA 降解片段、mRNA 的完整性及序列的准确性、dsRNA、mRNA 含 量等。
3)递送系统:应重点关注递送系统的组成成分、配比、来源、生产工艺、质量控制、稳定性、杂质。以脂质纳米颗粒为例,应重点关注电荷、粒径 分布、pH 值、纳米颗粒对 mRNA 的包封率、包封后 mRNA 的完整性、功能性及含量、mRNA 释放效率等问题,电荷会影响纳米粒的稳定性、入胞 效率、内体逃逸及不良反应等;pH 值会影响递送材料与 mRNA 复合的效 率。
4)杂质:应重点关注聚正电荷材料相关杂质,包括材料合成产生的杂质 及 mRNA 复合过程中可能产生的杂质;不饱和脂质的氧化及相关降解产物; 纳米颗粒聚集产生的颗粒物也是潜在杂质;未组装的脂质分子、阳离子物 质、游离 mRNA。其中,未组装的脂质分子会影响 LNP 的稳定性;游离 mRNA 易降解,同时也可能引起非特异免疫刺激,影响产品的安全有效性。
5)生产工艺及质量研究工艺:临床样品制备工艺应具备一定规模、生产 连续性和放大可行性; mRNA 原液生产工艺应关注 mRNA 序列完整性、加帽率、去磷酸化、PolyA 尾长度、纯度、mRNA 序列生物活性表达、工 艺相关杂质的去除、产品相关杂质残留等;纳米颗粒生产工艺应关注现有 制剂规模、放大能力、耗材使用次数、GMP 符合情况等;纳米颗粒质量研 究应关注包封率、粒径分布、纳米粒的稳定性、纯度、不完整 LNP、纳米 颗粒各成分含量、工艺相关杂质的去除、免疫原性等。
3 mRNA 疫苗技术难点
序列选择:正确的序列选择是成功的一半
正确选择病毒的抗原序列非常重要。宿主可根据 mRNA 携带的编码信息来 合成任何蛋白质,所以 mRNA 疫苗在选择抗原方面异常灵活。但在选择特 定病毒的正确抗原时必须非常谨慎,要保证疫苗包含 RNA 所编码的蛋白 既安全又有效。由于不同的蛋白质是由不同的 RNA 序列编码,因此找到 最佳蛋白质抗原是确定 mRNA 疫苗研发方向的关键。严重急性呼吸综合征 (SARS)和中东呼吸综合征(MERS)暴发多年后仍未研发出疫苗的原 因之一就是尚未就哪种抗原既安全又有效达成广泛共识。
mRNA 序列的优化也十分重要。Moderna 等公司与 Amazon 等合作解决 序列优化的问题;斯微生物通过与全球公司合作并借助“AI+云计算”技术,开发独特算法技术(proprietary),以实验数据矫正数字模型,并改善预测 和序列设计的准确性和效率。与传动的序列优化平台相比,该技术可以把 mRNA 的表达效率提高 3-4 倍,并降低 mRNA 的降解比例。
化学修饰:多种方法可调节 mRNA稳定性、翻译效率及免疫原性
mRNA 的结构组成含有几个必要的元件,依次包括帽子结构(Cap)、5’ UTR 区、编码抗原蛋白的开放阅读框(ORF)、3’UTR 区和 Poly(A)尾结构。通过对 mRNA 的元件进行设计,可以提高 mRNA 的稳定性和翻 译效率。除了不稳定性和翻译效率外,mRNA 的另一个缺点是免疫原性过 高。目前的策略是在 mRNA 分子中掺入化学修饰过的核苷酸,可显著提高 其翻译效率,延长其半衰期,同时达到降低其免疫原性的目的。

Cap 结构
Cap 结构与 mRNA 的稳定性和免疫原性密切相关,还会影响 mRNA 的翻 译效率。主要功能有:1)作为翻译起始的必要结构,为核糖体对 mRNA 的识别提供了信号;2)增加 mRNA 的稳定性,保护 mRNA 免遭 5’→3’ 核酸外切酶的降解;3)作为自身识别信号,避免激活 Rig-I 及 IFIT 而导致 的免疫抑制。通过引入抗-反转帽子类似物(ARCA),可以提高 mRNA 的 翻译效率;此外,在 ARCA 基础上修饰 Cap 结构,还可以提高 mRNA 的 稳定性。
5’UTR 区
5’UTR 区的结构特征是影响 mRNA 翻译效率的主要因素之一。在真核细胞 中,翻译开始前 mRNA 需要招募核糖体亚基结合到其 5ʹm7G cap 上,但 起始密码子又常常在 5ʹm7G cap 下游较远的地方,所以核糖体亚基需要经 过 5ʹUTR 到达起始密码子 AUG 处,从而开始翻译。因此, 5ʹUTR 的长度和 结构对翻译的起始具有重要影响。此外,紧密的二级结构会阻止核糖体的 结合, 所以在设计 mRNA 时, 5ʹUTR 不能太长或太紧密。
在设计 mRNA 时,应该避免在 5ʹUTR 区域引入上游开放阅读框序列和起始 密码子 AUG。上游开放阅读框序列是存在 5ʹUTR 的一段包含起始密码子 和终止密码子的连续碱基序列,它可能会抑制 ORF 区基因的表达,也可 能导致 mRNA 的降解,因此对蛋白表达具有负面影响。最后,在 5ʹUTR 区 域引入强的 Kozak 序列可以加强起始密码子的识别,让 mRNA 更容易被翻 译,避免避免错误启动(在哺乳动物中 Kozak 序列是 GCCRCCAUGG,其中 R 代表嘌呤)。
开放阅读框(ORF)
在 mRNA 的开放阅读框(ORF)中,将常用的密码子去替换不常用的密码 子,即密码子优化,这一过程可以提高 mRNA 的稳定性和翻译效率。在开 放阅读框(ORF)中,每相邻的 3 个核苷酸组成密码子,在翻译时代表某 一种氨基酸。密码子的组成对 mRNA 的翻译效率和稳定性都有显著影响。同义密码子是指序列不同但是对应相同氨基酸的密码子,而不同生物常用的 密码子组成都不相同。故将 mRNA 注射到人体内, 原宿主的 mRNA 包含的 密码子虽然对应相同的氨基酸,但是并不常用,导致 mRNA 进入人体后不 稳定并且翻译效率低,所以需要进行密码子优化。此外,通过增加嘌呤和 胞嘧啶(GC)含量也有一定正面效果。
3’UTR 区
3’UTR 区是 mRNA 不稳定因素的集中区域,其中 AU富集序列(AREs)、AUUUA 重复序列和 GU 富集序列(GREs)是 3'UTR 引起 mRNA 不稳定 的最常见因素。因此,在合成的 mRNA 中应避免这些序列。3ʹUTR 内的 AU 富集序列(AREs)是激活 mRNA 快速衰变的顺式作用序列, AREs 上 的 AUUUA 重复序列数量和位臵对 Poly(A)尾的缩短和 RNA 降解有关键 的影响。而该区域上的另一 GU 富集序列(GREs), 在哺乳动物细胞中能 与 CELF1 蛋白结合从而加快 mRNA 的衰变。此外,通过引入稳定元件,可以显著提高 mRNA 的稳定性,延长其半衰期。例如,BioNTech 公司专 利中使用了 2 个β球蛋白(β-globin)串联的 3'UTR,这大大地增强了 mRNA 的稳定性。此外,人类α和β球蛋白的 3'UTR 可增强 mRNA 的稳 定性和翻译效率,头尾排列的人类 2 个β-球蛋白的 3'UTR 可增加 mRNA 的稳定性。
Poly(A)尾
Poly(A)尾是影响 mRNA 翻译效率和稳定性的重要因素。在翻译效率方 面,Poly(A)尾和 5ʹ帽的协同作用可以增加翻译效率;在稳定性方面,Poly(A)尾的去除是大多数真核 mRNA 降解的第一步和限速步骤,且 Poly(A)尾的存在可以抑制 mRNA 的降解和脱帽。Poly(A)尾的重要 作用决定了实验中对 mRNA 进行加尾处理的必要性。在体外为 mRNA 加 尾有两种方式:第一种是先进行体外转录,再通过酶促多聚腺苷酸化将 Poly(A)尾加到 mRNA 上;第二种是将 Poly(A)尾序列加在模板上,直接通过体外转录合成带 Poly(A)尾的 mRNA。通过酶促反应进行加尾时,需要注意 Poly(A)尾后若有其他碱基可能会影响其功效,因此应避 免在体系中混入其他核苷酸。与此同时,最好将 Poly(A)尾的长度保持 在最佳的 100 至 120 个核苷酸。例如,在 BioNTech 公司公开的专利中,长度为 120 个核苷酸的 Poly(A)尾有最高的稳定性和翻译效率。但由于 酶促反应进行加尾受到温度、酶质量等反应条件的影响较大,导致 Poly (A)尾长度无法保证完全一致,故在大多临床试验中只能保证加尾长度 最少为多少,如果需要保证精准的 Poly(A)尾长度则需采用第二种方法。
核苷酸类似物
通过使用核苷酸类似物可以提高 mRNA 的稳定性、降低免疫原性并且增加 翻译效率。如:假尿苷(Ψ)、5-甲基胞苷(m5C)、N6-甲基腺苷(m6A)、5-甲基尿苷(m5U)和 2-硫尿苷(s2U)等,其中尿嘧啶类似物在核苷酸 修饰中较为常见。
递送系统:递送方法多元,LNPs 最为常用
三大难点是胞外屏障、内体逃逸与胞内免疫。
目前,mRNA 疫苗发展受限的一大原因是递送系统。如何特异性地将 mRNA 递送进入靶细胞需要解决三大难点:胞外屏障、内体逃逸与胞内免 疫。mRNA 疫苗只有经过这三重考验后才到达细胞内靶部位,最终发挥功 能。
1)胞外屏障:第一个胞外屏障是 mRNA 分子在全身给药时易受胞外血清 中 RNA 水解酶(RNAse)的降解。因此需要在递送 mRNA 时要将其包裹 在密封载体内而避免被酶水解,从而保证 mRNA 可以顺利到达靶细胞。第 二个胞外屏障是单核吞噬系统(MPS)可以识别并消除外来的纳米颗粒 (NPs),而参与吞噬过程的主要有肝和脾中的巨噬细胞,这就导致 NPs 在这两种组织中聚集,使得 mRNA 在其他组织中的转染变得困难。
2)内体逃逸:当到达靶细胞时,携带 mRNA 的载体通过内吞的方式进入 细胞质,这也是最常见的载体进入细胞内的方式。内体逃逸是指 mRNA 需 要从内体小泡中释放出来,进而跟宿主细胞核糖体结合被翻译成抗原蛋白,抗原蛋白经过修饰后被分泌出细胞从而发挥作用。在内体小泡中,mRNA 能够被 Toll 样受体(Toll-like receptors,TLRs)检测到并被送去降解,因 此内体逃逸对于 mRNA 到达核糖体至关重要。
3)胞内免疫:当外来 mRNA 被递送到细胞质中时,能够被 TLR3 和 TLR7/8 识别,或者通过激活细胞质中的维甲酸诱导基因 I 样受体(RIG-Ilike receptors,RLRs)从而激活天然免疫系统。同时,外来的 mRNA 还 可以通过激活 TLRs 诱导干扰素(IFN)-α和 IFN-β等 I 型干扰素等促炎 细胞因子的表达。所以,合成的 mRNA 疫苗可以通过激活不同的细胞因子 来促进 mRNA 免疫后的细胞或者体液反应,从而作为良好的自佐剂。但是 胞内免疫也会限制 mRNA 发挥作用,TLR 家族中的模式识别受体 (pattern recognition receptors,PRRs)、RLRs 和 NOD 样受体(NODlike receptors,NLRs)能够特异性检测双链 mRNA(ssRNA)或者单链 mRNA(dsRNA),并且能够在它们转化为有治疗作用的蛋白质之前使其 降解。
递送方法较为多元,脂质体优势突出
递送 mRNA 疫苗的手段有物理方法、病毒载体方法和非病毒载体方法。1)物理方法:电穿孔和基因枪是物理手段递送 mRNA 的经典方法,但是临床 实验证明物理方法通常对细胞有害,不适合在体内应用;2)病毒载体方法: 虽然慢病毒、腺相关病毒与仙台病毒等载体可以进行核酸递送,但由于存 在安全性、稳定性以及有效性等诸多方面的问题,病毒载体方法应用也受 到一定限制;3)非病毒载体方法:非病毒载体主要包括脂质体、树状大分 子、无机纳米粒子、阳离子细胞穿膜肽等。
脂质体已成为目前递送 mRNA 最有效的非病毒载体。用于递送 mRNA 疫 苗的脂质载体主要分为以下几种:脂质体复合物(LP),脂质体聚合物 (LPR),脂质体纳米粒(LNP),阳离子纳米乳(CNE)。脂质体及其衍生物成为近年来备受关注的 mRNA 疫苗的新型递送系统。
优点有:
1)脂质体作为球形囊泡可将 mRNA 包裹在内,包封率较高,保 护 mRNA 免受酶降解;
2)脂质体类似于细胞膜,易与受体细胞融合,递 送效率高;
3)脂质体可递送不同大小片段的 mRNA;
4)脂质体作为递送 载体不受宿主限制。
缺点有:
1)不稳定,易水解;
2)在水解过程中易受 pH 值、温度、表面电荷、类脂组成等影响;
3)易发生自动氧化,导致膜 的流动性降低、药物渗流,聚集沉淀后产生毒性;
4)此外,纳米脂质体易 渗漏,渗漏的原因与脂质体粒径、所载药物性质和生物学稳定(如血清成 分,MPS 的吞噬作用)有关,这在很大程度上限制其作为药物载体的应用;
5)由于疫苗与载脂蛋白 E 的结合和被受体介导的肝细胞摄取,全身递送 的 mRNA-LNP 复合物主要靶向肝脏和脾脏。
脂质纳米粒(LNPs)是最为常用的递送系统
脂质纳米粒(Lipid nano particles,LNPs)是最先进和主流的 mRNA 递送 系统,最初在 siRNA 的递送中被证明是安全有效的。LNPs 通常由可电离 的阳离子脂质、聚乙二醇(PEG)、胆固醇和磷脂四种成分组成,其中可 电离的阳离子脂质具有较高的专利壁垒。除了保护 mRNA 外,LNPs 还可 以促进细胞摄取、提高内体逃逸,保护 mRNA 分子不被 TLRs 识别,避免先天免疫系统的过度激活的作用。具体成分及功能是:
1)可电离的阳离子 脂质,可以结合带负电 mRNA、增强内体逃逸。在生产原液时,将 mRNA 与可电离阳离子脂质在特定的 pH 环境下混合在一起,带负电的 mRNA 会 与阳离子脂质产生静电吸引从而融合在一起;
2)与脂质相连的聚乙二醇 (PEG)及其衍生物,可以增加制剂的半衰期、减少聚集和非特异性摄取,PEG 的含量可能会影响细胞吸收;
3)胆固醇有利于确保 LNPs 的双层结 构和脂质的流动性;
4)天然的磷脂具有稳定 LNPs 双层结构的作用,因为 脂质体的双层结构并不稳定。
LNPs 的递送机制主要是通过阳离子脂质体与带负电荷的 mRNA 结合,形 成粒径小于 200nm 的复合物,然后通过内吞的方式进入细胞。在体外实验 中,多种商业的转染试剂表现出良好的转染效果。但大多数商业试剂在体 内递送效果不佳,且具有肝损伤等毒性,以及载体免疫原性等缺点而不能 用于人体。商业试剂体内活性丧失的一个根本原因在于阳离子脂质体 mRNA 复合物带有正电荷的特性,这种带正电荷的复合物在全身循环时,能被带负电荷的血清蛋白包裹,使其被单核巨噬细胞清除。此外,LNPs 还存在过敏反应、易氧化降解、制备重现率差等问题,以 LNP 为载体制备 的 mRNA 制剂会在肝脏及脾脏聚集,难以靶向其他部位。
由于 LNPs 技术目前仍存在以上的缺点,因此应用受到一定限制,行业也 正在探索脂质复合物、多聚体等新型递送载体,未来载体技术仍有巨大提 升空间。例如,BioNTech 还开发了脂质体运载(lipoplexes,LPX)技术 和聚合物运载技术(polyplexes)。其中,LPX 技术可很好地稳定 RNA,且制剂自身应有免疫佐剂的作用,该公司重要的产品均利用 LPX 平台实现 递送;国内斯微生物开发的 LPP 纳米递送平台是一种以聚合物包载 mRNA 为内核、磷脂包裹为外壳的双层结构。与传统的 LNP 相比,LPP 的双层纳 米粒具有更好的包载、保护 mRNA 的效果,并能随聚合物的降解逐步释放 mRNA 分子。
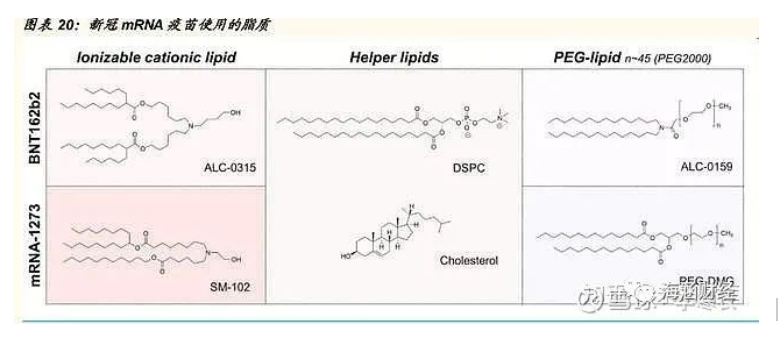
新冠 mRNA疫苗均采用 LNP 递送系统,成分配方有所不同
目前所有的新冠 mRNA 疫苗都以相同的 SARS-CoV-2 抗原为靶点,并包 含编码全长跨膜锚定 S 蛋白的 mRNA。三种新冠 mRNA 疫苗都采用了 LNP 递送系统,其中 CureVac 处方中具体脂质成分未知,BioNTech 和 Moderna 的新冠 mRNA 疫苗使用的可电离脂质分别为 ALC-0315 和 SM102,其所用的 PEG 脂质分别为 ALC-0159 和 PEG2000-DMG。二者共同 的辅助脂质为 DSPC、胆固醇。以上三种 mRNA-LNPs 的各脂质摩尔比为 可电离脂质:磷脂:胆固醇:PEG-脂质=50:10:38.5:1.5,mRNA-脂质的 质量比为 0.05。此外,由于脂质尾部引入酯键,ALC-0315 和 SM-102 的 生物可降解性较好。研究表明在递送 mRNA 时,SM-102 脂质的效果优于 Onpattro 的 MC3 LNPs,原因在于 SM-102 有更好的耐受性和更高的内吞 体逃逸效率。由此可见,脂质结构和组成的差异可能对 mRNA 的递送效率 等造成巨大的影响。PEG 脂质,可提高 LNP 在制备和储存中的稳定性,而这些 PEG 脂质一般含有短酰基链,有助于 PEG 脂质在注射后迅速从 LNPs 中分离,促进 LNPs 与细胞的相互作用。目前,新冠 mRNA 疫苗需 要严格的储存条件,限制了它们在冷库稀缺或不可用的地方的销售。未来,冻干或其他药物处理方法可能有助于解决这一问题,甚至可以实现鼻腔、口腔或呼吸道给药。
生产工艺:瓶颈在于原材料与规模化生产
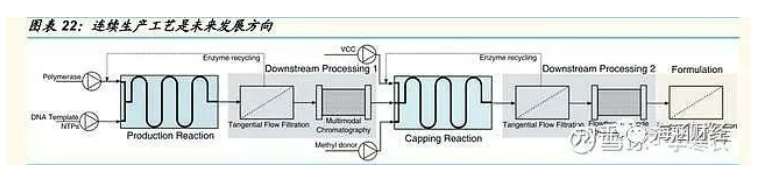
mRNA 的生产主要包括上游合成和下游纯化。相比起传统疫苗,mRNA 疫 苗的优势之一就是相对简单的生产过程。目前,暂无完善的 mRNA 疫苗生 产制造平台,mRNA 的制造主要分为上游 mRNA 的酶促反应合成和下游 mRNA 产物的纯化,随后是 LNP 的包封,最后一步是制剂的灌装。
上游合成:体外转录酶促反应(in vitro transcription enzymatic reaction, IVT)是以 DNA 为模版,并依赖 RNA 聚合酶催化生成目标 mRNA 的过程。DNA 模版需要提前制备,通常使用纯化的质粒进行线性化或者使用 PCR 技术扩增目标片段。除了线性 DNA 模版外,IVT 成分还需要包含 RNA 聚 合酶、NTPs 底物、聚合酶辅因子或 MgCl2 以及 pH 缓冲液。与复杂且耗 时的传统疫苗生产过程相比,IVT 酶促反应过程仅需几个小时即可完成,由于生产时间的大大缩减,相应生产过程中的污染风险也被降低。一般来 说,该反应的每毫升可以收获毫克级别的 mRNA。
mRNA 的加帽分为一步法和两步法。一步法是指在 IVT 酶促反应过程中,用帽子类似代替物 GTP 底物进行加帽,加帽效率约为 60-80%;两步法是 指在 IVT 酶促反应生成 mRNA 后,利用 VCC 和甲基供体作为底物再对 mRNA 进行加帽,加帽效率约为 100%。两步法的加帽效率更高,但一步 法由于不涉及第二步的酶促反应,因此速度更快。
下游纯化:mRNA 在由 IVT 生产出来之后,需要进行纯化来去除杂质,从而达到临床纯净的标准。生产出来的产品中不仅包含目标 mRNA,还包含 有很多杂质,如:酶、残留的 NTP 和 DNA 模板以及在 IVT 过程中形成的 异常 mRNA,因此需要进一步纯化,在纯化阶段所使用的几种方法都有一 定缺陷,如不能有效去除 RNA 片段或 dsDNA 等。杂质的去除非常重要,因为杂质会降低翻译效率以及改变免疫原性等。目前常见的纯化的方法有 SEC (Size Exclusion Chromatography),IPC (Ion Pair reverse-phase Chromatography),IEC (Ion Exchange Chromatography)等。
连续生产工艺是未来的发展方向。目前,IVT mRNA 的生产方法存在一定 缺陷,因此需要被进一步改善以适应广泛商业化的需求。由于连续生产工 艺在降低成本方面具备独特优势,因此我们认为连续生产工艺是未来 mRNA 生产方法的主要发展方向。连续生产工艺目前已经被广泛用于化学 与制药工业,这种方法不仅能按需生产,而且灵活性和成本效益更高。此 外,连续生产的过程还可以减少生产过程的操作时间,进一步利用自动化和生产分析技术,从而提高产率和产品质量。
原材料的可及性受限以及成本高昂。IVT 反应的特殊成分必须从经认证的 供应商处购买,来确保原材料均不含动物成分且符合 GMP 等级,因此原 材料可及性受到一定限制;此外,在生产过程中所大量使用的原材会极大 地增加生产成本,如帽子 cap 类似物等。
规模化生产存在难度。mRNA 与脂质的混合是 mRNA 疫苗生产工艺的难 点,由于此前缺乏大规模生产经验,因此原料供应和生产工艺的摸索与优 化均是目前限制全球 mRNA 疫苗产量的主要原因之一。Moderna 与 BioNtech 作为两家生物技术公司,除依靠自身能力进行研发生产外,Moderna 还与 Lonza 合作进行 mRNA 片段与 LNP 的装配,与 Catalent、Baxter(美国),Recipharm、ROVI(除美国外全球)合作进行下游分包 装;BioNtech 则与辉瑞合作进行 mRNA 疫苗生产。
以辉瑞的 mRNA 疫苗为例,该疫苗技术复杂程度高,生产过程需要多种 原料。以辉瑞/BioNTech 的新冠 mRNA 疫苗(BNT162b2)为例,该疫苗 的生产制备环节主要有 4 大步骤,依次为:DNA 原液的制备、mRNA 原液 的制备、脂质体的包封、灌装检验。辉瑞公司的发言人莎伦〃卡斯蒂略 (Sharon Castillo)表示,该公司的疫苗需要来自 19 个国家/地区的 86 个 供应商的 280 种成分,还需要高度专业的设备和人员,以及合作伙伴与全 球供应和制造网络之间复杂而耗时的技术转让。此外,该疫苗递送系统所 采用的脂质纳米颗粒(LNP)在全球的供应商数量较少,生产制造过程较 为复杂,需要耗费几个月的时间完成十几个步骤才能获得,所以扩大生产 规模的能力有限。脂质纳米颗粒供应商 Polymun 公司公司 CEO 称:“公司 使用的技术十分复杂,很难找到合格的员工来处理它,同时也很难培训具 有相关专业知识的人。”(报告来源:未来智库)
3 海外 mRNA 三巨头布局多年,国内后起之秀百花齐放
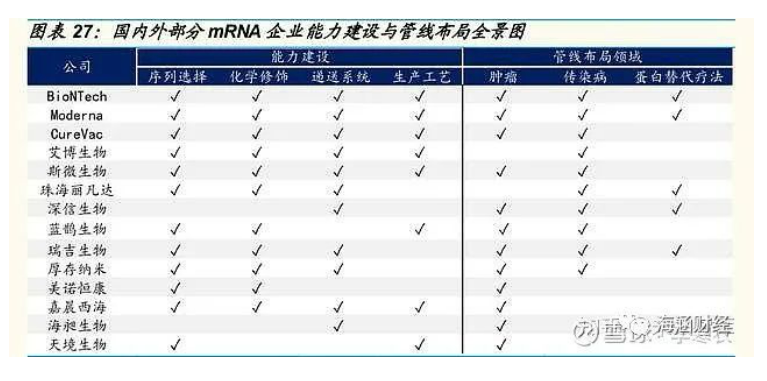
目前,全球范围内布局 mRNA 疫苗的三巨头分别是 BioNTech、Moderna 以及 CureVac。国内布局该领域的主要有艾博生物、斯微生物、珠海丽凡 达、深信生物、蓝鹊生物、瑞吉生物、厚存纳米、美诺恒康、嘉晨西海、海昶生物、天境生物等企业。
mRNA 作为疫苗,可以被广泛应用于:1)传染病领域。目前开发的传染 病 mRNA 疫苗主要针对流感、呼吸道合胞病毒、HIV 等。2)抗肿瘤领域。如:Moderna 的针对实体瘤的 mRNA-4157 与 BioNTech 的针对转移性黑 色素瘤的 BNT122。3)蛋白替代疗法领域。如 Moderna 公司用于治疗甲 基丙二酸血症(MMA)的 mRNA-3704 和治疗丙酸血症(Propionic Acidemia,PA)的 mRNA-3927 等。
国内临床进度以 I 期为主,多为新冠 mRNA 疫苗。目前,国内 mRNA 疫 苗研发整体进展偏早期,处于临床一期的共有 9 个,处于临床 I/II 期的共 有 2 个,处于临床 II期的共有 2 个,处于临床 III期的共有 2 个,处于临床 IV 期的共有 1 个。大部分都是针对新冠病毒开发的 mRNA 疫苗。
BioNTech
2008 年,BioNtech 成立于德国,公司未来发展战略为全球领先的癌症个 性化医疗生物技术公司。BioNtech 与赛诺菲、基因泰克、辉瑞等公司保持 长期合作,共同开发传染病与肿瘤 mRNA 疫苗。
公司拥有独特的四大技术平台。四大技术平台分别为:mRNA 疗法平台、细胞和基因治疗平台、蛋白质疗法平台和小分子治疗平台,涵盖肿瘤、传 染病和罕见疾病等领域。同时,公司与辉瑞、赛诺菲、基因泰克等知名大 型药企以及新兴等生物科技公司保持密切合作关系。
在研管线重点布局肿瘤领域。相比于其他公司,BioNTech 在肿瘤领域布局 的管线较为丰富,适应症包括头颈鳞癌、黑色素瘤、前列腺癌等。除此以 外,公司也布局传染性疾病领域,同样具备丰富在研管线。
Moderna
Moderna 成立于 2010 年,致力于开发以 mRNA 技术为基础的创新疗法。2018 年 12 月,Moderna 在纳斯达克上市,以每股 23 美元的价格募资超 6 亿美元,创造生物技术公司 IPO 募资新纪录。
公司研发实力雄厚。目前,公司拥有世界领先且自助完整的 mRNA 研发生 产平台,包括 mRNA 的改造、LNP 递送系统和生产平台。此外,Moderna 还与包括默沙东、阿斯利康、Vertex 在内的众多制药大企达成战略合作伙 伴关系,以加强推进自身 mRNA 技术在各疾病领域的研究布局。
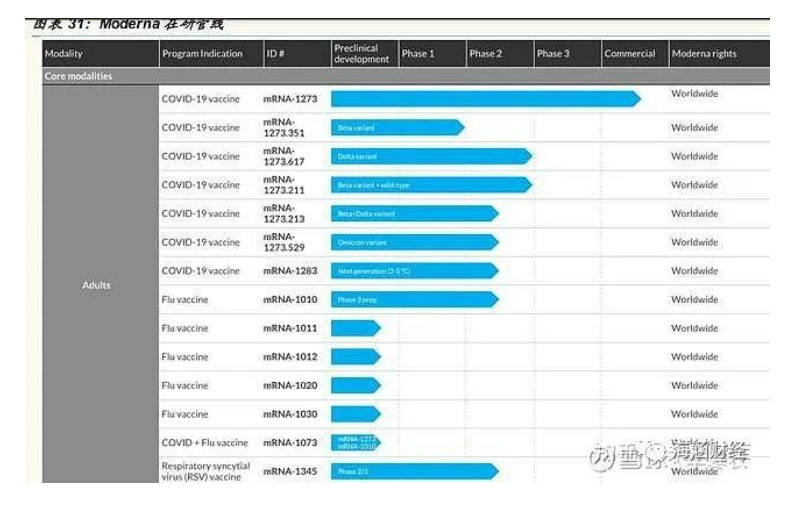
在研管线丰富。Moderna 在 mRNA 领域的研发实力雄厚,在研管线丰富。目前有 24 条管线同时推进,其中 12 个步入临床阶段,重点布局传染病、肿瘤、罕见病以及心血管疾病等领域。
CureVac
2000 年,CureVac 成立于德国,是 mRNA 药物技术领先的生物技术公司。公司拥有 20 年的专业经验,专注于癌症疗法、抗体疗法、罕见病治疗和 预防疫苗的开发。CureVac 的合作伙伴有勃林格殷格翰、礼来等、CRISPR Therapeutics、梅琳达〃盖茨基金会、CEPI等。
递送系统具备独特优势。CureVac 在递送系统方面具备独特优势,公司通 过和 Arbutus 合作引入了 LNP 技术;此外,公司也在不断加快自有 LNP 技术的研发进度。除此之外,公司还拥有基于聚合物的递送系统,采用专 有 PEG 化聚合物系统 CureVac 载体分子(CVCM),可以将治疗性候选药 物递送至眼和肺等器官。CureVac 的 mRNA 技术平台拥有十足的潜力。
具备差异化的在研管线。相比于 Moderna 和 BioNTech 的在研管线,CureVac 的在研管线并不算丰富,但具备一定差异化。目前公司已经覆盖 肿瘤、传染性疾病等领域,正在开发布局眼科、呼吸道疾病以及罕见病的 蛋白替代疗法等领域。

4 “十四五”医药工业规划出台,mRNA 疫苗供应链自主可控
“十四五”医药工业规划出台,提升 mRNA 及其供应链能力。“十四五” 医药工业发展规划明确指出,1)新型疫苗研发和产业化能力建设。紧跟疫 苗技术发展趋势,基于应对新发、突发传染病需求,支持建设新型病毒载 体疫苗、脱氧核糖核酸(DNA)疫苗、信使核糖核酸(mRNA)疫苗、疫 苗新佐剂和新型递送系统等技术平台,推动相关产品的开发和产业化;2)提高疫苗供应链保障水平。支持疫苗企业和重要原辅料、耗材、生产设备、包装材料企业协作,提高各类产品质量技术水平。因此,我们看好未来 5- 10 年内 mRNA 及上游供应链的投资机会。
商业化生产放量在即,看好 mRNA 上游供应链。mRNA 上游原材料主要 包括 DNA 质粒、酶、脂质以及分离纯化材料等。随着国产 mRNA 疫苗研 发进度的不断推进,如艾博生物与沃森生物合作的 mRNA 疫苗已经进入临 床 3 期阶段,若研发进展顺利,我们预计不久后将进入商业化生产阶段,对上游供应链的需求将大幅增加,因此我们看好 mRNA 疫苗及其上游供应 链的投资机会。
我会在 公众号:海涵财经 每天更新最新的医疗新基建、一体化压铸、 汽车智能化,激光雷达,HUD,车规芯片,空气悬挂、L3级智能驾驶、PET铜箔,纳电池,800V高压,光伏HJT、TOPCON、钙钛矿、光伏XBC、BIPV、IGBT芯片、碳化硅SIC、CTP/CTC/CTB电池、4680电池、工业母机、海风柔直高压、新能源车高压快充、高镍三元、碳纤维、PET铝箔、PET铜箔、空气源热泵、新材料、中药创新药、中药配方颗粒、乡村振兴、锂矿、钒液流电池、钠离子电池、分布式储能、集中式储能、抗原检测等最新题材热点挖掘,未来属于高预期差的结构性市场,把握核心赛道以及个股的内在价值逻辑预期差才是根本所在。












