谈一谈Fragment-Based Drug Discovery,水平有限,内容也较多,仅是浅谈。
分两部分,首先简单介绍FBDD,然后看看截至目前FBDD发现的上市药。
FBDD,基于片段的药物发现,核心是筛选分子片段库,得到合适的Fragment Hit,一般也把后续的片段生长、分子优化包含在内。如图1所示,FBDD主要用在Hit Identification及Hit to Lead两个阶段(尤其是Hit Identification阶段)。
图1也大致示意了FBDD的流程,即先要有一个片段库以供筛选,然后针对特定靶标通过合适手段进行筛选;找到Fragment Hit后,一般要解析出其共晶结构、确定结合模式,然后基于结构(SBDD)进行片段生长、分子优化等工作。
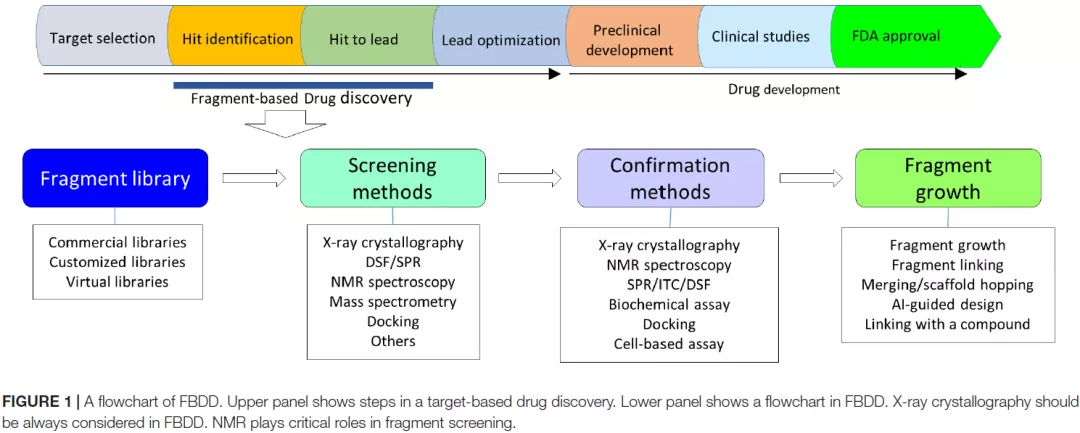
图1 FBDD用于药物发现的阶段及大致流程
筛选分子片段的优点:可以用较少的数目探索较大的化学空间;得到的Fragment Hit分子量小、配体效率较高,后续优化的空间大。
FBDD的缺点:片段活性低,筛选需要很灵敏的检测手段;后续需要大量的优化工作。
图2总结了一些筛选手段的检测灵敏度(Sensitivity),分子片段一般活性很低,需要X-ray结晶、NMR、Thermal Shift、SPR等手段,常规的酶活检测满足不了需求。
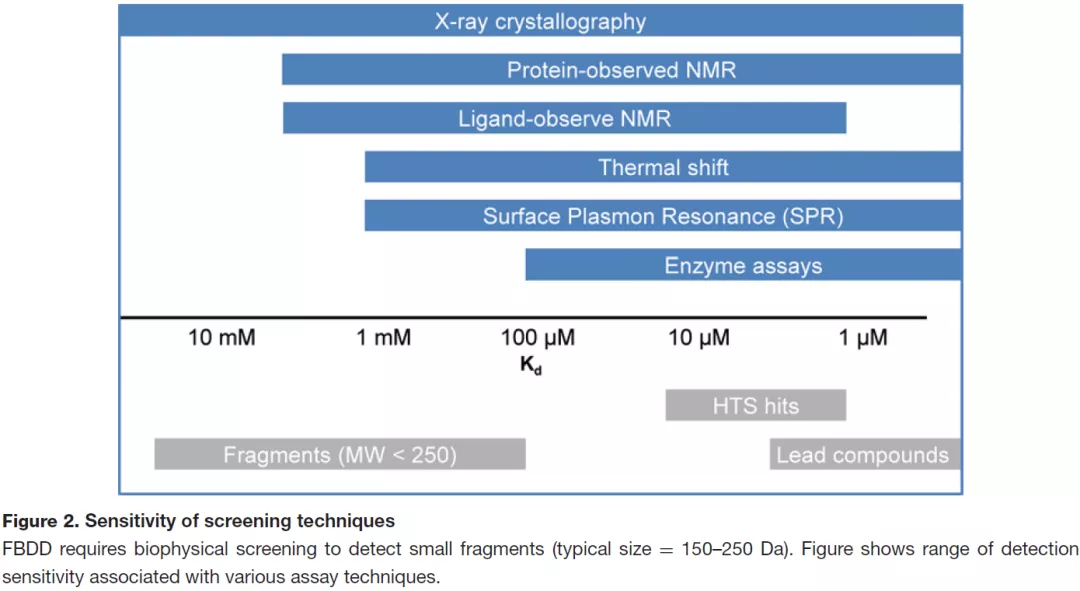
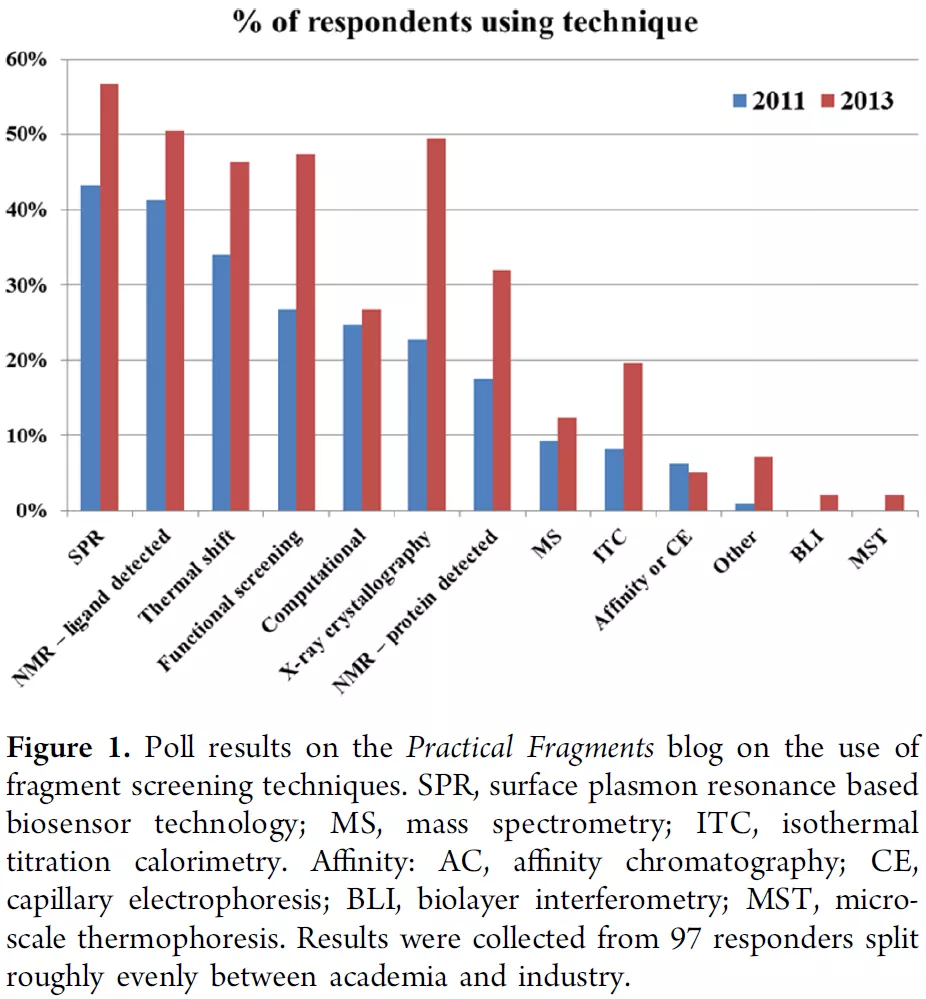
图2 部分筛选手段的检测灵敏度(Sensitivity)图3统计了FBDD中各种筛选手段使用的比例,数据有点老(2013年),其中图3a是问卷调查结果,图3b是文献统计结果。多数技术也不太了解,就不展开了。主要提两个吧:一个是X-ray,没错,它可以作为一种筛选技术,并且灵敏度很高(图2);当然,缺点是通量低,不过好处是直接获得了共晶结构,方便后续优化。另一个是Computational,计算,或者说(片段的)虚拟筛选,也是可能的;不过目前提到FBDD主要还是指实验筛选。
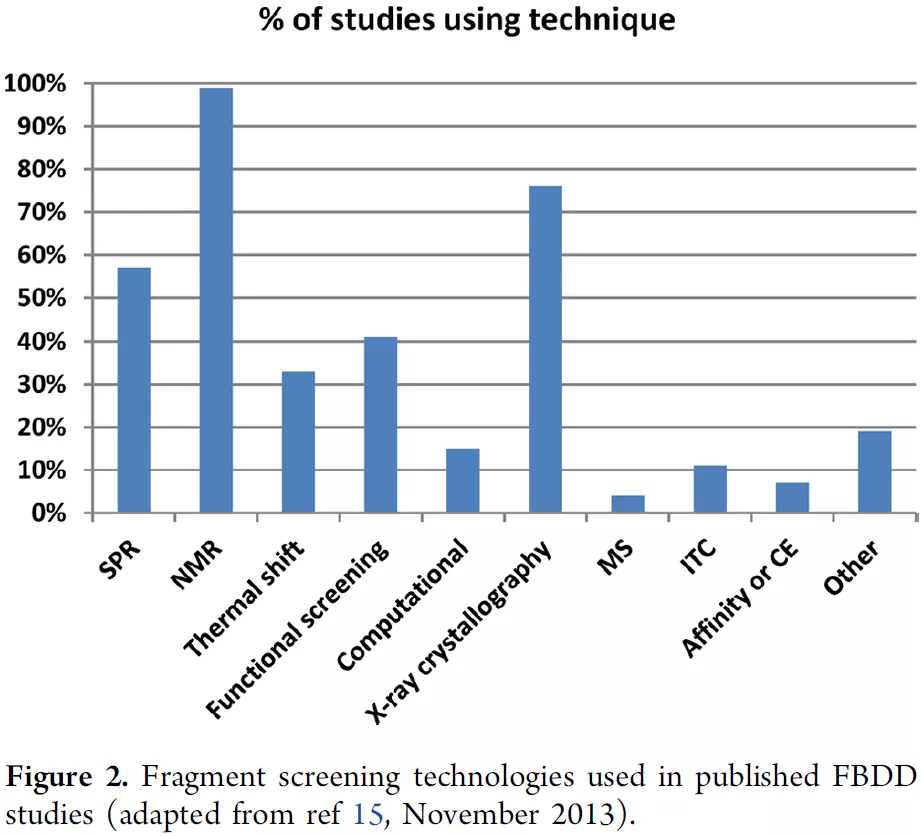
图3a/b 各种片段筛选手段的使用比例
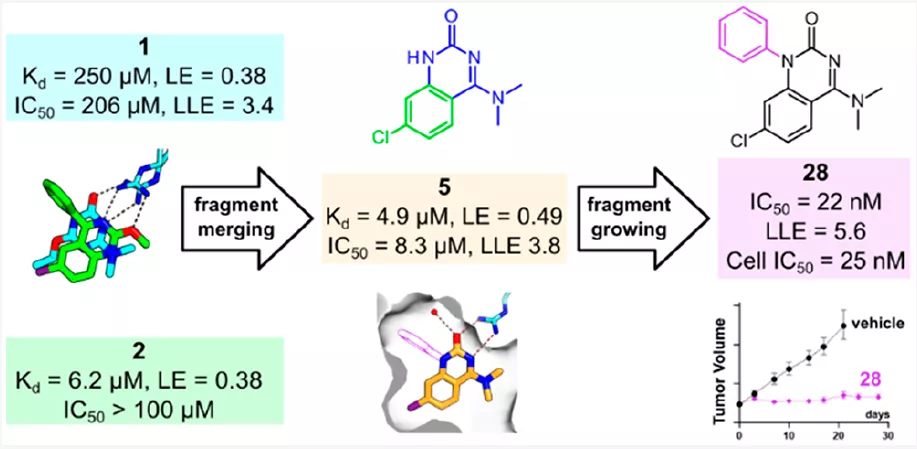
筛到Fragment Hit之后,还有大量的优化工作,主要方法包括片段生长、片段连接、片段融合。片段生长很好理解,可能也是最常用的,就是在Hit片段上继续添加基团、占据未占据的口袋空间,并形成新的相互作用、提高活性;片段连接也好理解,这需要同时筛到两个(或几个)占据口袋不同位置的片段,然后以合适的linker把它们连接起来、成为一个分子;片段融合也需要同时筛到不止一个片段,并且它们占据的空间有重叠,则有可能把这些片段的特征“融合”到一起,得到一个更大的分子片段。图4就是这样一个例子,其中第二步他们称为片段生长,但看起来也是片段融合。
图4 片段融合提高活性的一个例子
FBDD简介到此,下面看几个实例,可能也是截至目前FBDD方法发现的所有上市药(今年上市的KRAS抑制剂Sotorasib跟FBDD也有些关联)。
即图5总结的4个分子:一个Bcl-2抑制剂(Venetoclax, 2016),三个激酶抑制剂(见图)。
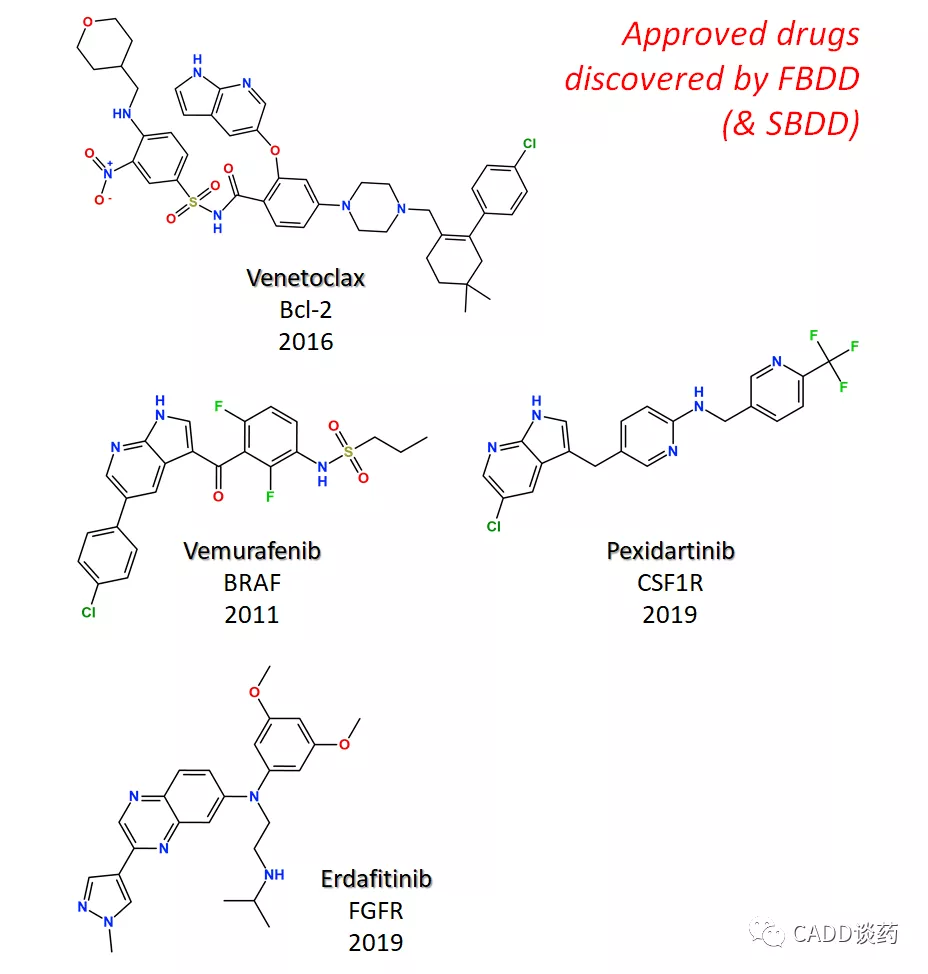
图5 截至目前FBDD方法发现的上市药
下面依次看看这4个分子的优化过程,需要说明的是,每个分子的优化都包含了大量艰巨的工作(Venetoclax是一个典型),篇幅有限,水平有限,不会展开,简单看看。
图6示意Bcl-2抑制剂Venetoclax的大致优化过程,这是一个难成药靶点(PPI),通过FBDD筛出了两个结合在口袋不同位置的片段。然后是漫长、艰巨的优化工作,包括片段连接、片段生长等方法,基于解析的共晶结构。最终得到的分子也比较巨大,但可以口服,也是bRo5一个典型例子。可以看到,经过重重优化,最终的分子结构中只保留了最初Fragment Hit的一些影子。
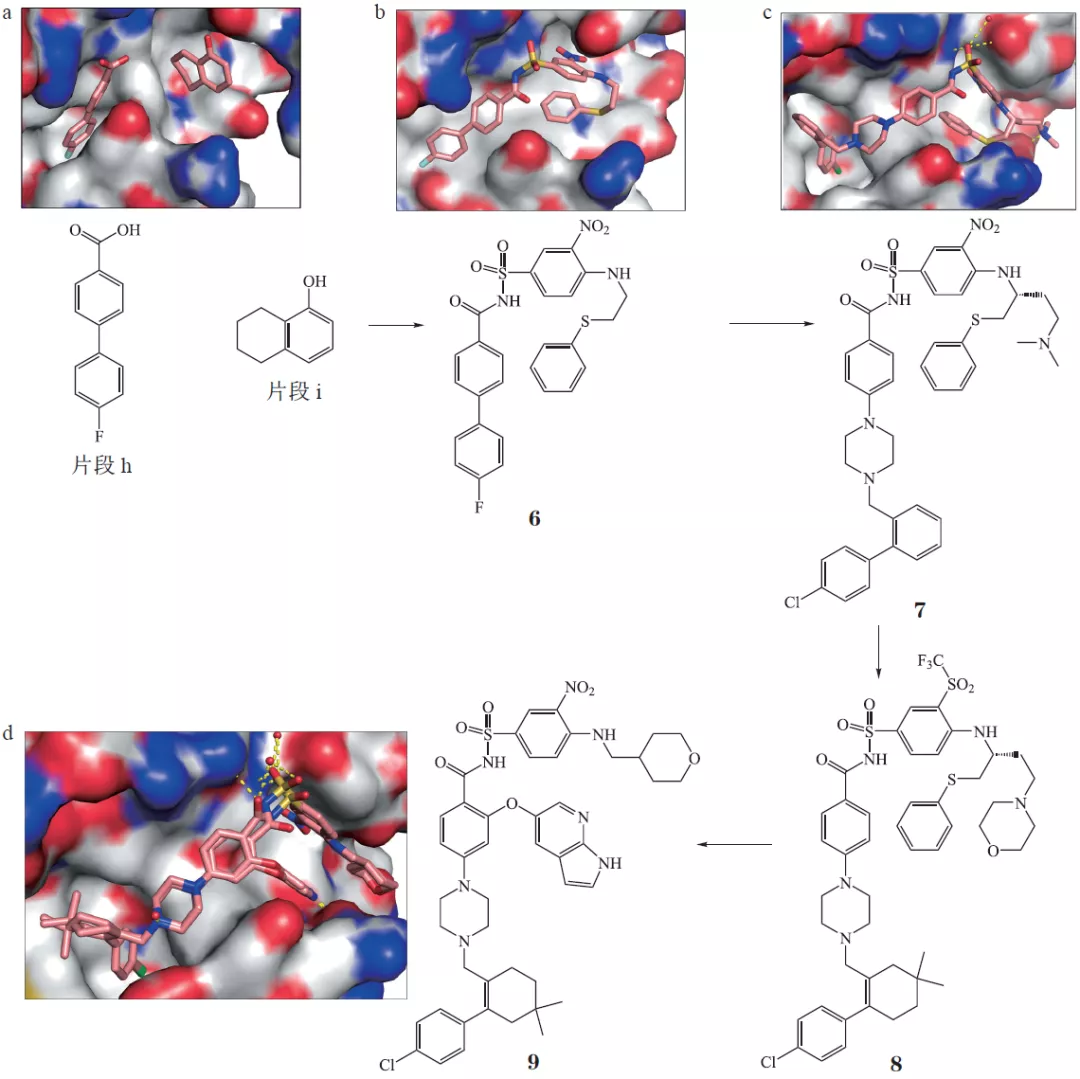
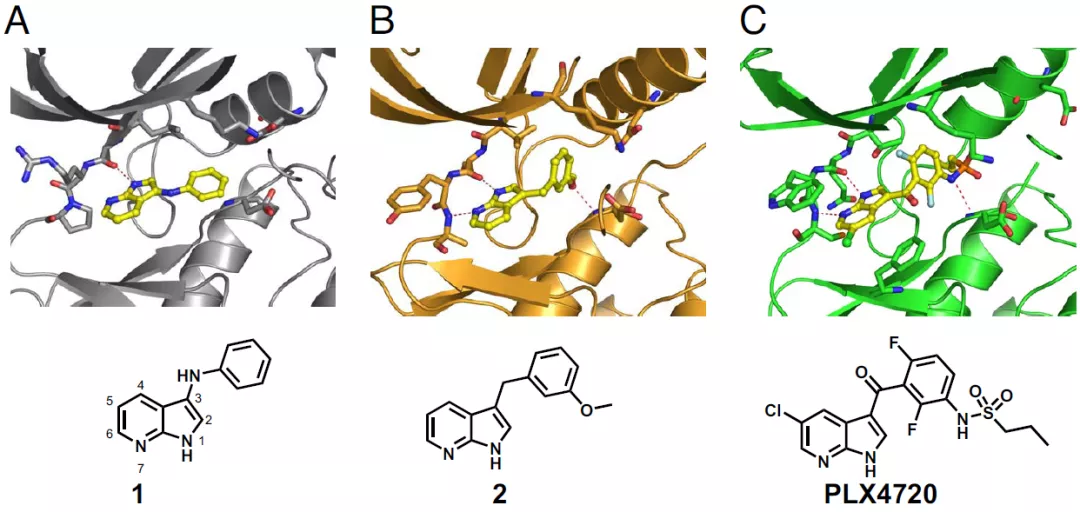
图6 Bcl-2抑制剂Venetoclax的大致优化过程图7示意BRAF抑制剂Vemurafenib的大致优化过程,其中图7a截自原研文献,图7b截自后来一篇综述,内容基本一致。图7a的片段1,是最初的Fragment Hit,后续优化中基本得到保留(linker有改变),其中N杂吲哚是母核。要注意图7a三个子图的激酶不同,分别为Pim-1、FGFR、BRAF。还要注意图7b,所画2D结构有点小问题(部分linker有误,可参照图7a)。
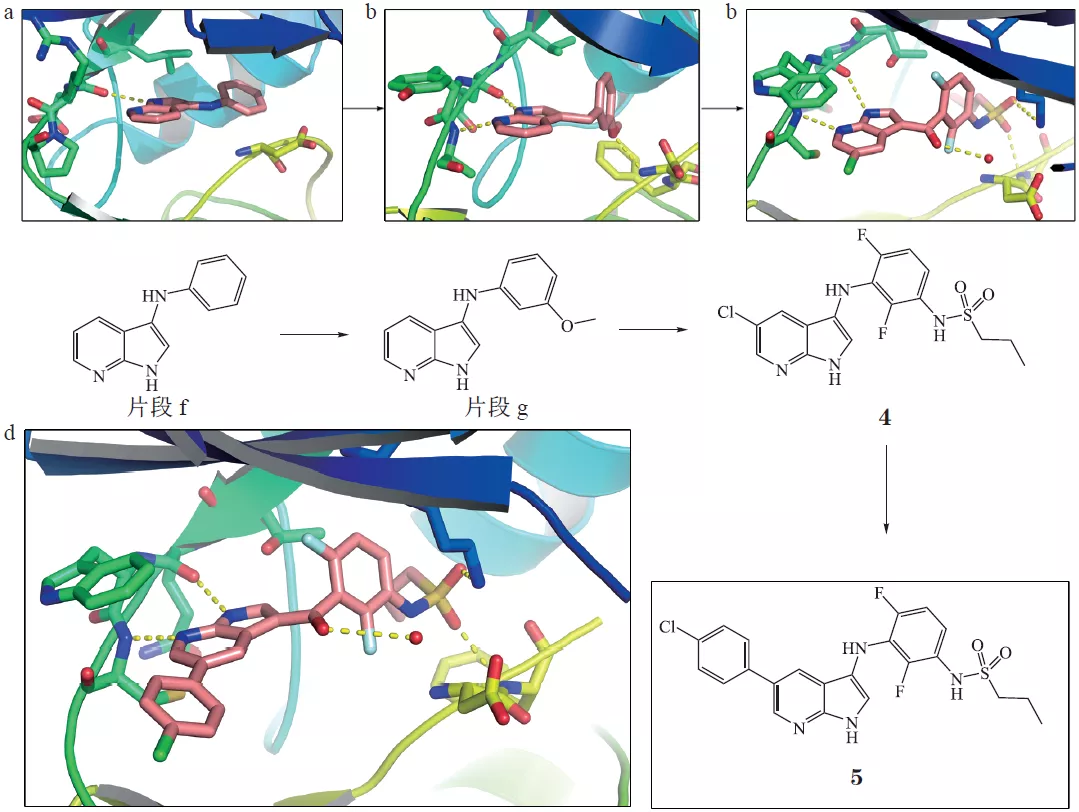
图7a/b BRAF抑制剂Vemurafenib的大致优化过程还是这家公司,用相同的母核(7-N杂吲哚),优化出另一个上市激酶抑制剂,Pexidartinib(CSF1R/FMS、KIT)。如图8所示,向上优化PLX4720得到Vemurafenib,向下优化PLX647得到Pexidartinib。
其实现在看,N杂吲哚是个很平常的激酶抑制剂母核,仅凭这个推出两个上市药,更多还是依赖后续的大量优化工作。
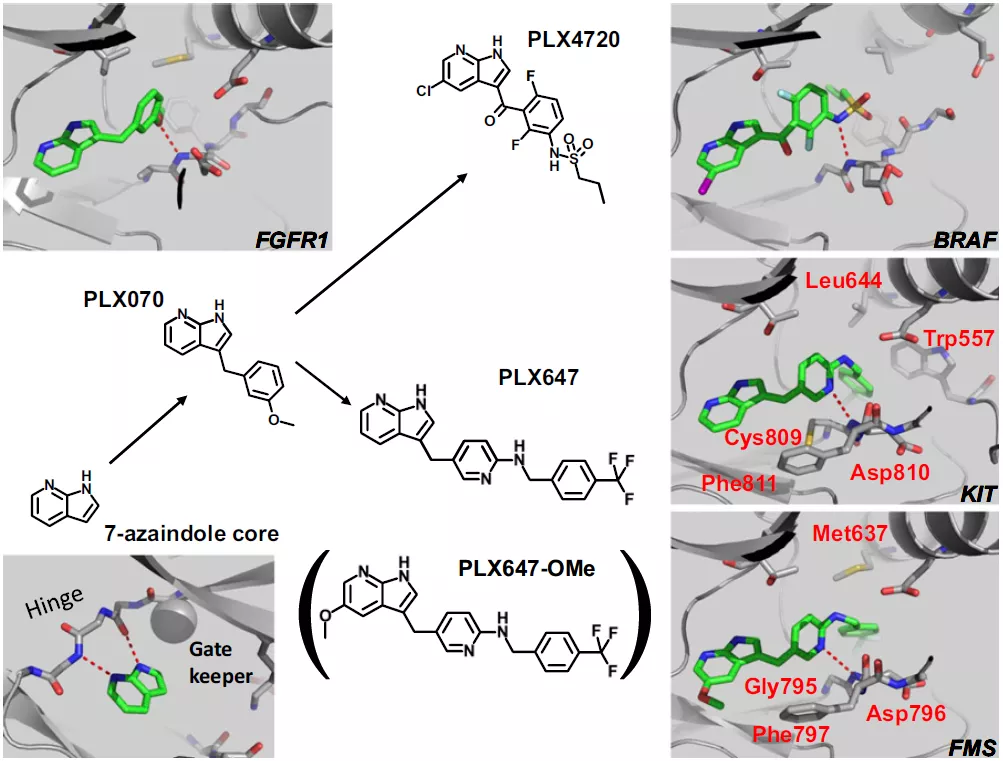
图9示意FGFR抑制剂Erdafitinib的大致优化过程,图9a可见一个典型的片段生长过程,其中Compound 1为Fragment Hit,对FGFR及VEGFR都有微弱活性,Compound 2活性有提高、选择性变差,Compound 3添加二甲氧基苯环,活性提高选择性提高;最后通过与另一个共晶分子的叠合(图9b),受启示延伸出靠下侧链,进一步提高活性选择性。
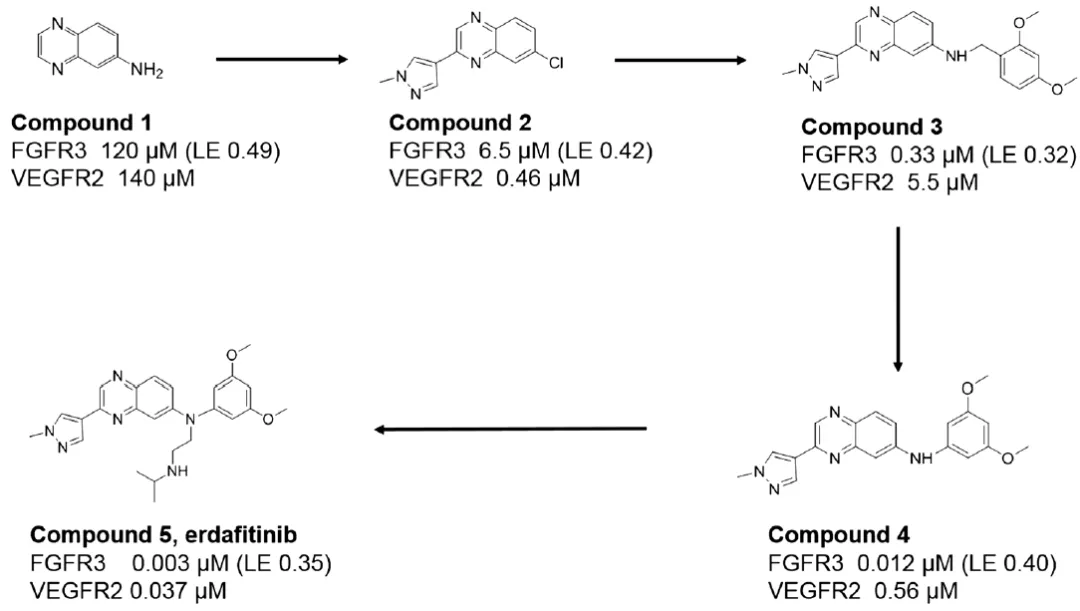

图9a/b FGFR抑制剂Erdafitinib的大致优化过程
小结
FBDD是一种行之有效的新药发现手段:优点是筛选较少片段可以覆盖较大化学空间,并且分子量小、无效基团少,为后续优化留足空间;缺点是筛选所用手段需很灵敏,而且后续需要大量的优化工作。此外,FBDD通常伴随SBDD(基于结构设计),也通常需要解析较多共晶结构,一方面可以作为筛选手段,另一方面也为SBDD提供结构基础。截至目前,通过FBDD(包括后续优化),已经有至少4个药物获批,未来还会有更多。但显然FBDD并不是完美无缺、无所不能,而是新药发现的手段之一。
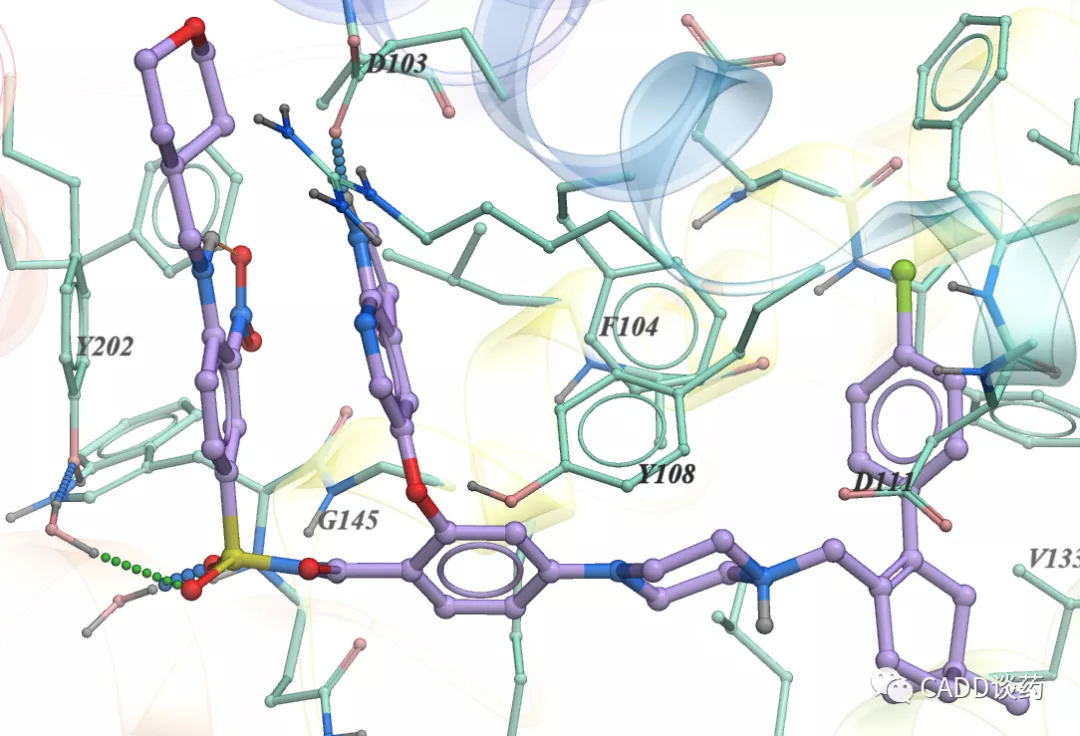
最后,附上这4个上市药分子与主靶点的共晶结构截图。分别为Venetoclax、Vemurafenib、Pexidartinib、Erdafitinib,2D结构请参见图5。
图10a Venetoclax结合Bcl-2 (6O0K)
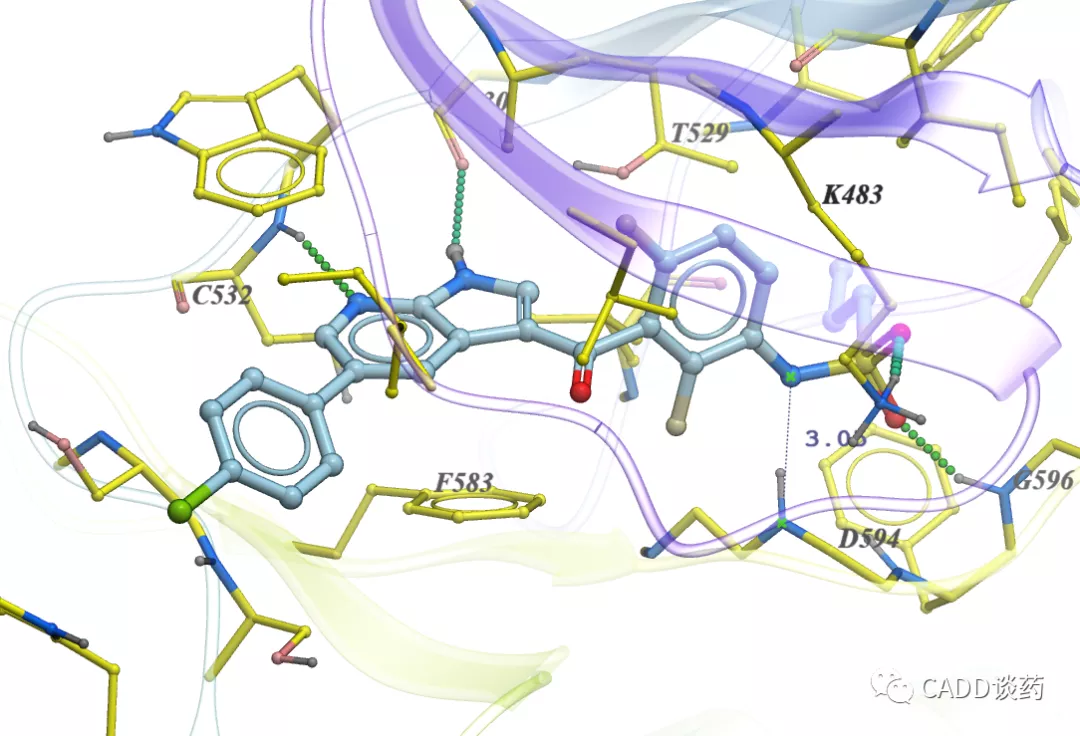
图10b Vemurafenib结合BRAF (4RZV)
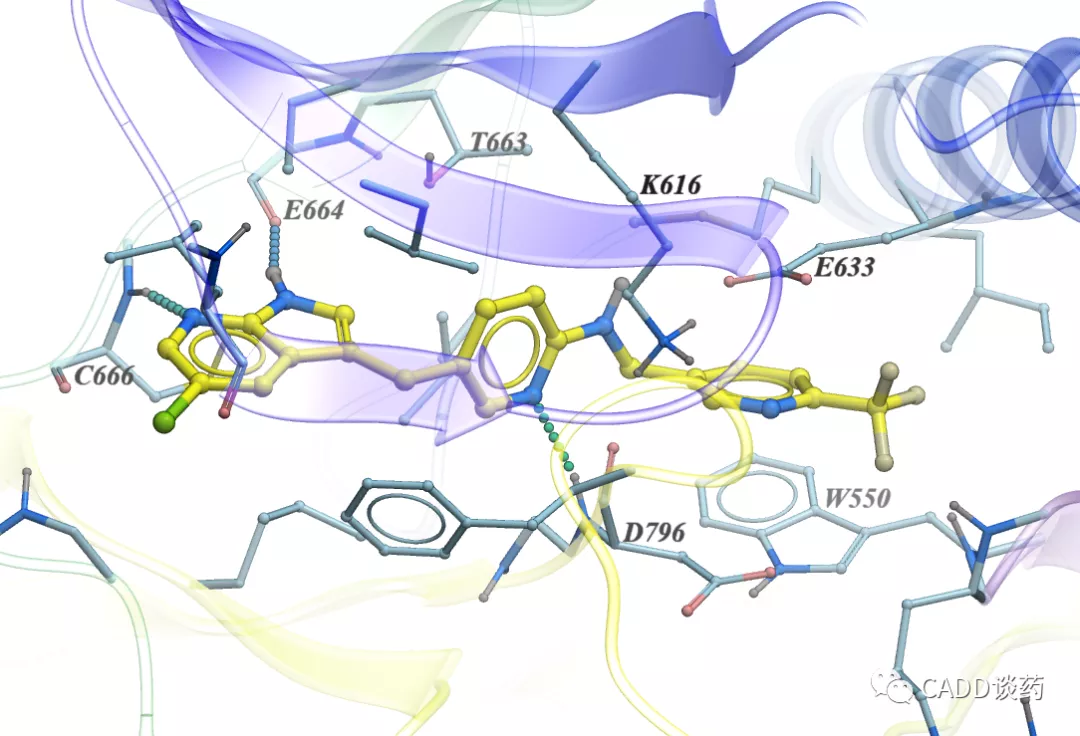
图10c Pexidartinib结合CSF1R (4R7H)
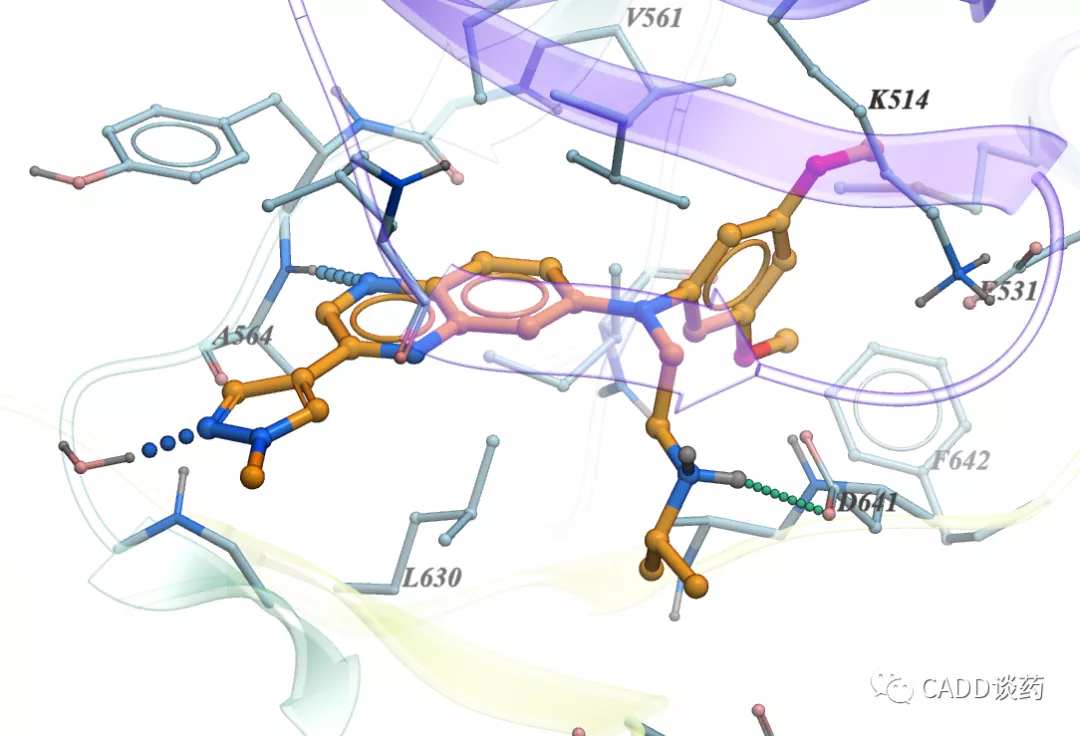
图10d Erdafitinib结合FGFR1 (5EW8)
凡图片右下角没有水印的,都截自文献。
基于片段的药物设计研究进展
本文摘自---药精通 Bio