药融圈监测显示:据统计,美国1~7岁花生过敏儿童约67万人,其中1~3岁幼儿28万人,4~7岁儿童39万人;欧洲1~7岁花生过敏儿童约61.5万人,且每年新增诊断病例约8.1万人。全球儿童花生过敏市场存在显著未被满足的治疗需求。传统治疗方式有口服免疫疗法、抗IgE单克隆抗体,但传统疗法存在剂量调整复杂、需频繁就医、有注射恐惧或不良反应风险等痛点,90%的过敏科医生认为需要更多儿科花生过敏治疗选择。
2002年,两位儿科医生、一名工程师以开发出一种能避免传统注射或口服脱敏疗法风险的新型免疫疗法为愿景,在法国创立了DBV Technologies。2012年3月公司在巴黎泛欧交易所主板完成IPO,股票代码DBV;2014年10月公司又以发行美国存托股份(ADS)的方式登陆纳斯达克。
自创立以来,DBV Technologies就便摒弃广撒网策略,全力押注表皮免疫疗法(EPIT),EPIT将过敏原递送至表皮上层,借助皮肤免疫特性逐步诱导耐受,该疗法无需口服或注射,从源头降低传统疗法的全身不良反应风险。与口服脱敏(OIT)相比,EPIT 免除每日进食、剂量递增及剧烈运动禁忌,显著减少严重过敏反应,更适用于生理心理尚未发育成熟的婴幼儿。
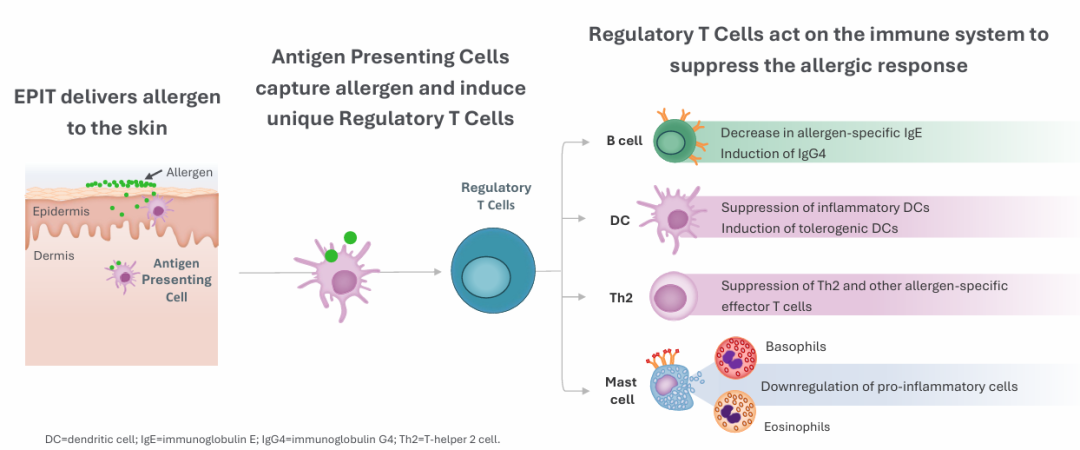
公司推出的Viaskin贴片,可经完整皮肤将过敏原(如花生蛋白)递呈给免疫系统,最大限度减少入血,降低全身过敏反应风险。这一“贴片式脱敏”理念在当时属首创。其药械组合设计采用冷凝干燥腔结构,实现过敏原稳定释放与经皮吸收:每日仅需250 μg花生蛋白(约相当于1/1000颗花生),即可维持长期脱敏效果。
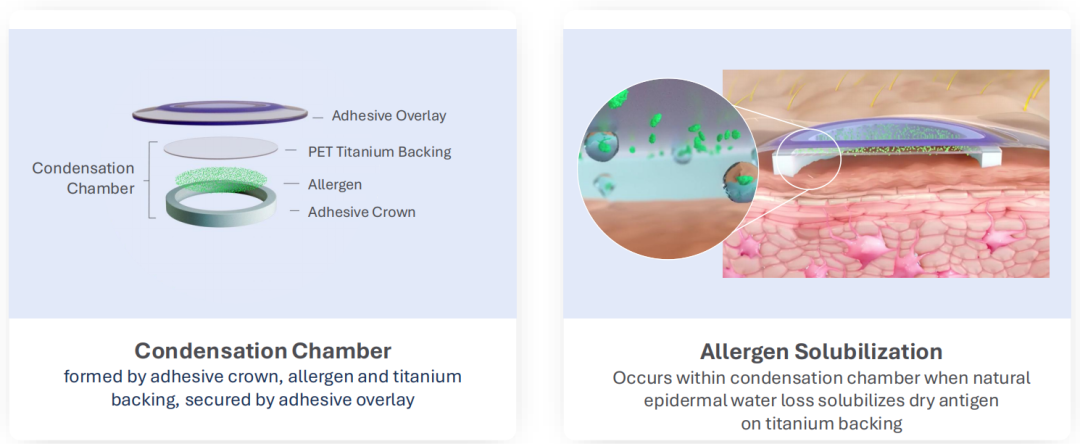
目前,DBV Technologies已围绕该技术构建完整知识产权矩阵,覆盖贴片核心结构、作用机制及生产工艺,并在美、欧、澳等多国获得专利保护,核心专利经延长后预计2034年到期。
DBV Technologies的Viaskin花生贴片针对1~3岁幼儿和4~7岁儿童两大关键年龄段,设计了两款差异化产品方形贴片与圆形贴片,形成双轨并行的研发与商业化布局。其中,方形贴片针对1~3岁幼儿,圆形贴片面积比方形贴片大50%,针对4~7岁儿童,两款产品剂量一致,都是250μg花生过敏原提取物。
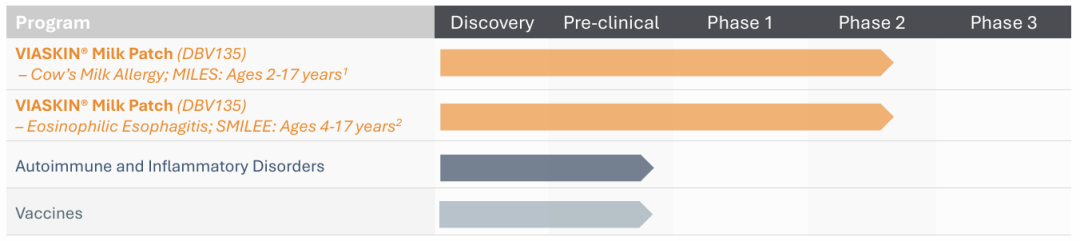
另外,公司还在拓展Viaskin技术的应用边界,布局了牛奶过敏、嗜酸性食管炎等适应症的研发管线,长期致力于挖掘技术平台的全场景潜力。
1、针对1~3岁幼儿
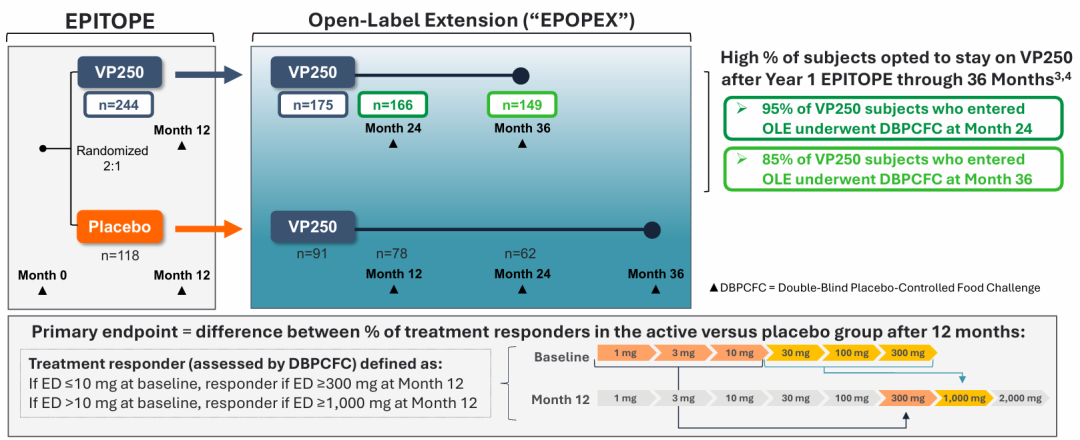
EPITOPE试验是一项针对1~3岁幼儿的临床试验3期研究,结果显示,治疗12个月后,67.0%的活性组受试者达到应答标准,显著高于安慰剂组的33.5%,且64.2%的受试者实现≥1000mg花生蛋白的耐受剂量,是意外暴露典型剂量的8倍以上。
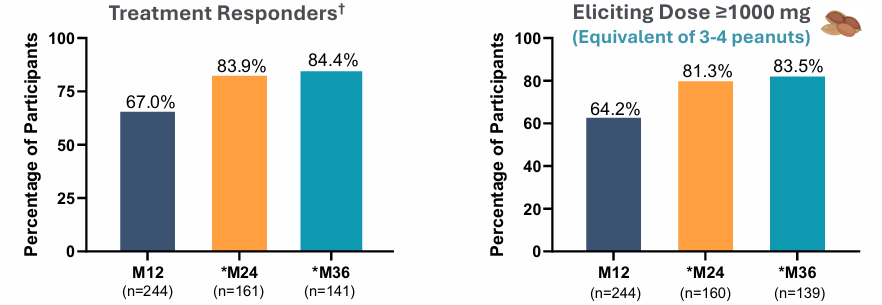
后续的EPOPEX开放标签延伸研究显示,治疗持续至36个月时,应答率进一步提升至84.4%,83.5%的受试者耐受剂量≥1000mg,安全性表现持续稳定,严重治疗相关不良事件发生率仅0.6%,无治疗相关过敏反应报告。针对该年龄段的COMFORT Toddlers补充安全性试验已在2025年6月启动,计划招募300~350名活性治疗受试者,预计2026年下半年完成BLA提交。
2、针对4~7岁儿童
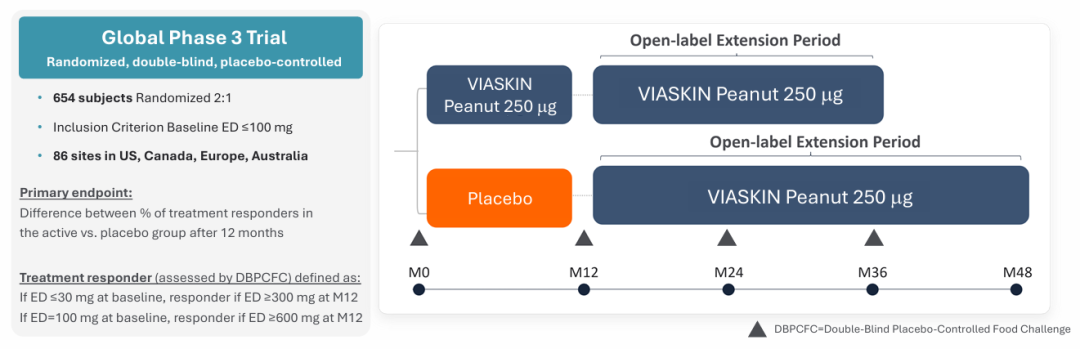
VITESSE试验是一项临床试验3期研究,这项针对4~7岁花生过敏儿童的研究为期12个月,旨在评估Viaskin花生贴片的有效性和安全性,共纳入654名受试者,随机分组比例2:1,覆盖美国、加拿大、欧洲、英国和澳大利亚86个研究站点。2025年11月11日,DBV宣布VITESSE试验已完成最后一名患者随访,按照当前进度,仍计划在今年第四季度公布VITESSE试验的顶线数据。
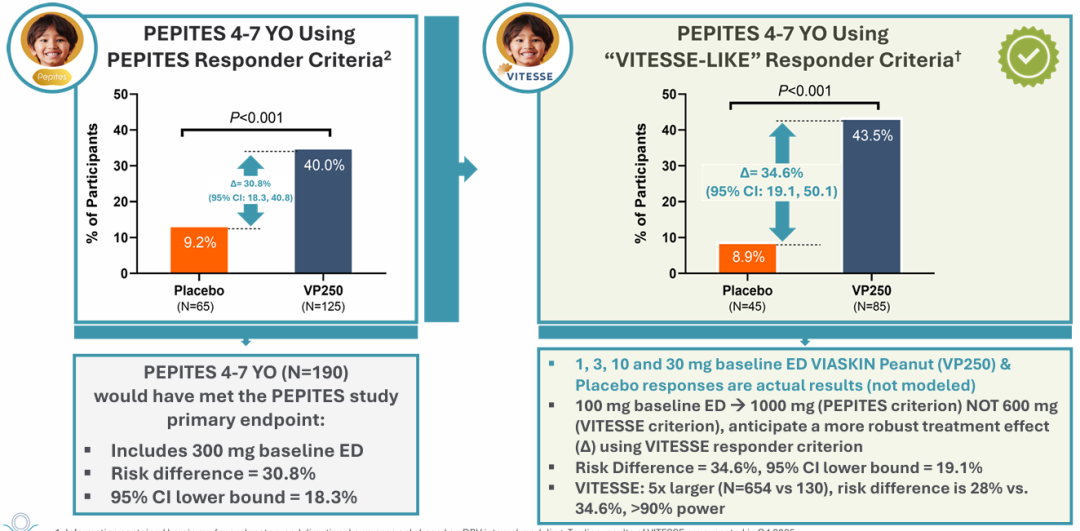
VITESSE试验参照了此前的PEPITES试验分析,PEPITES结果显示,4~7岁儿童使用Viaskin花生贴片的应答率达到40.0%,显著高于安慰剂组的9.2%,为VITESSE试验提供了坚实的数据支撑。值得一提的是,2025年3月,FDA已确认VITESSE试验的安全性数据足以支持BLA提交,无需额外开展COMFORT Children补充安全性试验,公司计划在2026年上半年提交BLA,预计在获得FDA批准的情况下,有望将产品上市时间提前约1年。
分地区来看,在美国市场,Viaskin花生贴片已获得FDA突破性疗法认定,4~7岁儿童适应症已确定BLA提交路径,预计2026年上半年提交申请,且有望获得优先审评资格;1~3岁幼儿适应症已与FDA达成加速审批路径共识,EPITOPE试验数据被认定为符合加速审批要求的中间临床终点,BLA提交预计在2026年下半年完成。在欧洲市场,EMA已提供MAA指导,明确1~7岁儿童适应症的MAA需包含VITESSE试验、EPITOPE试验及一项针对1~3岁幼儿的新增安全性研究数据。公司计划在相关数据完善后重新提交MAA,推动产品在欧洲市场的上市。
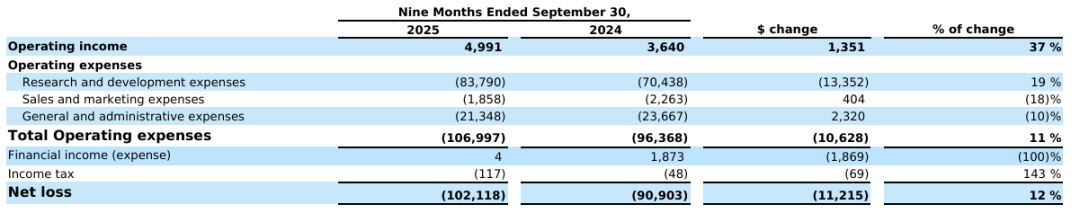
2025年前三季度,DBV Technologies产生了500万美元的营业收入,上年同期只有360万美元,同比增长37%;研发费用为8379万美元,与上年同期相比增加了1340万美元;销售和市场营销费用为186万美元,与上年同期相比减少18%;一般和管理费用为2135万美元,与上年同期相比减少10%。总的来看,今年前三季度净亏损1.021亿美元。
DBV Technologies通过多轮融资为研发及商业化提供资金支持。2025年3月完成的融资交易共筹集初始资金1.255亿美元,若所有认股权证全额行使(取决于VITESSE试验顶线数据),可额外获得1.814亿美元资金,总计融资规模达3.069亿美元。截止2025年9月30日,DBV Technologies的现金及现金等价物为6980万美元。结合后续可能的ATM发行募资(已获批最高1.5亿美元额度),足以支撑至2026年第三季度的运营需求,覆盖BLA提交及上市前准备工作。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China