CRISPR/Cas系统是继锌指核酸酶和TALENs技术之后的第三代基因编辑技术,也是目前最为主流的基因编辑系统,因其能够以高精度,快捷、低成本地进行基因编辑,在生物技术和医学领域被认为具有重要意义,2015年《科学》将它评为年度十大突破之首。该技术可应用于开发新药、农产品、转基因生物等,或作为控制病原体和害虫的手段,还有潜力治疗遗传性疾病,以及由体细胞突变引起的疾病(如癌症)。
CRISPR/Cas系统可以说是源于大自然的“基因魔剪”,它是生命进化历史中,微生物用来抵抗病毒等外源遗传物质入侵的一种获得性免疫系统。这与哺乳动物的二次免疫类似,一些细菌在遭受过病毒入侵后,能够将病毒基因组中的一段序列存储到自身基因组中一段被称为“CRISPR”的序列中,当再次遇到病毒入侵时,细菌能够根据先前存储的片段识别病毒,并剪切病毒基因而使之失效。
CRISPR意为“成簇规律间隔短回文重复序列”(clustered regularly interspaced short palindromic repeats),是最初在大肠杆菌、古细菌等原核生物中被发现的DNA序列家族。在基因组中,该序列往往还伴随着一组同源基因,即Cas基因(CRISPR-associated systems)。Cas基因编码的Cas蛋白(Cas核酸酶)与CRISPR序列共同发挥作用,因此Cas蛋白与CRISPR序列一起,构成了CRISPR/Cas系统。其中应用最为广泛的是Cas9蛋白,即CRISPR-Cas9基因编辑技术。
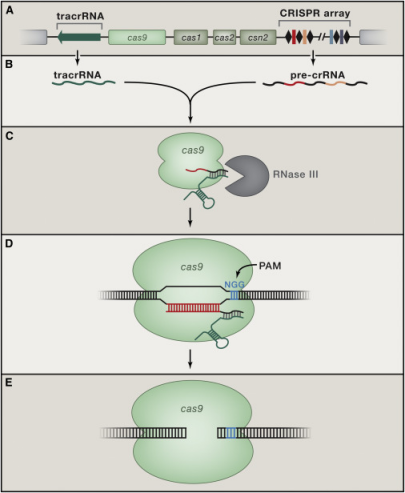
▲CRISPR-Cas9系统作用机制 图源:Cell
Jennifer Doudna是一名美国生物化学家,2020年她和法国微生物学家Emmanuelle Charpentier凭借对CRISPR基因编辑技术的贡献,获得了诺贝尔化学奖。

▲Jennifer Doudna 图源:Marcus Hanschen
在Doudna职业生涯的早期,她致力于推断RNA分子的三维结构,这让她对RNA分子的催化活性具有深刻的见解。后来她研究了某些小RNA(small RNAs)对遗传信息的调控作用,并对CRISPR产生了兴趣。2011年,在波多黎各的一次科学会议上,Doudna遇到了当时在瑞典工作的Emmanuelle Charpentier,两人“一拍即合”,并就解析Cas9蛋白的结构和功能开始了深度合作。2012年,Doudna和Emmanuelle Charpentier共同提出CRISPR-Cas9系统可用于基因组的可编程编辑,这被认为是生物学史上最重要的发现之一。从那时起,Doudna一直是“CRISPR革命”历程中的领军人物。
2000年,Jennifer Doudna因利用X射线晶体学技术确定核酶的结构而获得Alan T. Waterman奖;2015年,Doudna和Charpentier二人因CRISPR-Cas9基因编辑技术获得生命科学突破奖,同年获得格鲁伯遗传学奖,并被《时代》周刊评为2015年全球最具影响力100人。此外,Doudna还是台湾的唐奖(2016)、加拿大盖尔德纳国际奖(2016)、和日本奖(2017)的共同获得者。美国历史学家兼记者Walter Isaacson为Jennifer Doudna撰写了一本传记:The Code Breaker: Jennifer Doudna, Gene Editing, and the Future of theHuman Race,该书于2021年出版。
Jennifer Doudna不仅是著名科学家,也是一名连续创业者。她与合作者联合创立了多家生物技术公司以将CRISPR基因编辑技术商业化。
Caribou Biosciences由Doudna等人创立于2011年,是一家处于临床阶段的生物制药公司,该公司致力于利用CRISPR-Cas9系统,为多种癌症开发基因组编辑同种异体细胞疗法,如CAR-T和CAR-NK细胞疗法。

2013年9月,Jennifer Doudna曾与华人科学家张锋等人共同创立了Editas Medicine,这是一家利用CRISPR基因编辑技术开发罕见病疗法的公司,但由于二人的专利纠纷,2014年6月Jennifer Doudna离开了Editas Medicine。在这之后,Emmanuelle Charpentier曾邀请Doudna加入其联合创办的CRISPR Therapeutics,该公司基于CRISPR-Cas9技术开发基因编辑治疗药物。不过在Editas经历了类似“离婚”的体验后,Jennifer Doudna拒绝了Charpentier的邀请。
2014年,Caribou Biosciences与风险投资公司Atlas Venture联合成立了一家新的基因编辑公司Intellia Therapeutics,该公司获得了Caribou Biosciences的专利许可,正在使用模块化基因组编辑平台,为遗传病开发基于CRISPR-Cas9的药物,并开发新的工程化细胞疗法用于癌症和自身免疫性疾病,Doudna为联合创始人之一。

Scribe Therapeutics由Jennifer Doudna联合创立于2018年,是一家分子工程公司,通过开发新型CRISPR技术平台和递送技术,克服当前基因组编辑技术的局限性,为那些具有严重未满足医疗需求的疾病开发突破性疗法。该公司的新型核酸酶CasX更加紧凑,且可成功应用于基因编辑。

2017年6月,Jennifer Doudna联合创立了Mammoth Biosciences,与前述几家公司不同的是,Mammoth创办之初致力于将CRISPR技术应用于疾病诊断,据了解,该公司开发了全球首个基于CRISPR的检测平台,期望通过按需诊断普及疾病检测。现在Mammoth还将CRISPR用于治疗用基因组编辑技术的开发,并开发新型Cas蛋白,帮助开发永久性基因治愈疗法。Mammoth可以为生命科学研究、医疗保健、农业、生物防御等提供增强的诊断和基因组编辑技术。

Mammoth的联合创始人还包括Trevor Martin、Janice Chen和Lucas Harrington。这三位虽然年轻,在创办该公司时都还不到30岁,但均是行业资深的研究者。他们曾一同入选2018年福布斯医疗健康“30under 30”榜单,也是2020年Business Insider评选的全球30名40岁以下生物医药行业青年领军人物。
CEO Trevor Martin在斯坦福大学获得计算生物学博士学位时就对诊断学产生了兴趣,他最初与Jennifer Doudna通过邮件建立了联系,表明有意基于Doudna团队开发的DETECTR技术共同创办一家公司,Mammoth Biosciences由此诞生;
CTO Janice Chen是Doudna的学生,她正是DETECTR技术的开发者之一(她还是2022年北京冬奥会花样滑冰男单冠军陈巍的姐姐);
CSO Lucas Harrington也是Doudna的学生,是CRISPR-Cas14系统的发现者之一。

DETECTR技术:DETECTR技术基于CRISPR-Cas12a系统,Doudna团队发现CRISPR-Cas12a系统在剪切靶向的双链DNA的同时,Cas12的DNA酶活性会被激活,而该酶能非特异性切割单链DNA(ssDNA)。这为细胞内检测是否含有特定DNA序列提供了一个全新的思路:同时向细胞内递送靶向该DNA的CRISPR-Cas12a系统和非特异性ssDNA荧光报告基因(FQ-labeled reporter),一旦检测到目标DNA,CRISPR-Cas12a系统将被激活,同时荧光报告基因也会被降解,从而释放出荧光信号。基于此发现,该团队开发了一种可用于诊断病毒感染的新型诊断工具,并通过与等温核酸扩增技术的联用提高了灵敏度,最终命名为“DETECTR”(DNA Endonuclease Targeted CRISPR Trans Reporter)。
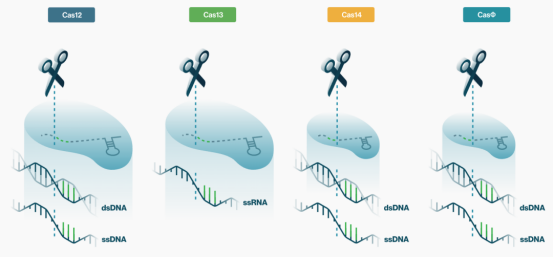
CRISPR-Cas14系统:Doudna团队发现的Cas14序列家族编码的Cas14蛋白大小仅为40-70kDa,Cas14能够结合并剪切单链DNA上的目标序列,与Cas9不同,Cas14不需要依赖PAM序列,除了这种顺式切割,Cas14还能够不加选择地反式切割单链DNA,类似于Cas13和Cas12。他们还发现Cas14在识别单链DNA方面比Cas13或Cas12更具特异性。
根据官方信息,目前Mammoth的工作分为4个方面:基于CRISPR的SARS-CoV-2检测解决方案、基于CRISPR的分子诊断平台、基于CRISPR的精准基因编辑疗法开发、探索新的CRISPR-Cas系统。
SARS-CoV-2检测解决方案:
Mammoth最新开发的DETECTR BOOST®平台是一个基于CRISPR的一站式分子诊断系统,可实现高通量、从样本到结果的一站式检测,其性能与PCR等效,并可大幅缩短操作时间。2022年1月,其DETECTR BOOST® SARS-CoV-2试剂盒获美国FDA授予的紧急使用授权(EUA),目前已授权与安捷伦Bravo BenchCel DB自动化液体处理平台结合,用于检测疑似COVID-19个体的鼻咽或口咽拭子样本中的SARS-CoV-2RNA,这是首个将CRISPR技术与实验室自动化SARS-CoV-2检测相结合的高通量解决方案。利用该诊断系统可在每8小时轮班内完成1500次检测,且只需要一小时的人工操作。
值得一提的是,在需求激增、耗材短缺的背景下,Mammoth团队努力将试剂盒设计得精简高效,并与默克公司进一步优化产品配方,该试剂盒已签约由默克负责制造。
不过在诊断领域,Jennifer Doudna和张锋又一次“狭路相逢”,张锋团队曾利用CRISPR-Cas13系统开发了名为“SHERLOCK”的病毒检测系统,并于2019年联合创立了Sherlock Biosciences,其Sherlock™ CRISPR SARS-CoV-2试剂盒也已获得美国FDA的紧急使用授权,这是FDA首次批准基于CRISPR基因编辑技术的新冠病毒检测产品,也是首次授权使用CRISPR技术进行传染病检测。Cas13系统是由张锋和Eugene Koonin使用计算生物学方法发现的,后由Jennifer Doudna在加州大学伯克利分校的团队进一步表征。
分子诊断平台:
Mammoth的分子诊断平台也是基于DETECTR®技术,可应用于单核苷酸多态性(SNP)检测、细菌感染检测、癌症筛查和分析、抗生素耐药性检测、病毒感染检测。该技术可搜索样本中是否存在指定疾病的特定核酸,提供可操作的临床信息。该检测系统利用经编程的CRISPR核酸酶捕获到特定的基因序列,找到目标序列后,核酸酶的剪切能力会被激活,从而产生信号,出现该信号意味着已检测出目标序列。
Mammoth在创立之时,其目标就是创建一种即时诊断工具,可以检测多种疾病,可供医院和家中使用,并且具有可支付性。现在该公司的DETECTR®平台可以通过扩展检测项目集成到不同的产品中,简单、快速、可编程。
精准基因编辑疗法开发:
Mammoth正在利用其蛋白质发现平台中的新型CRISPR-Cas酶来实现精准的基因编辑以治疗疾病。该公司的超小型Cas14和CasΦ核酸酶家族克服了Cas9对病毒和非病毒递送方法的限制,并改变了对PAM序列的要求,有望成为治疗用基因编辑系统的候选者。潜在治疗领域有免疫肿瘤学、自身免疫性疾病、肝靶向疾病、血液病、眼科、神经病学、神经肌肉疾病、心血管疾病等。
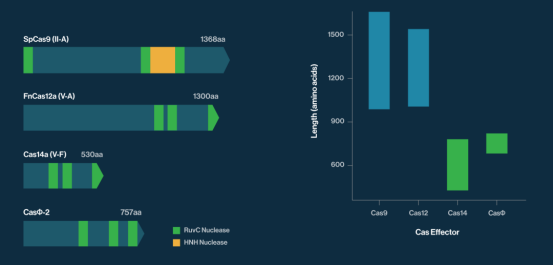
下图左比较了Cas14a和CasΦ-2核酸酶和较常用的Cas9和Cas12核酸酶结构域(RuvC和HNH),蛋白质长度按比例绘制;下图右比较了Cas14a-c和CasΦ系统和Cas12a-e和Cas9系统的长度分布:
发现新CRISPR-Cas系统:
Mammoth正在利用其专有的蛋白质发现平台来识别新的Cas蛋白以应对当前CRISPR-Cas系统面临的挑战,扩大CRISPR-Cas技术应用范围。该公司的蛋白质发现平台包含独家宏基因组数据库和机器学习算法,以搜寻新的CRISPR-Cas系统。新的CRISPR-Cas系统可以有效避免专利纠纷
该发现过程分为4个步骤:
从环境样本中获取微生物DNA进行测序;
将“宏基因组”序列在数据库中进行编译;
利用算法在数据库中检索识别CRISPR系统的序列;
在实验室对CRISPR系统进行合成和检测。
新发现的Cas蛋白创建了一个多样化的工具包,实现新的应用。目前,Mammoth已经识别出了新的Cas蛋白家族,包括Cas12、Cas13,以及超小型的Cas14、CasΦ。这些Cas蛋白具有更好的热稳定性、更快的反应动力学、可替代的PAM序列,提供了更灵活的靶向性,且蛋白质尺寸更小,从而开辟了新的细胞递送选择。该公司可以利用这些特性进行更快、更灵敏的分子诊断检测,并为细胞和基因治疗提供有效的DNA嵌入片段。
融资与合作:
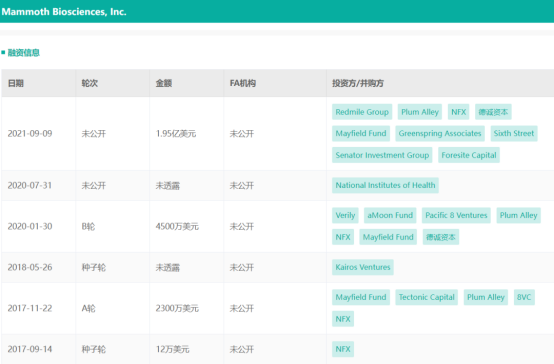
药融圈旗下药融云数据www.pharnexcloud.com显示,截至目前,Mammoth Biosciences累计已完成6轮融资。最近一轮融资是在2021年9月,Mammoth获得了1.95亿美元的新融资(相关阅读:CRISPR先驱创立,专注开发分子剪刀的Mammoth Biosciences成为独角兽),该轮融资包括由Redmile Group领投的1.5亿美元D轮融资,以及2020年末由Redmile Group和Foresite Capital领投的4500万美元C轮融资。融资完成之后,Mammoth估值超过10亿美元,正式跻身“独角兽”行列。
▲药融云数据库
下图为Mammoth Biosciences主要投资方:

在治疗领域:2022年1月,拜耳与Mammoth Biosciences官宣合作,旨在利用Mammoth的CRISPR系统共同开发体内基因编辑疗法。根据协议条款,Mammoth公司将获得4000万美元的首付款,并有资格获得目标期权行权费用以及超过10亿美元的未来潜在里程碑付款。协议涉及5个预先选择的适应症,其中首先关注肝脏靶向疾病。此外,拜耳将支付研究经费以及分层特许权使用费,最高可达净销售额的两位数百分比。两家公司还正在非排他性基础上探索体外项目相关工作;
2021年10月,Vertex Pharmaceuticals和Mammoth Biosciences宣布达成一项新合作,旨在利用Mammoth的超小型CRISPR系统共同开发治疗两种遗传疾病的体内基因编辑疗法。根据协议条款,Mammoth将获得4100万美元的预付款,并可能获得高达6.5亿美元的里程碑付款,以及产品净销售额的分级特许权使用费;
Mammoth Biosciences还分别在2019年12月和2020年1月与Horizon Discovery达成合作,将Mammoth在CRISPR方面的知识产权与Horizon在中国仓鼠卵巢细胞(CHO细胞)方面的专业知识相结合。根据协议,双方将共同识别并优化新型Cas蛋白,以开发新一代基因工程CHO细胞,用于生产治疗性抗体等生物药。
在诊断领域:2021年1月,安捷伦科技与Mammoth Biosciences宣布达成一项联合营销协议,以支持推出的基于CRISPR的完整SARS-CoV-2诊断解决方案。该解决方案包括安捷伦的Bravo自动化工作站和Mammoth Biosciences的DETECTR BOOST®检测平台;
2020年10月,Mammoth Biosciences宣布与默克旗下Millipore Sigma达成协议,将Mammoth的DETECTR BOOST®SARS-CoV-2试剂盒由Millipore Sigma代工生产。同时Mammoth还与Hamilton公司达成合作,将基于CRISPR的高通量SARS CoV-2检测进行商业化;
2020年7月,Mammoth Biosciences获得美国国立卫生研究院(NIH)的加速诊断RADx项目支持,帮助扩展其高通量CRISPR SARS-CoV-2诊断平台,以解决检测能力短缺问题。Mammoth的平台是该计划资助的第一个基于CRISPR技术的项目;
2020年5月,Mammoth Biosciences与GSK Consumer Healthcare建立合作,使用基于CRISPR的DETECTR平台开发COVID-19检测产品。
参考:
NMPA/CDE;
药融云数据:www.pharnexcloud.com;
FDA/EMA/PMDA;
相关公司公开披露;
The Heroesof CRISPR,DOI:https://doi.org/10.1016/j.cell.2015.12.041;
Jinek M,Chylinski K, Fonfara I, Hauer M, Doudna JA, Charpentier E. Aprogrammable dual-RNA-guided DNA endonuclease in adaptive bacterialimmunity. Science. 2012;337(6096):816-821.doi:10.1126/science.1225829;
Crackingthe Code: Jennifer Doudna and Her Amazing Molecular Scissors,https://alumni.berkeley.edu/california-magazine/winter-2014-gender-assumptions/cracking-code-jennifer-doudna-and-her-amazing;
Marino M.Biography of Jennifer A. Doudna. Proc Natl Acad Sci U S A.2004;101(49):16987-16989. doi:10.1073/pnas.0408147101;
https://mammoth.bio/;
ForbesChina;等等
本文摘自---有机化学网
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China