2023年2月,一家名为Corbus Pharmaceuticals的海外新锐Biotech宣布与石药集团附属公司石药集团巨石生物制药有限公司(石药巨石生物)签订独家协议,Corbus Pharmaceuticals获得石药巨石生物的SYS6002(重组人源化抗Nectin-4抗体药物偶联物)在美国、欧盟国家、英国、加拿大、澳大利亚、冰岛、列支敦士登、挪威及瑞士的开发及商业化权利。根据协议条款,Corbus Pharmaceuticals先支付750万美元的首付款,石药巨石生物有权收取最多1.3亿美元的潜在开发及监管里程碑付款以及最多5.55亿美元的潜在销售里程碑付款,该项交易总金额约合6.925亿美元。
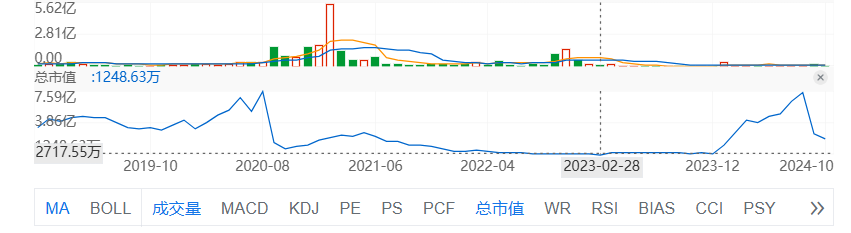
而也是在2023年2月,Corbus Pharmaceuticals股价再次触底,公司总市值只有1200多万美元。随后在美国和中国都拥有丰富的肿瘤学经验的Yong Ben博士加入了公司董事会,原首席运营官CraigMillian于2023年4月离开公司。
摩熵医药数据库:公司信息
从摩熵医药数据库获悉,Corbus Pharmaceuticals(以下简称“Corbus”)成立于2009年,是一家拥有多元化产品组合的精准肿瘤学公司,公司通过将创新的科学方法引入熟知的生物通路,帮助人们战胜严重疾病。
2024年2月,Corbus完成了9450万美元的普通股公开发行;在第二季度,根据公司的ATM项目筹集了3560万美元的净收益;第二季度至2024年8月1日期间,又根据ATM项目筹集了约2880万美元的净收益。截至2024年6月30日,Corbus报告的现金、现金等价物和投资为1.47亿美元,根据计划,预计将为公司提供资金运营至2027年第三季度。
Corbus Pharmaceuticals的在研管线包括针对肿瘤和针对肥胖症的,管线具体进展情况如下:
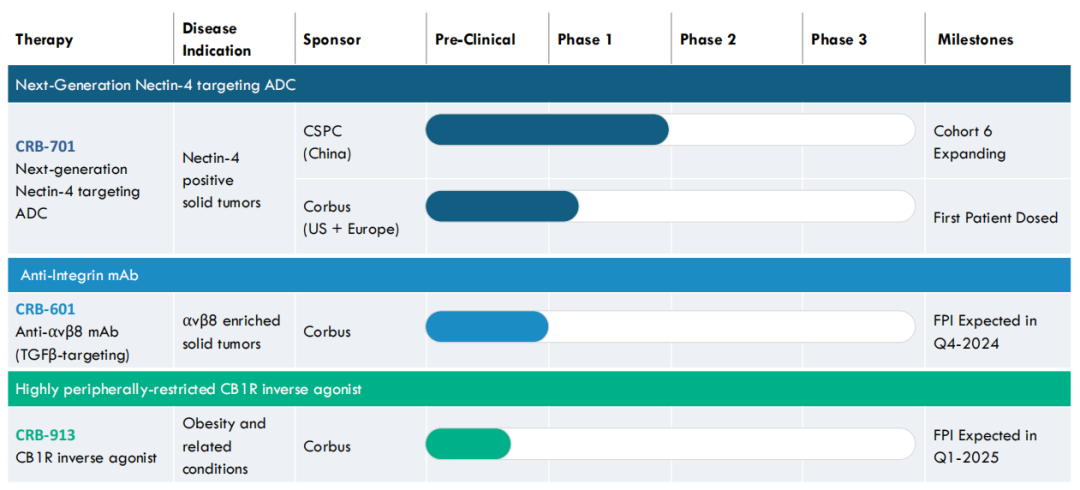
CRB-701是一种处于临床阶段的新型ADC,石药巨石生物的代码为SYS6002。通过石药集团专有的酶催化定点抗体偶联技术,CRB-701能将有效的有丝分裂抑制剂MMAE(单甲基澳瑞他汀E,一种细胞毒素,可以杀死癌细胞)针对性地导向Nectin-4表达的癌细胞,而其连接子的稳定性有助于将高浓度的MMAE送达肿瘤中,并同时通过减少不良的全身暴露量而将副作用减低。
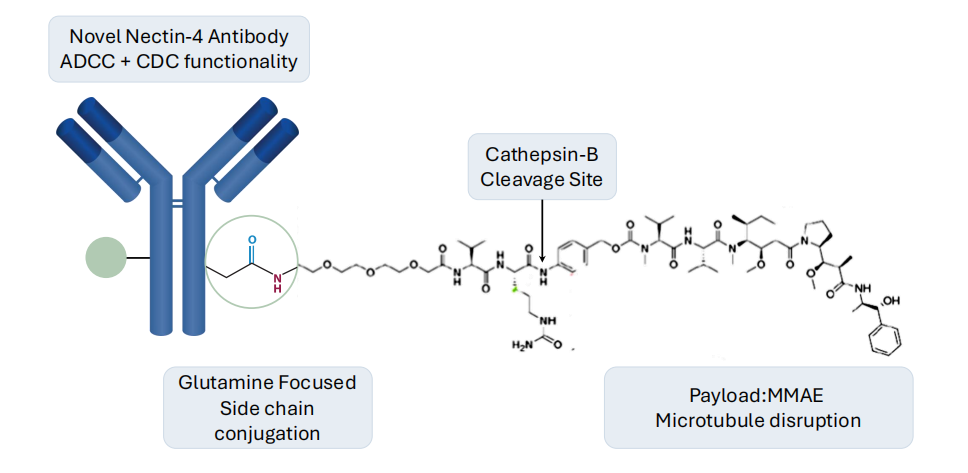
Nectin-4能促进肿瘤增生、血管生成、淋巴管生成及淋巴转移,在健康成人组织中的表达量非常低。但在多种类型癌症中,包括膀胱癌、三阴性乳腺癌、肺癌、结直肠癌、胰腺癌及卵巢癌,Nectin-4的表达被重新激活并有高表达量。由于在癌症中的选择性表达,Nectin-4已成为有潜力用于治疗各种癌症的靶点。CRB-701设计具有均匀的DAR分布、更高稳定性的专有连接子及降低的药物抗体比率,以提高血液稳定性及肿瘤部位特异性药物释放,从而获得更佳安全性及疗效。
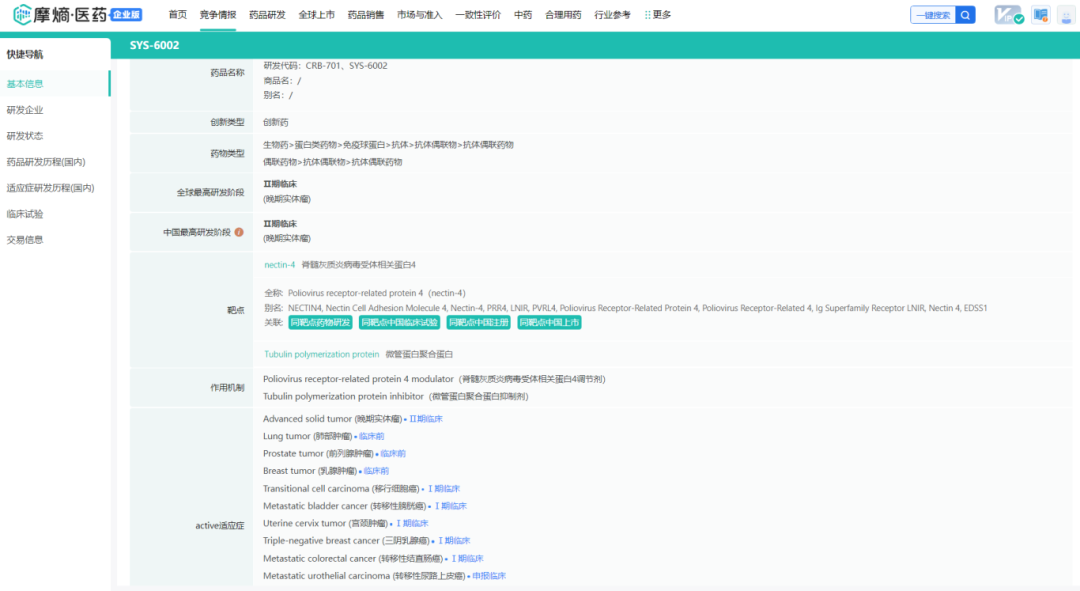
摩熵医药数据库:药品研发信息
CRB-701的IND已获得美国FDA批准,石药巨石生物在中国对晚期实体瘤患者进行临床试验1期剂量递增研究,Corbus按计划利用中国临床试验1期研究的数据,于2024年第一季度在美国开展1期临床试验。2024年1月,Corbus公布了由石药巨石生物进行的该产品的临床试验1期研究的首批临床数据,从安全性来看,CRB-701的耐受性良好,大多数与治疗相关的不良事件均为1级或2级且可逆;未观察到3级以上的不良事件;研究中没有出现剂量中断或减少的情况,一名参与者经历了临时剂量中断;迄今为止,尚未发现与药物相关的周围神经病变或皮疹病例。疗效上面,剂量水平5(2.7毫克/千克)及以上代表基于异速比的预测治疗相关剂量;-接受2.7毫克/千克或3.6毫克/千克剂量的混合肿瘤人群(7人)显示ORR为43%:3例部分应答、2例未证实的应答和1例无Nectin-4表达的无应答参与者,DCR为71%;观察到的最长应答为11个周期(约10个月),且仍在持续;所有Nectin-4阳性的mUC和宫颈癌患者在剂量≥2.7 mg/kg、2023年12月数据截止时可评估的情况下,均表现出疾病控制水平,代表了当时CRB-701的应答人群。
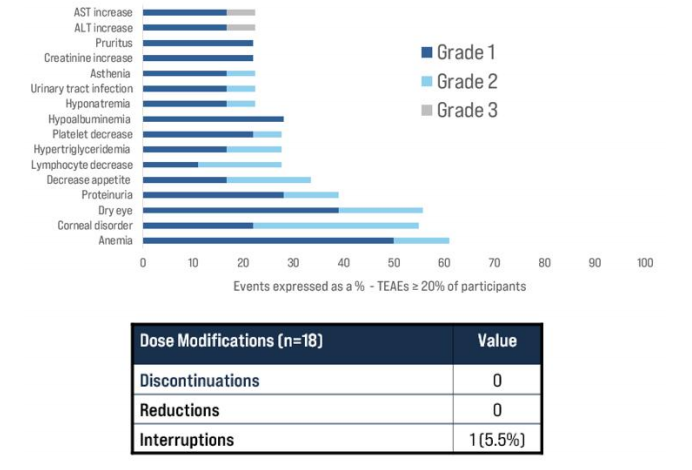
安全数据
2024年4月,Corbus宣布CRB-701在美国的临床试验1期研究实现首例患者给药,这项在美国和欧洲为开放标签研究的临床试验1期研究旨在评估CRB-701在高Nectin-4表达相关的晚期实体瘤患者中的安全性、有效性和药代动力学,该临床试验1期研究首先进行剂量递增,然后是剂量优化,最后以剂量扩展结束,以确定推荐的临床试验2期研究的剂量。
2024年6月的ASCO会议上Corbus公布了临床试验1期研究的补充数据,数据显示:(1)在剂量≥1.2 毫克/千克时,转移性尿路上皮癌的ORR为44%,DCR为78%;宫颈癌的ORR为43%,DCR为86%;(2)在4.5 毫克/千克(含4.5毫克/千克)以下的剂量中未观察到剂量限制性毒性;(3)已发现三例皮疹(包括一例3级皮疹)和一例1级神经病变,均已治愈;(4)早期药代动力学数据显示,在研究的所有剂量(包括4.5毫克/千克)中,游离MMAE的水平始终低于维恩妥尤单抗(安斯泰来和辉瑞旗下Seagen联合开发,商品名PADCEV)。

2024年10月16日Corbus宣布CRB-701桥接临床试验1期研究的剂量递增部分已完成。临床试验1期研究的A部分剂量递增正在评估四个预定剂量(1.8 mg/kg、2.7 mg/kg、3.6 mg/kg和4.5 mg/kg),随后将进行B部分(剂量优化)和C部分(剂量扩展),以确定推荐/优化剂量并寻求初步疗效信号。公司预计在2025年第一季度分享剂量递增的首批数据。

目前来看,以Nectin-4为靶点的CRB-701的竞争对手包括辉瑞、礼来、Bicycle Therapeutics、Mabwell和Adcentrx Therapeutics,维恩妥尤单抗已被批准用于治疗转移性尿路上皮癌,但其毒性和安全性限制包括严重且可能危及生命的皮肤反应和周围神经病变,这对耐受性和剂量强度产生了负面影响,这无疑也是Corbus可以优化的重要方面。
另一个开发用于治疗实体瘤的CRB-601是一种抗αvβ8单克隆抗体,从加州大学旧金山分校该产品的许可,由Stephen Nishimura博士和他的团队发明。该产品能阻断肿瘤微环境中癌细胞上潜伏的TGFβ(转化生长因子β)的激活,TGFβ是一种多功能细胞因子,参与许多细胞过程,包括细胞生长和分化、免疫反应、伤口愈合和组织修复。在癌症中,TGFβ介导免疫逃避,并通过其在肿瘤微环境中的免疫抑制作用在促进癌细胞生长和转移方面发挥关键作用,当TGFβ在肿瘤环境中过度表达时,会导致不良的临床结果。
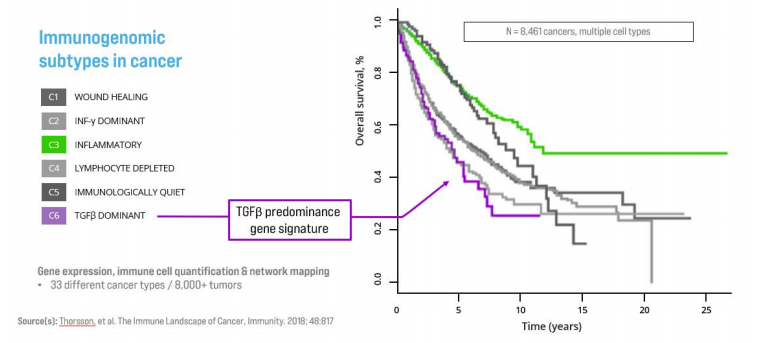
αvβ8整合素是TGFβ的一个关键调节因子,一些人上皮恶性肿瘤的肿瘤细胞表达αvβ8,导致肿瘤微环境中TGFβ的激活。CRB-601专门设计用于与αvβ8上潜伏的TGFβ激活位点结合,从而阻断αvβ8依赖性激活。
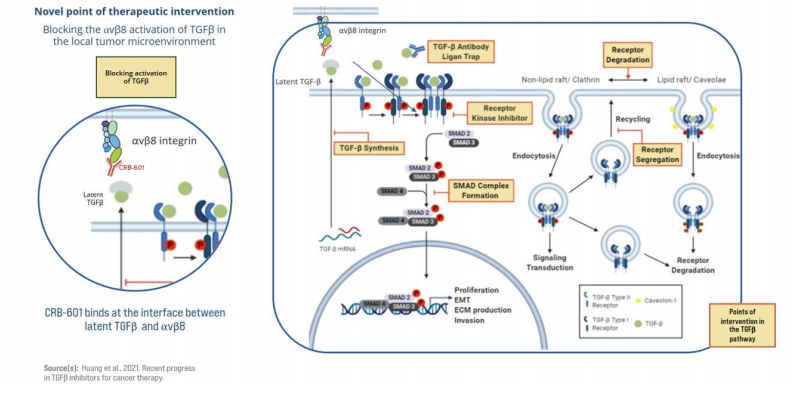
在临床前模型中,CRB-601与抗PD-1检查点抑制剂疗法联合使用时,其抗肿瘤活性比单独使用其中一种药物更强。临床前数据表明,CRB-601对潜伏TGFβ生成的阻断可导致肿瘤微环境中免疫细胞浸润的变化,从而有可能增强PD-1阻断的益处,该产品目前正被开发为与包括检查点抑制剂在内的现有疗法联合治疗实体瘤患者的潜在疗法。2024年1月,FDA批准了CRB-601的IND,公司预计在2024年第四季度启动临床试验1期研究。
最后一条进展管线CRB-913是第二代高度外周限制性CB1受体反向激动剂,旨在治疗肥胖症。2018年9月20日,Corbus与Jenrin Discovery签订了独家许可协议,该协议为Corbus提供开发和销售Jenrin已授权专利和专利申请所涵盖的大麻素化合物的全球独家许可,这些专利和专利申请涵盖了选择性大麻素受体调节剂的组成和使用方法。该专利的权利要求涉及大麻素受体阻断剂CRB-913以及使用CRB-913治疗肥胖症、糖尿病、肝功能紊乱或心脏代谢紊乱的方法。
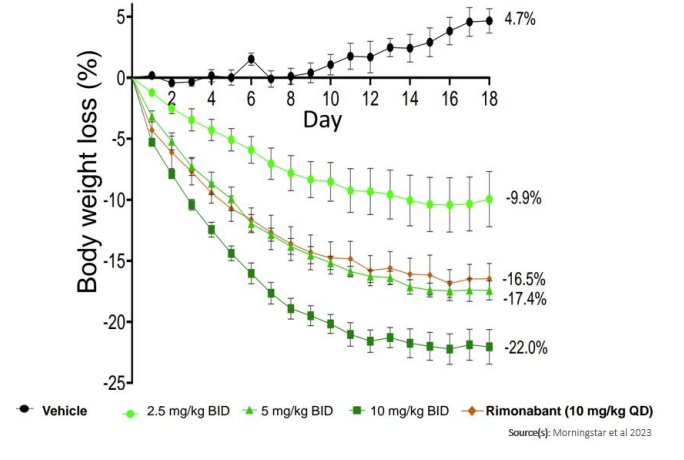
利莫那班是第一代CB1受体反向激动剂,具有很好的减肥效果,并具有胰岛素增敏和改善脂代谢紊乱的作用,与利莫那班相比,CRB-913在瘦小鼠和肥胖小鼠中均显示出更强的外周限制作用,且在DIO小鼠研究中,该药物在减轻体重方面的疗效与利莫那班相当。
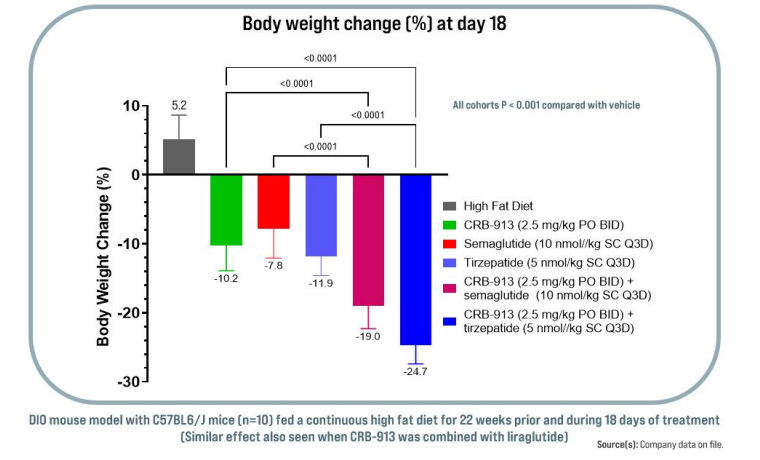
在DIO(肥胖)小鼠模型中,CRB-913作为单一疗法或与增量素类似物(替泽帕肽、司美格鲁肽或利拉鲁肽)联用,均能减轻DIO小鼠的体重,并能改善体脂含量、瘦素血症、胰岛素抵抗、肝甘油三酯、肝脂肪沉积和肝组织学。Corbus预计将在2025年第一季度开始临床试验1期研究。此外,同样在肥胖症赛道的还有阿斯利康、礼来、诺和诺德、安进和辉瑞等一众巨头。
不过,在诺和诺德披露自身在研的CB1R反向激动剂Monlunabant(10.57亿美元收购自加拿大公司Inversago Pharma)结果时大跌,同时带跌了同赛道的Corbus暴跌。

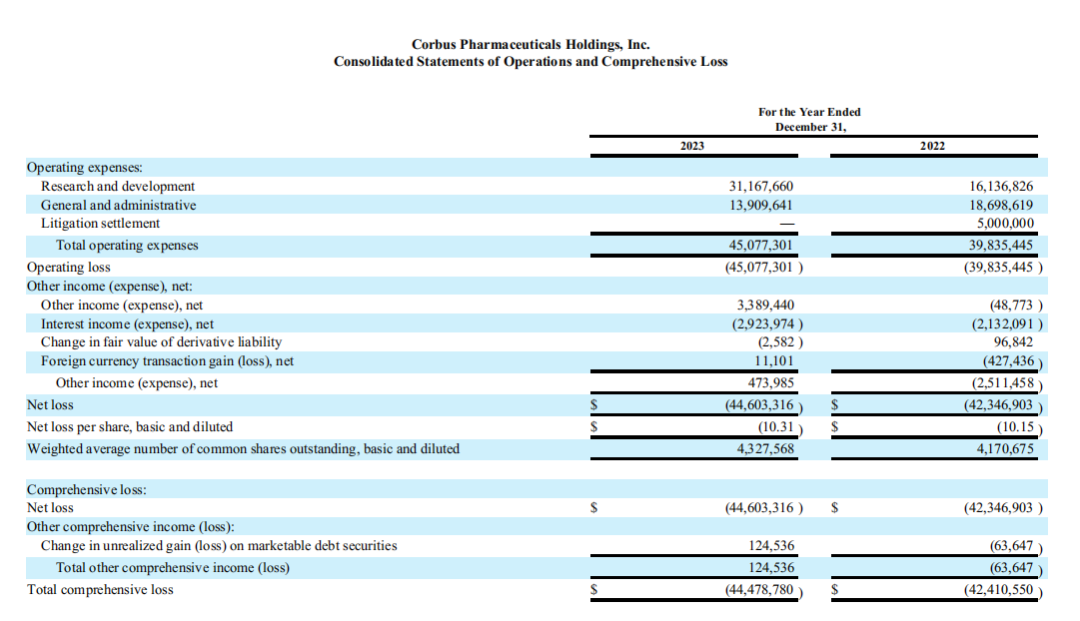
2023年度,Corbus的总运营费用为4508万美元,其中研发费用3117万美元,一般和行政费用1391万美元。净亏损约4460万美元,摊薄后每股净亏损10.31美元,上年同期净亏损约4230万美元,摊薄后每股净亏损10.15美元。
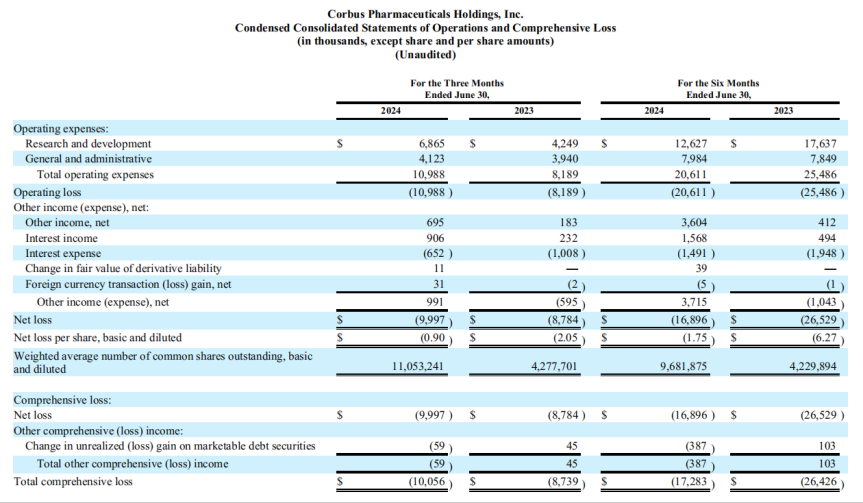
2024年上半年度,Corbus总运营费用为2061万美元,其中研发费用1263万美元,一般和行政费用为798万美元,上年同期总运营费用达到了2549万美元。上半年净亏损约1690万美元,摊薄后每股净亏损1.75美元,上年同期净亏损约2653万美元,摊薄后每股净亏损6.27美元。
截止2024年10月25日,Corbus公司总市值1.96亿美元,约合人民币14亿元。

Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China