眼科即“眼病专科”,是研究发生在视觉系统,包括眼球及其关联组织有关疾病的学科。自1851年德国的Helmholtz发明检眼镜以来,眼部组织和血管系统开始清晰地呈现在医生面前,眼睛作为人类最精密的器官之一,一旦发生异常通常是致命性且永久性的,异常的眼底将严重影响人体的视觉感受。目前,大部分的眼科疾病都以药物治疗为主,随着眼部用药技术的研究不断革新突破,创新型眼部用药的出现将为各类眼病患者带来更多的治疗希望。
第一部分:“智银”为什么推荐眼科创新药赛道
1、眼科疾病定义与分类
眼部疾病涉及多种多样的疾病,这些疾病影响到视觉系统的不同组成部分和视觉功能。眼部疾病是指发生在视觉系统,包括眼球及其相关联的组织有关疾病的学科。一般包括视网膜疾病,眼视光学,青光眼和视神经病变,白内障等。
眼科疾病种类广泛,屈光不正与白内障患病率最高:眼睛是人体重要的感觉器官之一,眼科疾病种类繁杂且广泛。致盲类疾病包括白内障、青光眼及眼底相关疾病,与人类健康和生活质量密切相关。但目前白内障和屈光不正主要依赖于手术治疗。目前对于眼部疾病主要有两种分类方法:
按照是否损伤视力分类
由于眼疾的范围广,根据WHO于2020年发布的《世界视觉报告》中提到的一种分类方法,将一般不会导致视力损伤的眼疾与可能导致视力损伤的眼疾区分开来。一般不危及视力的眼疾包括干眼症,结膜炎,眼睑异常,甲状腺相关眼病等。尽管非致盲性眼病的危害性相对较低,但长期依然会对人群的日常生活产生影响。在不进行及时治疗的情况下,某些不会导致视力损伤的眼疾将会产生多种严重并发症,亦存在视力损伤风险。例如,甲状腺相关眼病严重后引起甲亢性眼突会出现影响视力的情况。目前一般不危及视力的眼疾大部分都依靠相关药物进行治疗。
可能损害视力甚至造成盲症的眼疾有视网膜病变、湿性老年性黄斑变性、白内障、青光眼等,其中湿性老年性黄斑变性、青光眼等的致盲性是不可逆的。
图表1 常见眼科疾病的分类和介绍

资料来源:智银全球生物医药资料库
按照发病部位进行分类
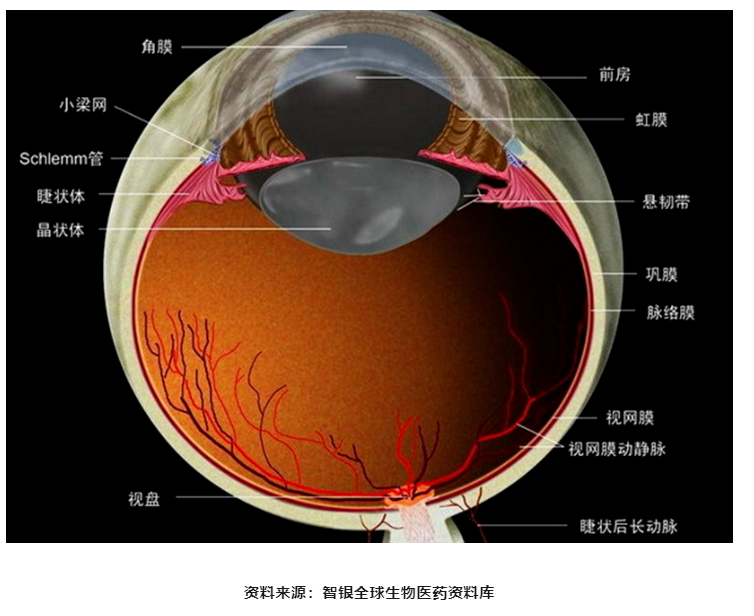
眼睛结构由外到内分别为泪膜,角膜,晶状体,虹膜,视网膜等。如果把眼科疾病按部位进行划分,则可以列为眼前部疾病和眼后部疾病两大类。其中,眼前部疾病有白内障、干眼症、近视、青光眼、结膜炎、葡萄膜炎等;眼后部疾病包括湿性黄斑病变、糖尿病黄斑病变、后部葡萄膜炎等。
图表2 眼部结构图
眼科赛道患者基数庞大,市场需求尚未被满足。对于目前的眼部疾病,主要包括手术治疗和药物治疗两类。据Frost&Sullivan统计,2020年我国八大常见眼疾包括近视、结膜炎、干眼症、白内障、睑缘炎、视网膜疾病、青光眼及葡萄膜炎。
图表3 我国各类眼科疾病的患病率
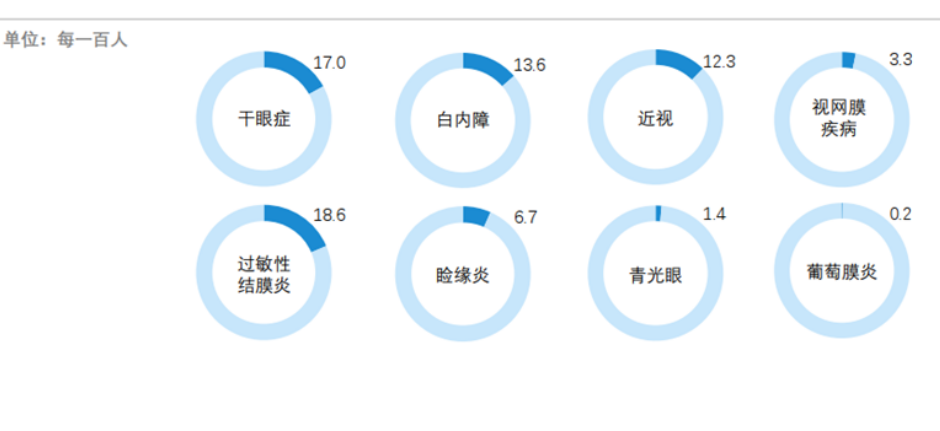
资料来源:Frost&Sullivan,智银全球生物医药资料库
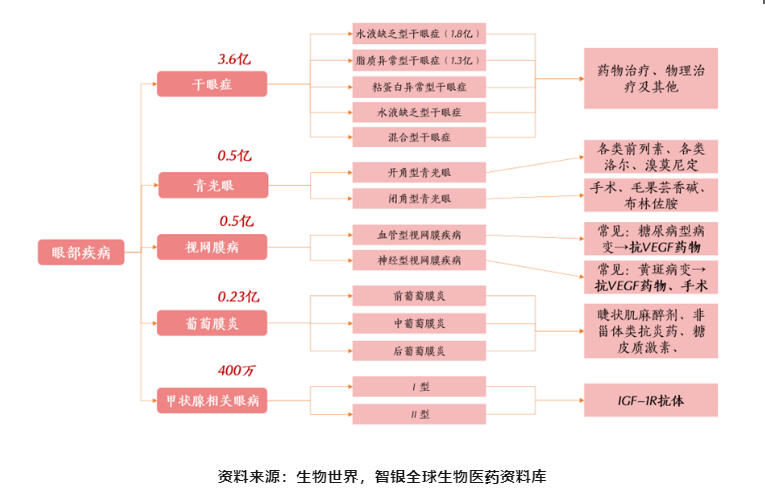
抛去屈光不正和白内障这类主要通过手术治疗的眼疾,剩余眼疾均依赖于不同程度的药物治疗。目前,国内眼科药物多为进口药物,获批的眼科新药寥寥无几,眼疾患者的数量却在逐年增加。目前我国干眼症患者数量达到3.6亿人。除此之外,视网膜疾病的市场规模也在高速增长,其中眼部黄斑变性是全球三大致盲病种之一,也是一类危害大且容易被忽视的中老年眼底病,我国60岁以上人群中眼部黄斑变性的发病率约为10.6%,据此推算,我国已有将近3000万的眼部黄斑变性患者人群。而诸如甲状腺相关眼病也达到400万的数量。
图表4 我国依赖药物治疗的眼科疾病患者流
2、眼科创新药技术分类
眼科创新药是指用于预防、治疗或改善眼部疾病或矫正视力的药品,其主要运用于眼外科和视力保健两大眼科领域。眼科疾病的基础治疗手段是通过药物治疗,目前,药物治疗的整体痛点在于无法根治疾病,长期使用药物仅起到延缓疾病进程、控制病情恶化和降低严重并发症发生的作用。新型眼科药物的研发致力于更长效的治疗效果,替代疗效欠佳的传统药物,同时,为目前缺乏药物治疗的眼疾带来创新治疗手段。目前,眼科疾病创新药开发主要分为以下四类方向:新疗法开发(基因疗法,干细胞疗法),新靶点开发,新型给药方式开发。
眼部疾病药物开发的难点不仅在于机理和靶点的识别,还在于眼部特殊环境为药物有效递送带来挑战。除结构形成的静态屏障,参与血液流动、淋巴清除和眼泪排出的动态屏障和离子泵、酶类构成的代谢屏障都为药物抵达作用部位并持续药效带来难度,因此亲脂/水性质、透膜性、电荷等性质都是贯穿药物设计始终的考量,运用性质模拟的计算方法将药物开发的风险前置,可有效提高药物开发阶段的成功率。
图表5 眼部结构示意图
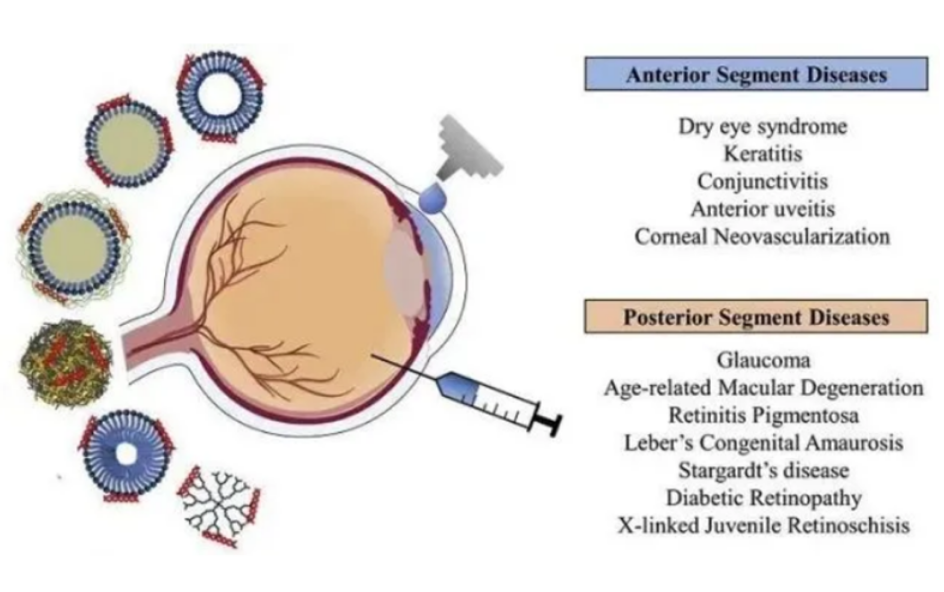
资料来源:晶泰科技,智银全球生物医药资料库
(1)新靶点开发提供全新作用机制
新靶点的发现对于眼科疾病研究具有重大意义,为治疗疾病提供全新的作用机制,成为一系列新药发现的突破口。具有代表性的靶点之一的VEGF因子,研究发现其异常增高可引起黄斑区血管的高渗漏及新生血管的生成,抑制VEGF显示出显著的治疗有效性,抑制VEGF药物也成为眼底新生血管疾病治疗的主要策略,目前作用于该靶点的药物有雷珠单抗、阿柏西普和康柏西普,且适应症范围随着靶点研究的深入也在不断拓展。
近年来越来越多企业聚焦于眼睛免疫微环境开发新型药物,眼内微环境中存在多种炎症调节因子,以抑制炎症激活,维护眼部免疫特权。而各类激素及调节因子的异常容易影起眼部异常(TAO即为一种典型的免疫性眼部疾病)。通过对免疫微环境的调节有望治疗这类疾病,但基于眼睛免疫微环境开发新型药物依赖于对眼眶结缔组织的高通量单细胞图谱的建立,阐述眼眶组织中不同基质细胞及免疫细胞的表型、转录水平的变化,通过细胞亚群、差异基因分析、细胞间相互作用分析等,技术壁垒较高。但类似的研发思路为开发新型免疫干预措施提供重要思路。
图表6 常见眼病的新靶点或调控机制

资料来源:生物世界,智银全球生物医药资料库
(2)新型给药方式开发为患者提供更多选择
眼睛生理结构复杂,存在多种生物屏障,使得药物在眼部难以实现有效的药物递送。对于眼前段给药,存在三种主要的生物屏障,使得大部分眼表给药的药物损失过多、眼部生物利用度极低,治疗效果不甚理想。目前研究方向集中对制剂处方的改良,目的是延长药物的滞留时间和改善药物的眼表渗透;对于眼后段给药,由于眼后部血-视网膜、脉络膜、巩膜等复杂的生理屏障,依从度更高的外用眼表给药无法达到治疗效果,玻璃内注射给药可以将药物直接注射到眼后部组织,然而不良反应的产生限制其应用。开发给药方便、患者用药负担小且能将药物递送到眼后段病变组织的新型递药系统成为一个亟待解决的关键问题。如:VEGF抑制剂多为眼内注射,患者依从性较差。因此从药物分子结构设计、剂型改良创新,甚至开发创新的药物递送系统不仅将使眼科药物开发受益,也将是其他药物获得独创性的一大方向,比如罗氏长效给药装置(PDS)已经获得FDA批准上市,患者在补药前能够长达6个月不需要额外治疗。
而新型的药物递送系统开发包括:
凝胶缓释技术:通过凝胶技术,突破氧化性药物眼部制剂难题,降低眼部刺激性,延长药物在眼部作用时间,有效降低用药频次,提高病人依从性;与传统滴眼剂相比,给药更方便。
图表7 新型滴眼液到达眼底组织的路径
纳米胶束技术:根据眼科药物给药途径及制剂特点,研发制备不同种类表面活性剂或两亲嵌段共聚物的纳米胶束体系,提高疏水性药物的溶解度和生物利用度,为开发低溶解度药物提供合适载体;可提高药物的组织穿透性,用于开发眼后部药物。
脂质体技术:可生物降解,作为无免疫源性的生物相容性载体;也可用作亲脂性和水溶性分子的递送,有效提高药物渗透性,便于眼后段药物输送。
(3)基因疗法为眼科遗传性疾病治疗带来希望
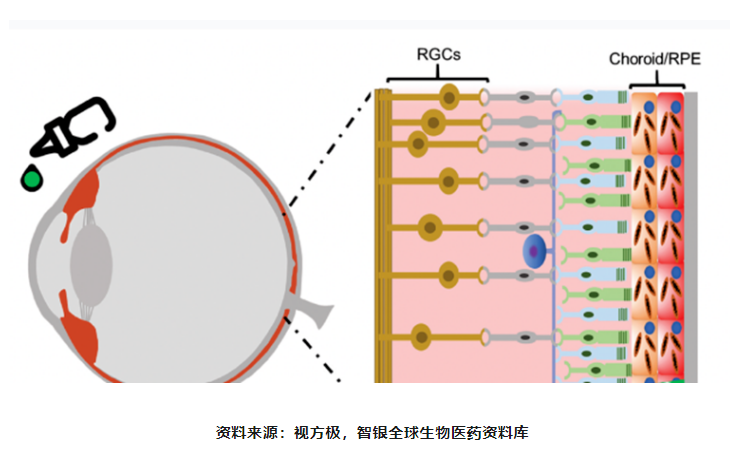
由于血眼屏障的存在使得眼睛成为具有免疫特权的器官,针对基因治疗产生的免疫反应有限眼睛因其良好的解剖学和免疫学特性成为理想的基因治疗靶器官。此外,由于眼睛的视网膜细胞不会分裂,可允许持续的基因表达且不会整合入基因组,眼睛的视网膜成为基因治疗极有利的目标部位。基因治疗对于缺少替代疗法的遗传性视网膜疾病(IRDs)具有巨大优势,可从根本上补充或修复缺陷基因,恢复视网膜的正常生物学功能。
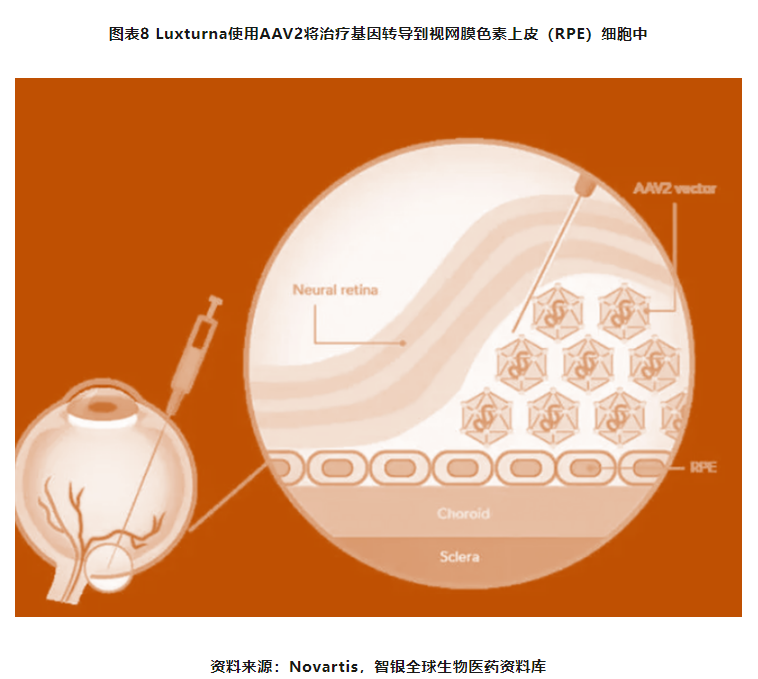
眼科是基因治疗中进展最迅速的适应症领域之一,眼科诞生了FDA批准的首款应用基因疗法的药物,2017年由Spark研发的Luxturna获批上市,用于针对由RPE65基因突变导致的雷柏氏先天性黑朦2型(LCA2)。随着更多遗传性眼部疾病的突变被精准识别,基因治疗开发有了更多的靶点选择,眼部基因疗法临床试验迅速增加,主要集中在单基因突变引起的罕见遗传性视网膜疾病和基因突变角膜疾病,例如视网膜营养不良、无脉络膜症、Leber遗传性视神经病变(LHON)和X连锁视网膜劈裂症(XLRS)等。
(4)干细胞治疗为复杂眼部疾病提供思路
目前,基于干细胞的再生替代治疗的适应症领域主要有角膜损伤、视网膜变性(RD)等。受限于可供移植治疗的角膜数量少,角膜干细胞的治疗为中重度角膜损伤患者提供新的治疗方案,代表性药物Holoclar为欧盟批准的首款干细胞眼药,经培养后的角膜缘上皮干细胞移植治疗成人患者因物理或化学灼烧而引起的角膜缘干细胞缺乏症(LSCD)。针对致盲风险高的视网膜变性,当前的治疗手段多数仅能延缓疾病进展,而利用干细胞的特性去修复和再生受损的视网膜有望达到长期、彻底的治疗效果。干细胞如胚胎干细胞(ESC)和人工诱导的多能干细胞(IPSC)具有增殖和多向分化的特性,干细胞疗法的临床前研究结果也展示其在临床治疗中的巨大潜力。
3、眼科疾病市场规模
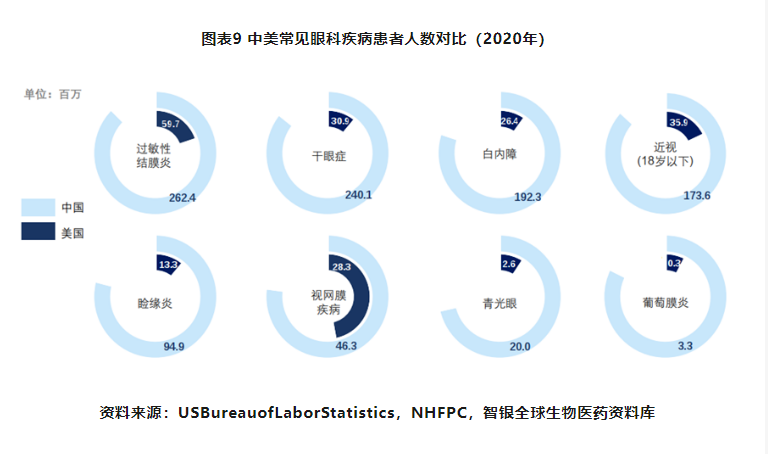
眼科疾病治疗渗透率较低,未来市场空间广阔:一直以来,由于眼科专病高度细分、专业性较强,大众对眼科疾病的认知与重视程度有限,导致我国眼科诊断率及治疗率一直处于较低水平,国内眼科药品及器械的发展也处于非常早期的阶段,仍以进口为主导。我国患者数量明显多于美国,据弗若斯特沙利文2019年对主要眼科疾病的中、美两国人数进行统计发现,国内干眼症和葡萄膜炎的患病人数为美国的10多倍,过敏性结膜炎患者人数高出美国2亿多人、白内障患病和近视人数均较美国高出1亿多人。而与美国相比,我国虽然拥有更广阔的患者基数,但眼科器械及药物的市场规模仅有其八分之一到五分之一。整体来说,我国眼科市场诊断及治疗渗透率极低,未来还有很大的增长潜力。
(1)全球市场:稳定增长,高度集中
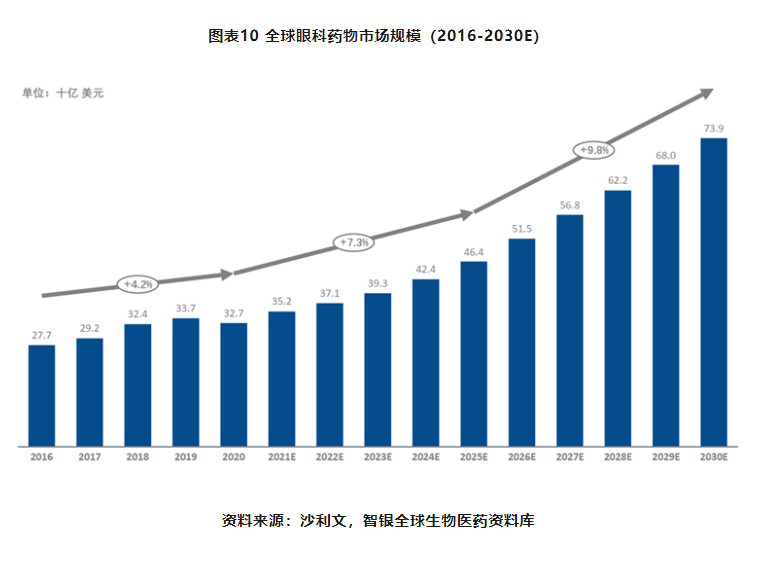
全球眼科药物市场自2016年以来,一直保持着4%左右的稳定增长态势。2016年至2020年,全球眼科药物市场规模从277亿美元增长至327亿美元,未来,这一稳定增长态势将会继续保持,随着未来更多眼科创新药物的研发和上市,预计2025年将达到464亿美元,2030年将达到739亿美元。而增长率也将逐步提升。
从全球区域范围来看,由于技术发达、医疗保健支出高以及领先企业的存在等原因,美国在眼科药物市场上占据主导地位,其次是同为较发达地区的欧洲,由于庞大的患者群体、不断增长的需求和医疗保健技术的发展,亚太地区是增长最快的眼科药物市场。从全球市场竞争整体情况来看,由于眼科赛道技术壁垒极高,全球市场目前呈现高度集中的竞争格局,爱尔康、强生、博士伦、依视路和诺华等企业占据着前沿的第一梯度市场。目前,全球眼科药物的研发热度主要集中在视网膜病变、眼部炎症和感染、干眼症和青光眼四大领域,随着眼科疾病治疗技术的迭代以及适应症的拓展,创新药物市场不断扩大且逐步覆盖更多眼疾患者。
(2)国内市场:逐渐发展,潜力无限
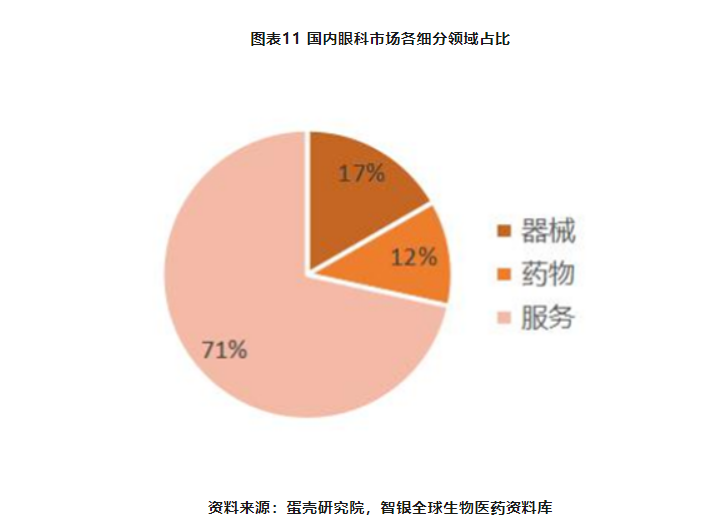
国内眼科赛道呈现“药物+器械+服务”三位一体的模式。就细分领域市场规模而言,眼科服务市场占比最大,达到72%左右,器械次之,占比达17%左右。而眼科药物起步较晚,目前市场规模占比最小,但其发展最为迅速,增速达到15%左右,位于各细分领域首位。
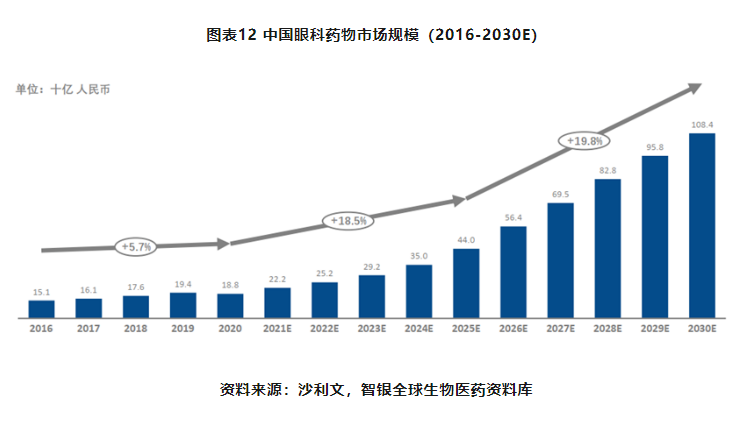
2016年至2020年,中国眼科药物市场规模从151亿人民元增长至188亿人民币,复合年增长率为5.7%,预计2025年将达到440亿人民币,2030年将达到1,084亿人民币。呈现加速增长趋势。
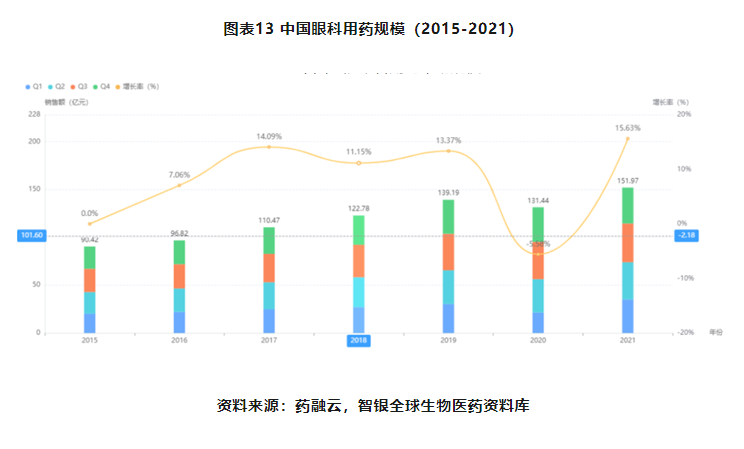
从需求端来看,国内的眼科患病人群远超美国,随着人口来老龄化、用眼健康意识的提升和眼科新药的不断发展,国内眼科用药渗透率大有提升空间,眼科用药市场均将进入快速成长期。从中国医院眼科用药市场规模发现,近些年,除2020年受新冠疫情影响外,其余均保持10%以上增速。
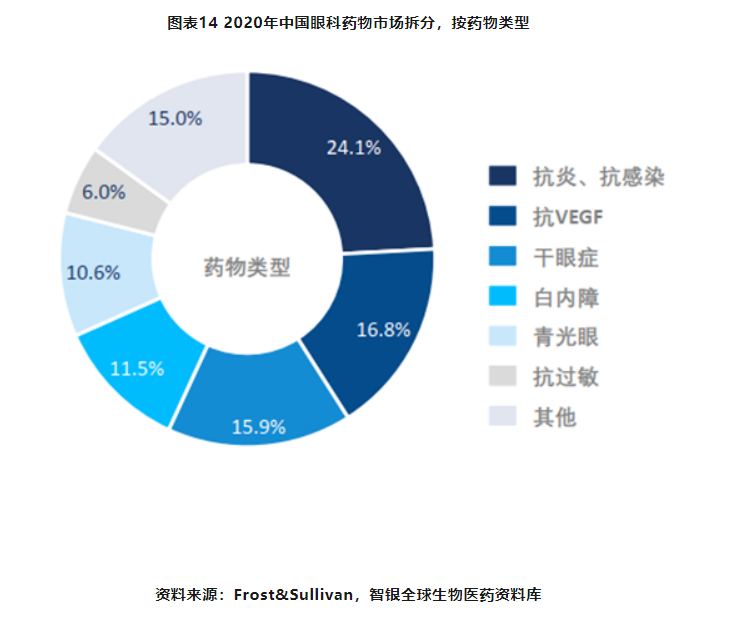
抗炎、抗感染药物占据中国眼科药物市场最大份额,占比24.1%,其次是抗VEGF药物,占比为16.8%,之后是治疗干眼症和白内障药物,分别占比15.9%和11.5%。针对视网膜病变的抗VEGF药物的发展最为迅速,已逐渐替代副作用较大、治疗效果不理想的传统治疗手段且成为该适应症市场的主流,市场空间广阔。但部分抗VEGF治疗无效的患者也面临着无药可治的场面。现部分企业寻求免疫治疗的方式对抗这种治疗失败的患者。
4、眼科疾病药物治疗行业壁垒
(1)高技术壁垒,缺乏新型创新药物
目前国内眼科药企的主流管线仍以仿制药、改良型新药为主,自主研发相对较少,同质化非常严重,导致国内外药物的差距没有明显改善。对于眼科创新药而言,技术门槛较高,而我国厂商相对来说布局较晚,研发,临床及销售端人才都非常匮乏,目前产品技术积累上仍与国外存在较大差距。
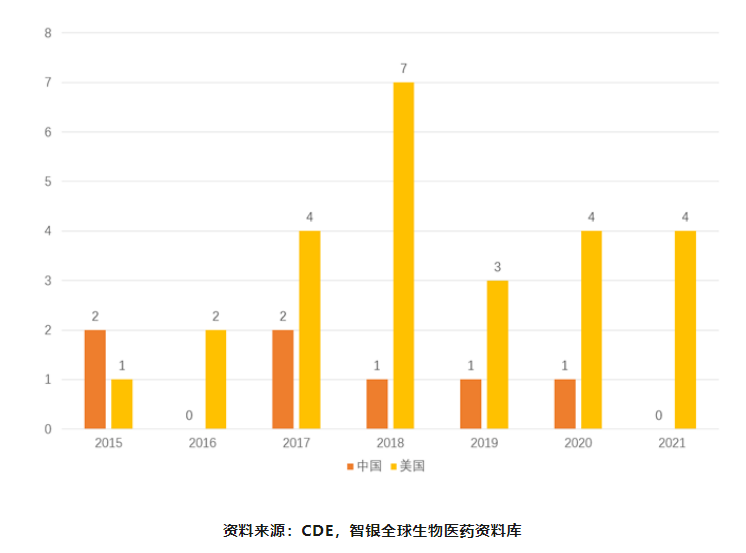
以中美2015年—2021年期间获批的眼科新药数量为例,美国远远高于中国,共有29款药物在FDA批准上市,获批产品包括505b(1)和505b(2)类新药;中国近有7款新药获NMPA批准上市,均为跨国公司开发的进口药物。近些年来本土药企在药物研发上有新的突破,但眼科创新药开发数量仍处于较低水平。
图表15 中美眼科创新药获批比较
(2)行业市场被外企占据,国内药企刚刚入局
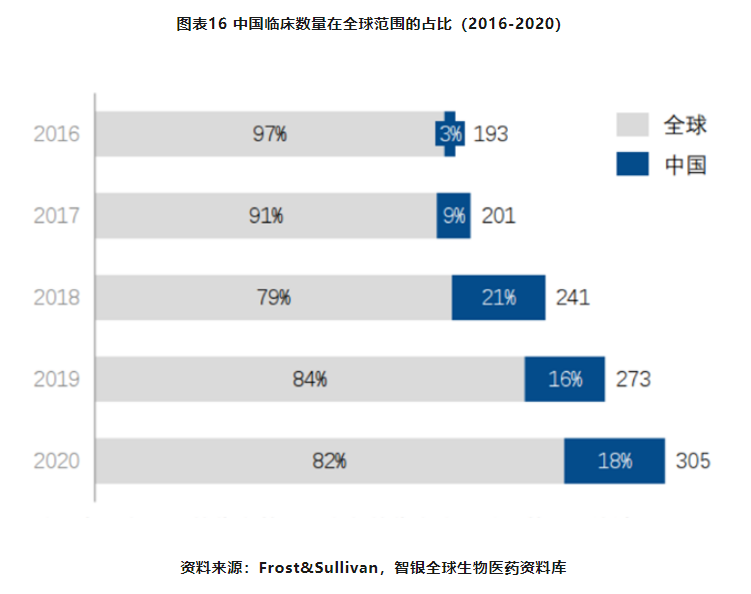
国内眼科药物市场中外资药企的占比在60%-70%左右,其中外资三大巨头就占据了国内接近50%的市场份额。近几年来国内企业虽纷纷布局眼科市场,但由于起步较晚,还需要一定的时间积累才能初步突破。2016年至2020年,中国在眼科疾病领域开展的临床数量为180个,随着逐年的临床数量增幅不断扩大,在全球范围的占比也呈现明显的上升趋势,五年时间从3%增至18%,研发管线数量的快速增长使得国内眼科药物的研发赛道持续拓宽。从药物的创新程度来看,所开展的临床试验中药物类型主要是化学仿制药和生物制品类似药,数量达到98个,新药的临床试验数量从2016年的4个跃升至2020年的30个,各眼科药企加大新药的自主研发力度,加速创新管线的临床开发。
(3)国内患者意识弱,法律法规不明
我国眼科疾病患病人群虽远高于美国,但目前患者治疗意识相对薄弱,相比于美国而言,在各大主流眼科疾病上的诊断率相差很大。较低的诊断率带来较低的产品渗透率,同时,相当一部分产品的可及性也存在问题。诸如莎普爱思等劣质产品依托宣传甚至出现劣币驱逐良币的情形。
如何让国内患者触及到国外的先进疗法,也是推动市场发展的关键因素。除此之外,资本市场对眼科市场的关注虽在近几年逐渐提高,但认知仍较为缺乏,特别是对于前沿产品带来的隐性市场空间认知有限。另外,针对更为前沿的细胞治疗、基因治疗等领域,因国内缺乏相关的产品,导致市场上的监管、审批等法律法规并不明晰,给走在前端的企业带来一定困难。
政府应对各类危害健康的眼疾的治疗率进行重点关注,颁布一系列有力措施完善眼科资源的覆盖情况,使得国民能拥有更高的人均眼科诊疗资源;同时随着医保目录扩容,满足患者的医疗需求且具有临床疗效的眼科创新型药物更多的被纳入医保范围,减轻患者用药负担的同时也增强医院的用药意愿。
5、行业发展趋势:需求增加,技术迭代
眼科药物广泛应用于近视预防、干眼症、青光眼、视网膜疾病、甲状腺相关眼病等领域:在常见的眼科疾病中,眼前部疾病主要包括屈光不正、结膜炎、干眼症、青光眼、白内障等,眼后部疾病则主要包括视网膜病变及葡萄膜炎。目前,近视、干眼症、结膜炎、角膜炎、青光眼、视网膜疾病和葡萄膜炎等疾病均可以使用药物进行治疗。
根据世界卫生组织的报告,我国青少年近视率居世界第一,已成为世界第一近视大国。现目前而言,近视的主要治疗手段仍以框架眼镜、角膜塑形镜等器械,以及激光、飞秒等手术为主。药物预防相对较少
根据《国人干眼多中心大数据报告》,目前我国干眼患者约有3.6亿,干眼成为继近视眼之后又一国民眼健康问题,而干眼症不仅发病人群广泛,药品也是目前最为主流的治疗方式;除此之外,视网膜疾病及葡萄膜炎等疾病也主要依靠药物进行治疗,且视网膜疾病发病人群总数接近5000万,眼科用药的占比也在不断提升。
目前,眼部基因治疗方式和免疫治疗方式也逐渐成为各类眼部药物研发企业的重点内容。这两者由于眼部独特相对独立的免疫环境,使得眼部成为两类技术率先开发的方向。
而中国政府对于眼科用药的审批较为严格,进口眼科新药完成审批流程通常需要经历较长时间。在2015年至2021年的五年间,7款海外眼科药物准入中国市场,且引进项目从递交临床申请到最终药品获批上市平均经历约6年。
其中,国内首款针对视网膜静脉阻塞(RVO)适应症的地塞米松玻璃体内植入剂艾力雅Eylea历时最久,于2009年完成FDA的优先审批流程且获批上市,自2007年在中国递交临床申请到NMPA批准上市,长达8年时间;治疗眼底血管新生性疾病的药品Eylea于2011年由FDA获批上市,最终在2018年获NMPA批准在中国上市,治疗甲状腺相关眼病的唯一药物Tepezza直到目前也未在国内进行上市。进口新药准入中国市场历时久这一特点将带动本土创新型眼药的研发,国产厂商以更快的速度将眼科新药带给患者。
图表17 艾力雅Eylea获批历程
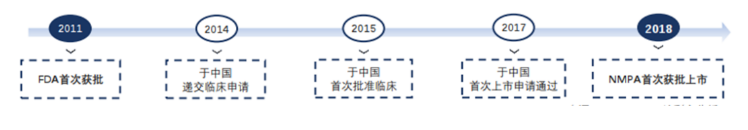
资料来源:智银全球生物医药资料库
从行业发展趋势来看,目前主要体现以下四个特点:
技术更新
创新技术如新型靶向药物、新型治疗方法以及多种剂型开发将引领眼科药物发展迈入新征程。
近年来,随着对新靶点的深入研究,进展最为迅速的抗血管内皮生长因子(VEGF)靶向药物陆续上市,仍有许多新靶点处于药物发现阶段,例如PIGF、Ang2等都是当下研究的热点;眼科疗法领域更是涌现出众多创新疗法,基因疗法、干细胞疗法、免疫疗法等为难治性眼科疾病提供重要突破口。对于给药途径和剂型的改良优化也在开展中,例如缓释制剂、玻璃体内注射剂(IVT)等,有望逐步突破传统给药方式的技术屏障。
预计未来眼科医药技术将在不同领域不断革新,对于新靶点、新疗法、新给药方式的探索将为未来眼科药物的发展开辟方向
从行业发展趋势来看,目前主要体现以下四个特点:
技术更新
创新技术如新型靶向药物、新型治疗方法以及多种剂型开发将引领眼科药物发展迈入新征程。
近年来,随着对新靶点的深入研究,进展最为迅速的抗血管内皮生长因子(VEGF)靶向药物陆续上市,仍有许多新靶点处于药物发现阶段,例如PIGF、Ang2等都是当下研究的热点;眼科疗法领域更是涌现出众多创新疗法,基因疗法、干细胞疗法、免疫疗法等为难治性眼科疾病提供重要突破口。对于给药途径和剂型的改良优化也在开展中,例如缓释制剂、玻璃体内注射剂(IVT)等,有望逐步突破传统给药方式的技术屏障。
预计未来眼科医药技术将在不同领域不断革新,对于新靶点、新疗法、新给药方式的探索将为未来眼科药物的发展开辟方向
资本介入
眼科药物赛道火热,广阔的市场需求吸引大量资本介入,助力眼科药企加码赛道布局
近年来,眼科赛道正在不断吸引大量的社会资本进入,眼科药物市场逐渐成为资本重点关注领域,机构数量不断增加,红杉中国、高瓴投资、正心谷资本等顶级投资机构以及腾讯等大型企业的战投部均参与到眼科药物赛道的布局中。

随着经济水平提高,眼部疾病等影响生活质量的疾病得到更高的关注度,资本进入眼科领域的意愿明显上升,眼科药物市场热度渐增,对眼科创新药的投入使得近年来眼科药物治疗领域发生多起重大并购、大额融资、产品许可及战略合作等商业活动。在资本的持续助力下,近年来诞生多家创新型眼药企业,众多药企持续涌入这一赛道,传统药企在积极通过加速研发或引进新药等方式参与竞争。
政策利好
2016年10月,国家卫生健康委发布《“十三五”全国眼健康规划(2016-2020)》,将眼病防治工作纳入医疗卫生服务体系,逐步消除可避免的盲症和视觉损伤,高度重视白内障复明、儿童青少年的屈光不正的筛查矫正以及糖尿病视网膜病变等眼疾的诊断与治疗,从多方面推动眼科护理的资源合理分配;
2019年7月,国务院颁布《健康中国行动(2019-2030)》,重视眼科行业的健康发展,针对中小学生的视力健康问题提出诸多要求,除对政府部门的决策提出建议,针对个人、家庭和学校提出具体的预防措施和建议;
2022年1月,国家卫生健康委发布《“十四五”全国眼健康规划(2021-2025)》并在其中提出进一步提高人民群众的眼健康水平,加强眼科医疗服务体系建设,持续完善眼科医疗质量控制体系,推动眼科优质医疗资源扩容并下延。
需求增加
随着日常生活中电子产品的广泛使用、生活方式转变和人口老龄化进程的加快等多种因素叠加,近年来各类眼病发病率呈上升趋势,眼科疾病患者人数持续增长。同时,我国眼科专业资源如眼科专业人员和先进医疗设备的不断完善也一定程度上提升眼科疾病的诊断率,存在眼科治疗需求的人群数量增加。此外,居民的可支配收入增长以及眼科疾病防治意识逐步增强等因素,也造成治疗需求的日渐旺盛,眼科用药需求不断扩大,而眼病在治疗上仍存在着较大的用药缺口,我国大量但未获得充分治疗的眼科疾病患者群体亟待有效的治疗药物和创新疗法的出现。
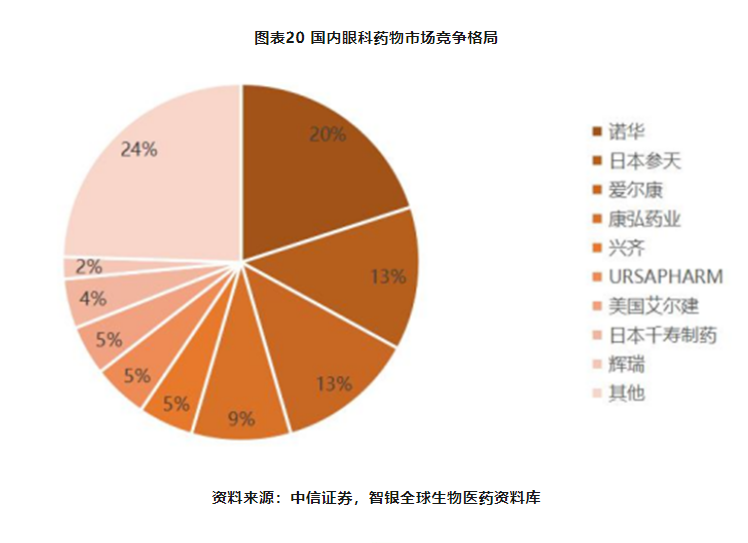
第二部分:眼科创新药赛道图谱:“黄金赛道,广阔的市场空间”
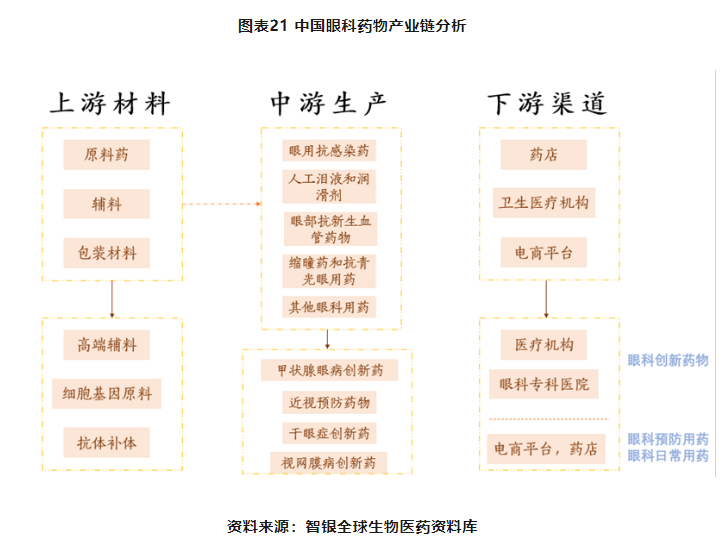
目前眼科药物产业链上游是眼科药物生产所需的原料药和辅料,主要是玻璃酸钠、去纤维蛋白小牛血、低密聚乙烯3020D、硝酸毛果芸香碱、低密聚乙烯18D、托吡卡胺、乙醇、色甘酸钠、高密聚乙烯。药科药物生产商将这些原材料加工为眼科药物。
未来随着眼科创新药的介入,产业链上游将逐渐往细胞蛋白原料,抗体补体生产,高端药用辅料转移。
眼科药物产业链中游主要是各类眼科药物研发和生产企业。目前,我国眼科创新药物细分领域中,主要类型为近视预防用药,眼用抗感染药、其他眼科用药、人工泪液和眼润滑剂、眼部抗新生血管药物、缩瞳药和抗青光眼用药等。
眼用抗感染药主要用于治疗细菌性结膜炎、角膜炎、角膜溃疡、泪囊炎、术后感染等外眼感染,市场主要产品有氧氟沙星、左氧氟沙星、盐酸左氧氟沙星等。
人工泪液和眼润滑剂主要用于治疗干眼症等眼科疾病,市场主要产品有维生素A棕榈酸酯眼用凝胶、透明质酸钠滴眼液等。
其他眼科用药主要用于治疗在其他细分眼科用药中未涵盖的眼科疾病,市场主要产品有小牛血去蛋白提取物眼用凝胶、重组牛碱性成纤维细胞生长因子滴眼液、卵磷脂络合碘片等。
而随着创新型的眼科药物也逐渐进入国内市场。未来产业链的中游将集中在近视预防用药,干眼症创新药,视网膜病创新药,甲状腺眼病创新药。接下来我们将对部分赛道进行剖析。
眼科药物产业链下游销售渠道主要是药店、医疗卫生机构、电商平台。而未来,产业链下游将会呈现两级分化的趋势,创新型高端药科药物将会集中在医疗机构和专业的眼科医院交付给患者,而日常眼部用药,预防用药等将集中在电商平台。
近视预防用药:低浓度阿托品,未来潜力无限
作为延缓近视的唯一药物,在全球具有极高关注度:传统治疗近视的方法主要为屈光手术、角膜塑形镜、框架眼镜等,目前,低浓度(0.01~0.05%)阿托品长期使用对近视控制的疗效及安全性已在国际上得到众多临床研究(包括大样本安慰剂对照的随机临床试验)的初步证实,在国际学术界上被公认是唯一一个能有效延缓近视的药物。就国内情况而言,在2019年国家卫健委发布的《儿童青少年防控近视适宜技术指南》中,明确指出低浓度阿托品滴眼液可以有效减缓青少年近视进展。且在2021年11月,山东省内首个获批的0.01%硫酸阿托品滴眼液院内制剂正式在山东第一医科大学附属眼科医院上市。
9家眼科药企/机构临床进展较快,国内已有多家医院应用于临床:截止到2021年,新加坡、日本、中国香港及台湾等国家和地区已经有低浓度阿托品产品上市销售,而在国内,则更多地以院内制剂的方式应用于临床。除此之外,国际上同时有多个多中心上市前临床试验正在进行中,有希望在接下来3-5年内获得美国FDA上市许可。根据蛋壳研究院统计,在全球范围内,目前已有包括极目生物、兆科眼科、兴齐眼药、欧康维视等在内的9家企业或机构的产品管线进入临床Ⅲ期,有望在该市场上获得先发优势。
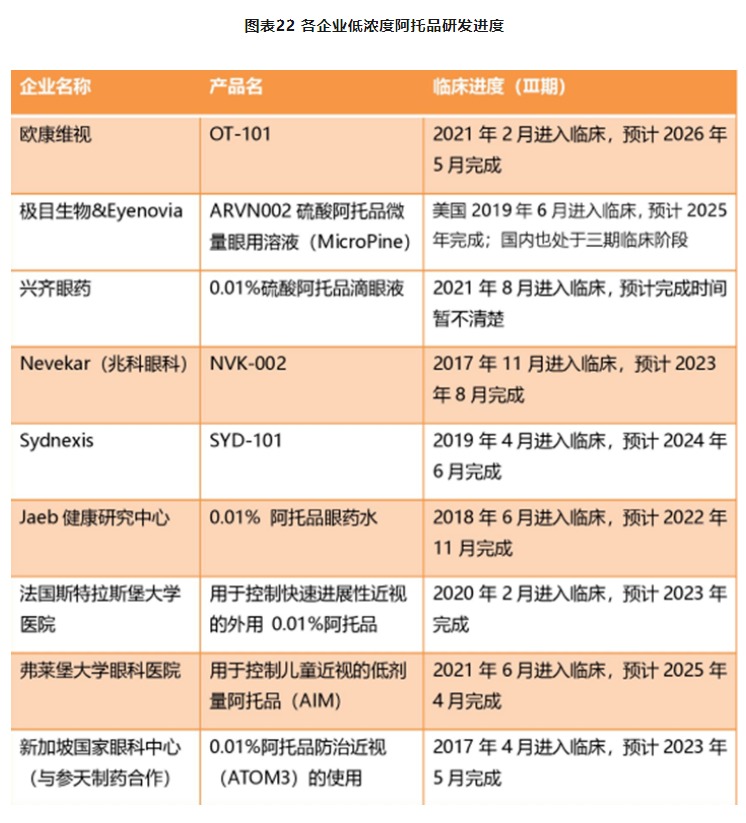
资料来源:ClincicalTrials,蛋壳研究院,智银全球生物医药资料库
国内近视率居高不下,国内低浓度阿托品市场规模高达180亿元:我国目前拥有8000万6-15岁的近视群体,若国内阿托品正式上市,按照每年1500元的客单价及15%的渗透率进行计算,国内低浓度阿托品的理论市场规模可达180亿元。低浓度阿托品的局限性导致其发展过程中争议不断:低浓度阿托品仅仅只能控制近视,而不能达到近视矫正的效果,因此使用低浓度阿托品的患者在日间仍需佩戴框架眼镜或采取其他措施以获得正常视力。
这意味着阿托品无法取代角膜塑形镜等近视矫正方式的地位,而只能作为其他近视矫正措施的补充疗法。
干眼症药物:新机制创新药物打破传统药物局限性
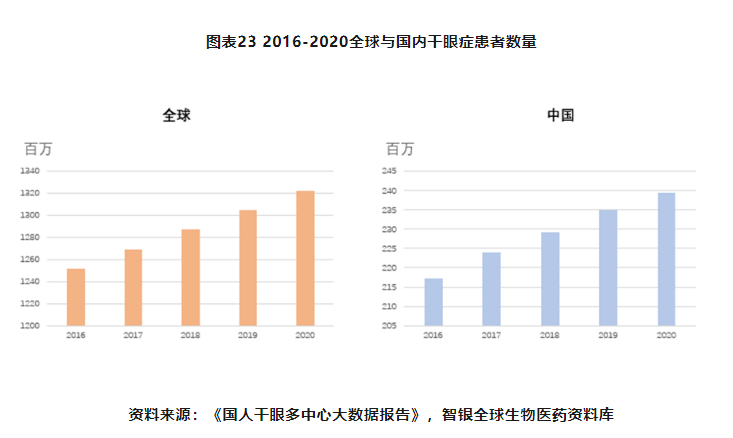
干眼症患者群体超3亿,市场广阔,发病因素多样:干眼是由多类原因造成泪液质或量异常或动力学异常,进而导致泪膜稳定性下降,是一种现代人的高发眼病。根据《中国干眼专家共识:定义和分类(2020年)》,干眼为多因素引起的慢性眼表疾病,可伴有眼表炎性反应、组织损伤及神经异常,造成眼部多种不适症状和/或视功能障碍。干眼的发病因素多样,在诊断过程中找出病因并对症治疗非常重要。根据2020年发布的《国人干眼多中心大数据报告》,保守估计目前我国干眼症患者约有2.4亿,患病率在20%左右,而治疗率仅为10%。
患病人群在年龄及性别上分布广泛,老年人、绝经后女性、常戴隐形眼镜的人群均是干眼症易患人群,而随着互联网和手机的发展,中青年及儿童的患病率也在进一步增高。干眼症药物潜在市场空间广阔,据统计,2022年,国内中重度干眼症市场规模接近12亿人民币,未来五年平均增速将达到30%以上。传统干眼症药物赛道拥挤、在治疗效果上存在一定局限性:目前,干眼症主要治疗药物包括人工泪液、润滑膏剂、局部抗炎药及自体血清等。
从发展历程上来看,人工泪液为干眼症治疗的第一个阶段,包括诺华、艾尔建、参天在内的国际头部企业位于第一梯队,但以玻璃酸钠为代表的人工泪液只能针对干眼症轻度患者。第二个阶段则是针对中重度患者的抗炎药物的兴起,国外使用最多的是环孢素滴眼液(国内还处于开拓阶段)。
2002年,Allergan(现为艾伯维)开发的0.05%环孢素制剂Restasis,在临床实验中以微弱的优势在美获批上市,打破中重度干眼症无有效药物的空白局面。Restasis是一种水包油阴离子型环孢霉素A乳剂,用于慢性、中至重度干眼症的长期治疗。
2016年,由Shire公司研发的Xiidra获FDA批准进入市场。Xiidra是一种新型的小分子整合素抑制剂,可结合整合素LFA-1(淋巴细胞功能相关抗原-1),阻断LFA-1与同源配体ICAM-1(胞间粘附分子-1)的相互作用。LFA-1是存在于白细胞表面的一种蛋白。在干眼病中,ICAM-1在角膜和结膜组织中过量表达。LFA-1/ICAM-1相互作用促进免疫突触的形成,导致T细胞激活并迁移至目标组织。Xiidra是首个被批准用于治疗眼损伤迹象和患者症状的干眼病疗法。
2018年,印度太阳制药公司研发的Cequa获FDA批准,用于干眼症患者的治疗。Cequa是环孢素浓度为0.09%的新型专利纳米胶束配方,是一种不含防腐剂的清透水溶液。
2019年6月1日,太阳制药将Cequa大中华区的开发和商业化权利授权给康哲药业。
另外,2015年日本眼科领域领导者参天制药研发的Ikervis(环孢素)获欧盟委员会(EC)批准,用于经人工泪液治疗未得到改善的干眼病成人患者严重角膜炎的治疗。它是首个将一日两次用药降为一日一次的无防腐剂配方滴眼液。
国内对于环孢素滴眼液,2020年6月23日,兴齐眼药的0.05%环孢素滴眼液正式获得NMPA批准上市,成为中国首个获批上市的用于干眼症的环孢素眼用制剂,商品名为兹润。
而目前目前国内干眼症患者以糖皮质激素为主要抗炎手段,但其副作用较大,不能长时间使用。目前,我国中重度干眼症患者的占比已经达到50%左右,但对于干眼症的疗法非常单一,市场对于新型药物及疗法的开发非常迫切。
图表24 干眼症滴眼液的发展
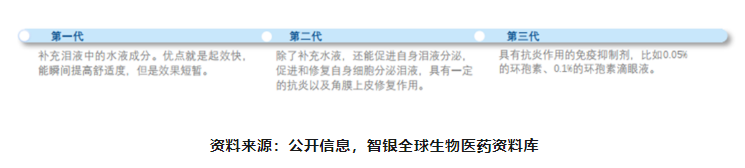
老花眼药物:药物稀缺,随老龄化进程需求增大
老花眼是一种自然的生理现象,是人们步入中老年后必然会出现的视觉问题。老视的实质是眼的调节能力的减退,调节即眼的屈光力的增加是通过晶体的塑形、变凸来实现的。年龄则是影响调节力的一个最主要的因素,随着年龄的增长,晶状体逐渐硬化,弹性减弱,睫状肌的功能逐渐减低,从而引起眼的调节功能逐渐下降,从而导致变焦降低。因此,由于投影到视网膜上时图像无法完全聚焦,观看靠近的物体时物体会变得模糊。
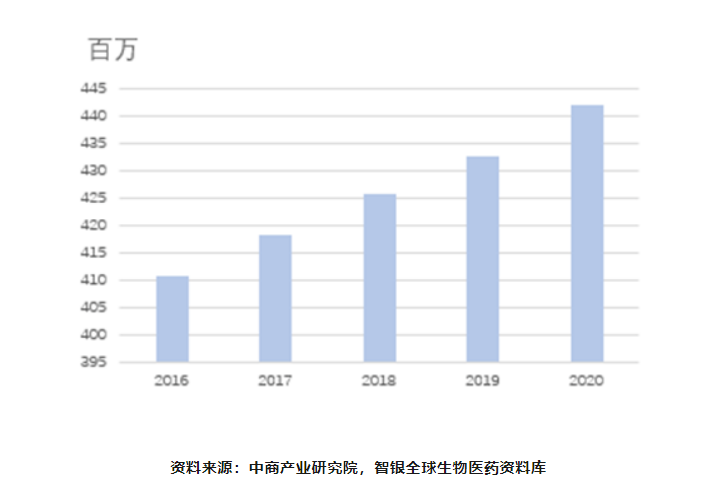
老视通常在38岁左右出现,发病高峰是在42~44岁,几乎所有患者在50岁左右时都会出现老视症状。年龄是影响老视患病率最主要的因素,随着中国老龄化进程加剧,患病人数呈连续增长的趋势,据估计,2020年全国约有4.4亿老视患者。
图表25 中国老花眼患者数量
老视的治疗方法主要包括非手术矫正和手术矫正方法,非手术方法包括框架眼镜和角膜接触镜;
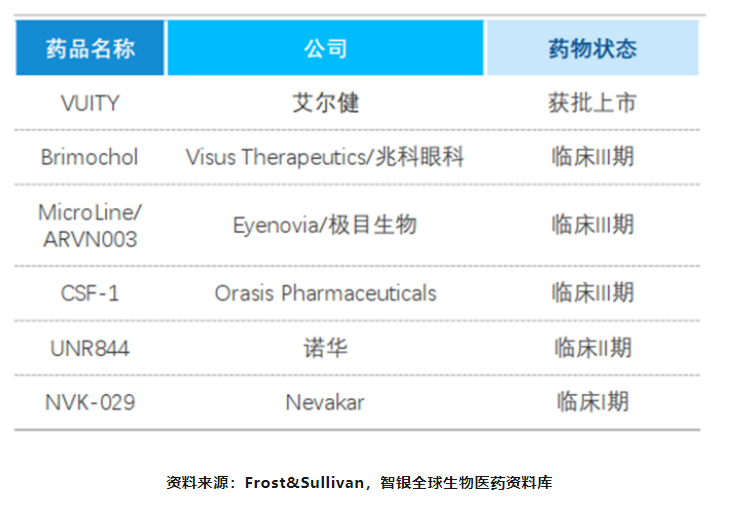
目前,全球获批上市的老视药物有1款,为艾尔健的VUITY(盐酸毛果芸香碱滴眼液),进入临床阶段的药物有10款。但针对老视目前尚无药物可以达到彻底治愈效果,全球获批的唯一一款应用于老视适应症的药物VUITY仅能缓解其症状,VUITY用药后起效迅速,视觉持久改善时间约6小时。
图表26 全球上市、在研老花眼药物
2021年,Vurity作为首款且目前唯一一款用于治疗老视的滴眼液于美国获批上市,全球老视药物市场将开始扩大,预计于2025年达将到16亿美元,于2030年将达到43亿美元,2025到2030年CAGR为21.4%。
预计2024年老视市场规模为3亿,且以较高增速增长,从2025年的12亿元增长到2030年的63亿元,复合年增长率为39.8%。
甲状腺相关眼病药物:新兴特效药暂未进入国内市场
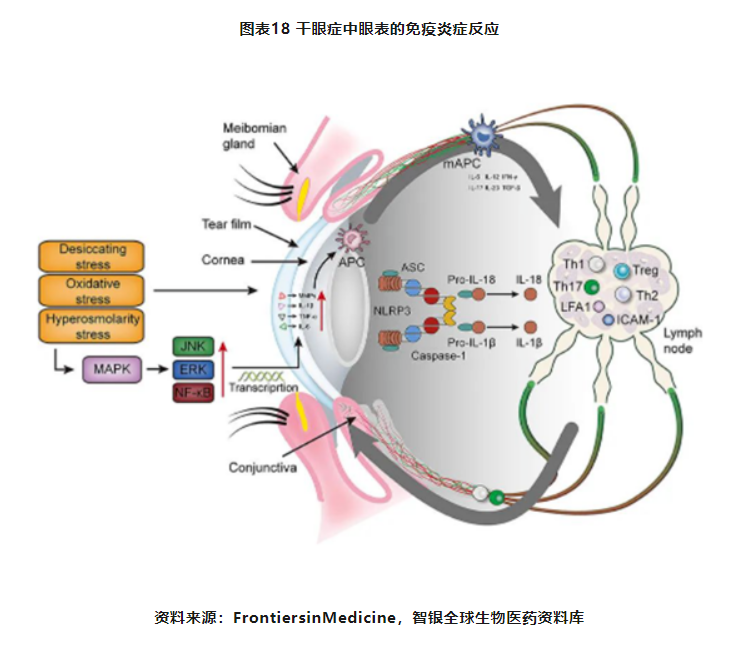
甲状腺相关眼病(thyroidassociatedophthalmopathy,TAO),最常见的甲状腺腺外表现,占眼眶疾病的20%,是成人患病率最高的眼眶疾病,临床主要表现为眼球突出、眼睑退缩、水肿、眶周组织炎症等,进一步发展可影响视力甚至导致失明。
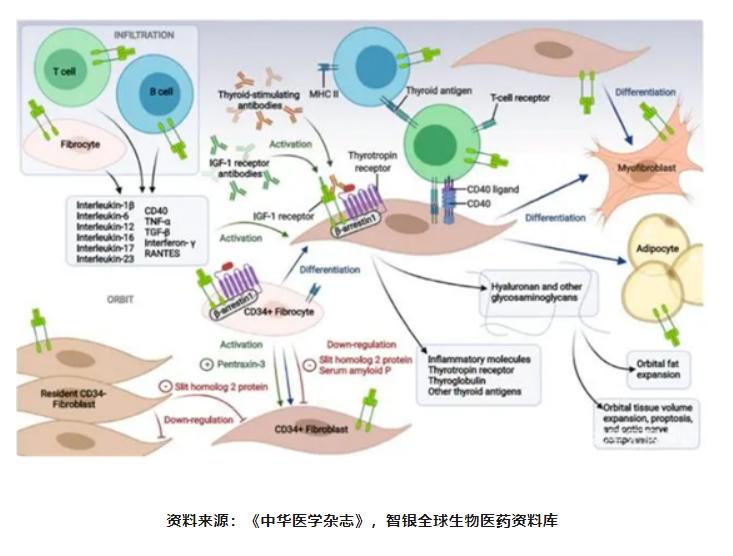
TAO的发病机制尚不完全清楚,目前认为其是一种由免疫、遗传、环境等多因素参与的疾病。TAO的本质是患者自身免疫功能紊乱引起的器官特异性自身免疫性疾病,细胞免疫(Th1,Th2,Th17、Treg细胞等)、体液免疫(自身抗体)、眼眶成纤维细胞(orbitalfibroblast,OF)均参与TAO的发生和发展。
OF是TAO的主要靶点,其在发病过程中既是靶细胞又是效应细胞。正常情况下由于免疫耐受的存在,机体不对自身组织和器官产生免疫反应,但在抗原刺激时机体免疫耐受失去平衡,导致致敏性T细胞、B细胞被激活,与OF相互活化,产生炎症因子和自身抗体,继而引起一系列的眼眶内炎症反应,导致眼肌纤维化、脂肪细胞增生和眼外肌肿胀,进而出现眼球突出等表现。
IGF-1R在人体全身和眼眶组织中广泛表达,IGF-1与IGF-1R结合后产生的一系列信号转导与TAO局部炎症发生、发展密切相关4。近年来IGF-1R也成为研发治疗TAO药物的靶点,为TAO患者的治疗带来新的希望。
图表27 甲状腺相关眼病理论模型
目前治疗TAO唯一获批的药物为Horizon的Tepezza,Tepezza是Horizon2017年花费1.45亿美元从RVDC处收购,用于治疗甲状腺眼病。2020年1月Tepezza通过FDA批准上市,是首个获批用于治疗TED的药物。Tepezza上市第一年便实现8.2亿美元的销售额;2021年销售额16.6亿美金,2022前三季度销售额达15亿美金。Horizon预计Tepezza销售峰值将超过40亿美元(现Horizon已被安进以278亿美元收购)。
图表28 Tepezza药物上市后销售数据
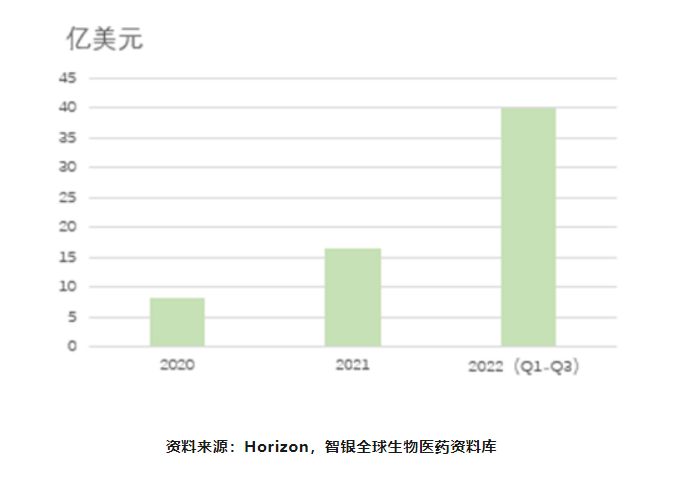
根据文献报道,甲状腺相关眼病患病率为男性每年0.54人/10万,女性每年2.67~3.3人/10万,女性多于男性。其中,40~60岁患病率最高。虽然TAO眼病患病率偏低,但对患者日常生活的影响巨大,大多因容貌,造成患者心理负担,就业和生存压力。即使是轻症也会影响患者生活质量,并对社会公共卫生健康成本造成一定负担。目前中国约有患者400万人,全球患病人数超3亿。
第三部分:国内外眼科代表性公司成长分析
1、国外主要眼科创新药公司
在众多的国外眼科创新药开发公司中,我们选择两家公司进行分析,一家专注于治疗老年性黄斑变性继发的地理性萎缩,而另一家则专注于抗VEGF治疗,两家公司具有各自的特色并且在眼科创新药领域有着自身独特的技术壁垒。
(1)IvericBio
IvericBio是一家科学驱动的生物制药公司,专注于发现和开发具有重大未满足医疗需求的视网膜疾病的新疗法。公司致力于通过提供高质量、安全和有效的治疗方法,对患者的生活产生积极影响,旨在解决使人衰弱的视网膜疾病,包括年龄相关性黄斑变性的早期阶段。其候选产品包括Zimura和基因疗法。该公司由DavidR.Guyer和SamirChandrakantPatel于2007年1月5日创立,总部设在新泽西州帕西帕尼。

GlennP.Sblendorio是IvericBio的首席执行官。他于2016年加入公司,担任执行副总裁、首席运营官和首席财务官,并于2017年1月被任命为总裁,同时继续担任首席财务官。他于2017年4月辞去首席财务官一职。斯布伦多里奥曾在2013年至2016年担任IvericBio的董事会成员,并于2017年5月重新加入董事会。
在加入IvericBio之前,他于2006年至2016年担任医药公司总裁兼首席财务官兼董事会成员。Sblendorio先生在2002年至2005年Eyetech制药公司担任OSI制药公司时担任执行副总裁兼首席财务官。2000年至2002年,他担任医药公司负责业务发展的高级副总裁。他的制药经验还包括在霍夫曼-拉罗什公司担任各种高级财务职位的12年。斯布伦多里奥先生目前是Amicus治疗公司和Intercept制药公司的董事会成员。Sblendorio先生拥有佩斯大学的学士学位和费尔利·迪金森大学的MBA学位,毕业于哈佛商学院高级管理课程。
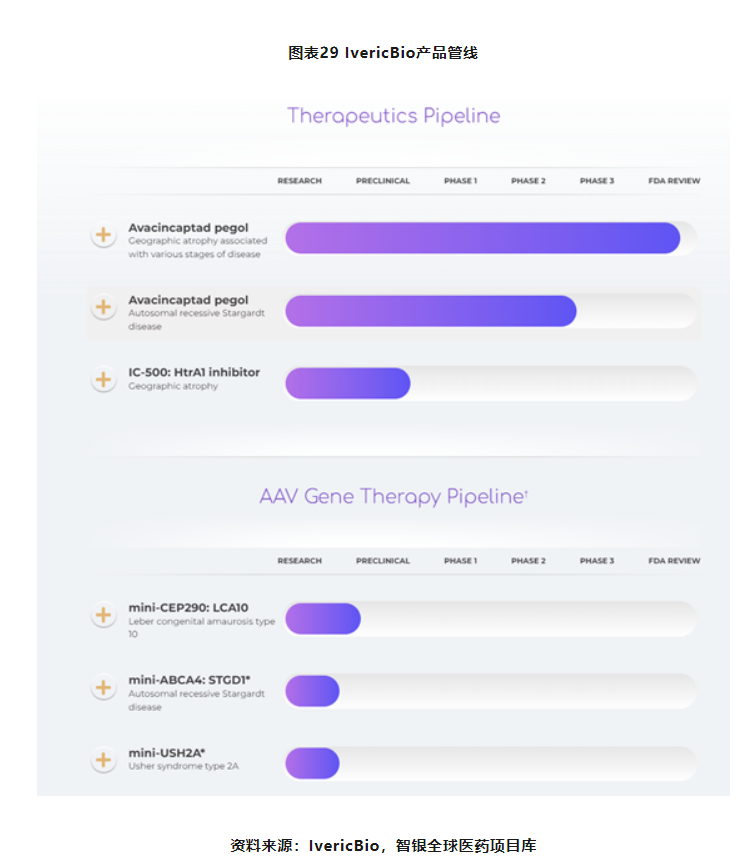
产品管线
2022年11月3日,IvericBio宣布已向FDA提交其主要产品avacincaptadpegol(ACP,也称为Zimura)新药申请(NDA)的第一部分“滚动式审查”(rollingreview),公司在今年年底前完成新药申请的最后部分。这是全球第2款申报上市的GA疗法,也是全球第4款申报上市的补体C5靶向疗法。
这是一种新型的补体C5抑制剂,用于治疗老年性黄斑变性继发的地理性萎缩(GA)。迄今为止,ACP是第一个也是唯一一个获得该适应症突破性疗法认定的研究性疗法,该认定是基于GATHER1和GATHER2关键临床试验中12个月的预设主要终点数据。
公司针对其他视网膜疾病的创新疗法也在同步推进当中。
技术路径
公司通过“腺相关病毒(AAV)”技术进行基因治疗的研发。由于部分基因体积较大(例如引起Stargardt病的ABCA4基因;LCA10的CEP290基因),常规AAV技术无法完全加载正确基因,导致在相关研发上出现障碍。公司正在开发一种与突变基因无关的小基因(既miniABCA4或miniCEP290),这些创新的与突变无关的小基因策略,不仅适合AAV载体,而且可以转录相关功能蛋白,起到治愈的可能。
“Zimura”被设计用于靶向抑制补体蛋白C5,形成C5A和C5B。通过它们的形成,可以减少炎症化,从而有可能避免或减缓RPE(视网膜色素上皮层)细胞变性。这一种疗法可以有效治疗因RPE损伤导致的“干性AMD“和”Stargardt病“。
GATHER1与GATHER2作为Zimura基于关键的临床试验项目,在12个月的时间点上均达到减缓GA进展的主要目标,并具有统计学意义,该公司要求滚动提交其计划的NDA,FDA随后批准该申请。根据公司与FDA的协议,NDA的第一部分,将包括完整的ACP临床数据包,相关数据已在2022年11月3日早些时间完成提交工作。
图表30 ZimuraGATHER临床实验结果(GA必须是在1500µm范围内的部分,但不涉及中心点)

财务状况
根据公司2022年第三季度财报,公司2022年第三季度季度报告净亏损$4240万,2021年同期净亏损$2460万。在截至2022年9月30日的9个月中,该公司报告净亏损$1.262亿。
截至2022年9月30日,该公司拥有$3.21亿的现金、现金等价物和可供出售证券,这反映其与Hercules和SVB的定期贷款债务融资工具下的$5000万初始借款的影响。该公司预计其2022年年底的现金、现金等价物和可供出售证券将在$2.65亿~$2.75亿,至少能维持到2024年年中的正常运营。
2022年第三季度公司研发支出为$2500万,2021年同期为$1790万。截至2022年9月30日的9个月,研发费用为$8120万,2021年同期为$6000万。研究和开发费用的增加主要是由于公司GATHER2试验的持续进展、ACP制造活动的增加以及人员成本的增加,包括增加研究和开发人员相关的基于股份的薪酬,但被与公司基因治疗计划相关的成本下降所抵消。
(2)EyePointPharmaceuticals
EyePointPharmaceuticals(纳斯达克股票代码:EYPT)是一家致力于开发和商业化治疗药物的制药公司,帮助改善严重眼疾患者的生活。公司于2008年3月成立。该公司致力于开发和商业化具有高医疗需求的创新眼科产品,以帮助改善严重眼病患者的生活。该公司的临床前开发项目专注于运用其核心Durasert和Verisome技术平台,研发治疗老龄化与相关的黄斑变性、青光眼、骨关节炎和其他疾病的药物。
其前身为pSivida有限公司。公司的产品线利用其专有的Durasert®技术进行眼内持续给药,包括EYP-1901,这是一种研究性的持续给药玻璃体内抗VEGF治疗,最初针对湿性年龄相关性黄斑变性。Durasert给药平台已经在美国FDA批准的四种产品中安全地用于数千名患者的眼睛,包括用于治疗影响眼睛后段的慢性非感染性葡萄膜炎的YUTIQ®,该产品目前由公司进行销售。EyePoint制药公司的总部设在马萨诸塞州的沃特敦。

NancyLurker作为总裁,首席执行官兼董事会董事,NancyLurker领导EyePointPharmaceuticals的使命是改善面临严重眼部疾病的人们的生活。她在制药行业拥有30多年的经验,推动公共和私营公司的科学和商业创新,为患者带来创新的疗法和解决方案。
在加入EyePoint之前,Lurker担任PDI的总裁,首席执行官和董事会董事,PDI是一家在纳斯达克上市的医疗保健商业化公司,现在名为InterpaceDiagnosticsGroup。在加入PDI之前,她是诺华制药公司的高级副总裁兼首席营销官。她还曾担任私营医疗保健信息公司ImpactRx的总裁兼首席执行官。在加入ImpactRx之前,Lurker是PharmaciaCorporation全球初级保健产品的集团副总裁,也是其美国执行管理委员会的成员。她的职业生涯始于百时美施贵宝(BristolMyersSquibb)的高级医疗代表,在那里她迅速晋升为全球心血管特许经营管理高级总监,监督许多成功的药物发布。Lurker曾在公共和私营公司以及倡导组织的众多董事会任职。她拥有西雅图太平洋大学生物学学士学位和埃文斯维尔大学工商管理硕士学位。
技术与产品管线
EyePoint专注于开发持续释放药物,以治疗眼部衰弱性疾病和其他局部慢性疾病。目前,该公司有两项专利性技术平台:DurasertTM和VerisomeTM技术。
DurasertTM技术是一种小型、可注射、持续释放的药物传输系统,可持续释放小分子药物长达三年。迄今为止,使用该项技术的四种产品已获经FDA批准。这些产品包括YUTIQTM(玻璃体内植入式氟轻松)0.18mg、ILUVIEN®(玻璃体内植入式氟轻松)0.19mg、RETISERT®(玻璃体内植入式氟轻松)0.59mg和VITRASERT®(更昔洛韦)4.5mg。
VerisomeTM技术可在悬浮液中持续释放小分子,一次注射即可1-6个月缓释,应用该技术的DEXYCU(地塞米松眼内悬浮液)9%已获FDA批准。目前,EyePoint已研发出5种经FDA批准的眼科缓释治疗药物。
DurasertTM技术是一种小型、可注射、持续释放的药物传输系统,可持续释放小分子药物长达三年。迄今为止,使用该项技术的四种产品已获经FDA批准。这些产品包括YUTIQTM(玻璃体内植入式氟轻松)0.18mg、ILUVIEN®(玻璃体内植入式氟轻松)0.19mg、RETISERT®(玻璃体内植入式氟轻松)0.59mg和VITRASERT®(更昔洛韦)4.5mg。
VerisomeTM技术可在悬浮液中持续释放小分子,一次注射即可1-6个月缓释,应用该技术的DEXYCU(地塞米松眼内悬浮液)9%已获FDA批准。目前,EyePoint已研发出5种经FDA批准的眼科缓释治疗药物。

而公司利用其独有的BioerodableDurasert™技术开发vorolanib为眼科疗法产品EYP-1901。EYP-1901的活性成分vorolanib(伏罗尼布)是一款具有全新化学结构的新一代多靶点激酶抑制剂,作用于VEGFR、PDGFR、c-Kit、Flt-3、CSF1R等多个靶点,可抑制肿瘤血管生成及生长,而且还能够满足靶点的特殊PK/PD要求,达到保留活性、降低毒性的目的。

2022年7月ASRS2022年会上公布EYP-1901治疗湿性AMD的1期DAVIO临床试验的12个月数据。所提供的数据强化EYP-1901的积极安全性和有效性,并显示没有剂量限制性毒性,没有关于眼部严重不良事件的报告,也没有与药物相关的全身性SAE。数据证实稳定的BCVA、稳定的OCT中心亚视野厚度,以及临床上显着降低74%的治疗负担,6个月时为79%。这些数据还显示,在单剂EYP-1901后,53%的眼睛在长达6个月和长达12个月内不需要任何补充抗VEGF注射。
2022年7月在EYP-1901治疗湿性AMD的为期12个月的随机对照试验,即2期DAVIO2临床试验,完成第一位患者被给药,预计将招募大约150名先前接受过标准护理抗VEGF治疗的患者,预计在2023年下半年获得一线数据。(NCT05381948)。
财务状况
EyePointPharmaceuticals2022年11月2日报告称,其2022年第三季度的净收入为1000万美元,比2021年第三季度的910万美元增加9.9%。
第三季度净产品收入为970万美元,比2021年第三季度的860万美元增长12.8%。主要源于Yutiq在视网膜疾病领域的市场需求提升。
EyePoint表示,Yutiq和Dexycu的2022年第三季度净产品收入分别为730万美元和240万美元。Yutiq的销售数量为890台,Dexycu为14,100台。
该公司还表示,由于医疗保险和医疗补助服务中心没有将Dexycu的直通报销状态延长至2022年以后,该公司已终止与ImprimisRx就Dexycu的分销协议,自2022年12月31日起生效。
其2022年第二季度的收入为1160万美元,比2021年第二季度的900万美元增长29%。产品净收入为1130万美元,其中Yutiq为740万美元,Dexycu为390万美元,而2021年第二季度的产品净收入为870万美元。销售额包括大约900台Yutiq,较2022年第一季度增长约40%;14,700台Dexycu,与2022年第一季度一致。
本季度特许权使用费和合作净收入总计30万美元,与2021年同期的30万美元持平。
手头现金和投资2022年6月30日总计1.712亿美元,加上产品销售的预期净现金流入,将足够使当前计划运营到2024年下半年。
2022年5月,与贝达药业签订独家许可协议,负责EYP-1901在大中华区开发和商业化。同时,EyePoint和贝达的附属公司-EquinoxSciences对其2020年独家许可协议进行修订,扩大EyePoint开发和商业化vorolanib的独家权利,后者是用于EYP-1901的酪氨酸激酶抑制剂,EyePoint负责新治疗方案EYP-1901的开发和中国(包括香港、澳门和台湾)区域外的全球商业化,用于治疗湿性年龄相关性黄斑变性(w-AMD)、糖尿病视网膜病变(DR)和视网膜静脉阻塞(RVO)。
2022年6月,授权与欧康维视的YUTIQ®(氟轻松玻璃体内植入物)0.18mg获得NMPA批准,用于治疗影响眼后段的慢性非感染性葡萄膜炎。
2、国内主要眼科创新药公司
而反观国内,极目生物和拔云制药也走在了眼科创新药的前列,两公司有着共同的特色,即创始团队的高学历,高技术背景,这无不表示这眼科药物的高技术壁垒。
(1)极目生物
极目生物是一家总部位于中国、专注于眼科创新疗法的生物技术公司,拥有覆盖从早期发现阶段到商业化阶段的一系列突破性眼科治疗技术产品组合。公司通过自主研发以及与全球领先的制药企业联合创新的模式,构建丰富的全球化产品管线。
公司的愿景是,通过在中国、亚洲乃至全球提供创新疗法,解决眼科疾病领域未满足的临床需求,惠及广大眼科患者群体。极目生物在生命科学领域专业投资方的支持下创立,并由一支拥有丰富的全球眼科产品研发和商业化经验的行业精英团队管理。

胡海迪博士是极目生物的创始人兼首席执行官,在创立极目生物之前,他是上海拓臻生物的负责人,负责指导和监督研发活动的各个方面以及一般管理职责。在此之前,他是艾尔建中国的执行医学总监,负责艾尔建在中国的整体临床研发、医学事务和产品管线战略。胡博士的职业生涯始于诺华,在诺华公司任职期间,他在巴塞尔、香港和台湾担任过各种职务,获得第一手的全球经验。在诺华公司总部,他曾担任AMAC(亚太、中东和非洲国家)、中国和日本的区域医学负责人和健康经济与成果研究(HEOR)负责人。胡博士毕业于香港科技大学,获得生物化学学士及博士学位。
产品管线
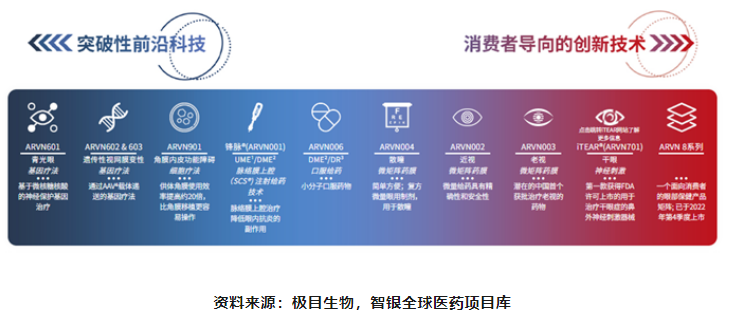
在产品管线方面,极目生物不仅拥有脉络膜上腔注射创新给药技术,角膜内皮细胞疗法、青光眼神经保护基因疗法等前沿科技,也差异化布局了包括近视微矩阵药膜递送疗法、老视微矩阵药膜递送疗法、全球首创的体外神经刺激干眼治疗器械在内的消费者导向创新技术。
图表33 极目生物产品管线

资料来源:极目生物,智银全球医药项目库
核心技术
“引入+合作开发+自主研发”三线并行,赋能管线创新:除引进全球最具突破性的眼科疗法外,极目生物也入驻强生JLABS@上海,搭建自主研发平台,并与香港大学、温州医科大学附属眼视光医院等多个研究机构合作探索创新眼科诊疗方案。
“双引擎”战略驱动,布局前沿科技与消费医疗:极目生物不仅拥有脉络膜上腔注射创新给药技术,角膜内皮细胞疗法、青光眼神经保护基因疗法等前沿科技,也差异化布局了包括近视微矩阵药膜递送疗法、老视微矩阵药膜递送疗法、全球首创的体外神经刺激干眼治疗器械在内的消费者导向创新技术。
创新商业化模式,构建全生命周期产品生态:“极目生物对产品进行全生命周期管理,从产品立项、科学研发,到销售平台搭建,在双引擎战略的引导下,极目生物的商业化部署全程参与其中。”相比于同类公司,极目生物致力于从产品技术与商业模式上探索全面创新。通过智能互联、App追踪等数字管理平台,搭建一个面向家庭各年龄段成员的眼健康管理“生态圈”,形成“产品+服务”的闭环。“在商业打法上,极目生物结合其产品管线的特点,不仅聚焦200家头部医院,同时还将依托互联网渠道,提升覆盖效率,有效推动和释放眼科市场的真正潜力。”
图表34 极目生物双引擎战略指导下的产品布局
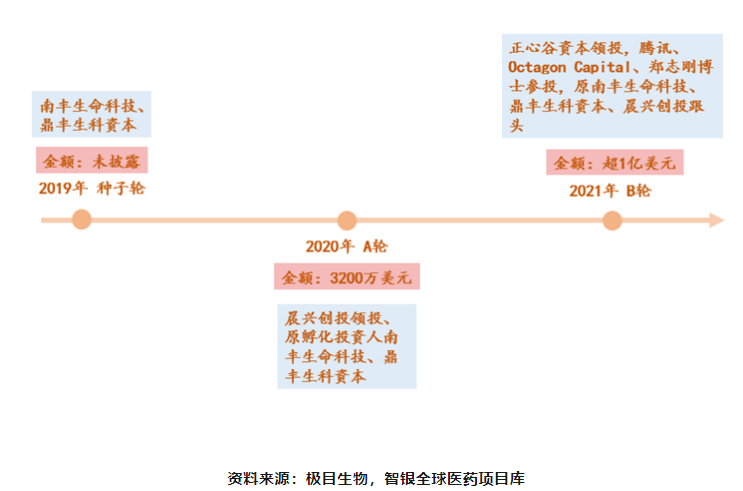
融资进程
图表35 极目生物融资信息
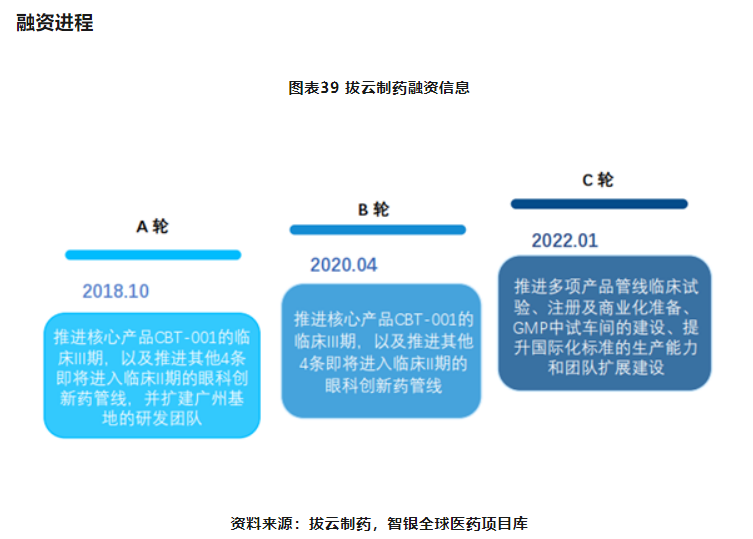
(2)拔云制药
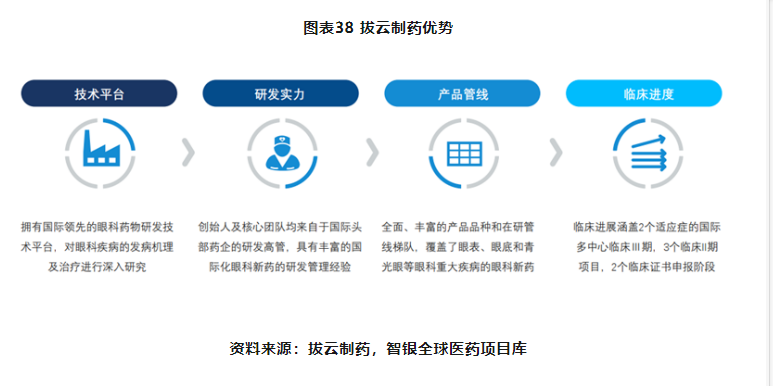
拨云制药,于2015年在美国加州创立,于2018年成立广州公司、2021年成立苏州公司并建设研发和生产基地。作为一家国际化的专注于眼科新药研发和产业化的生物医药公司,拨云制药秉承GlobalMarketGlobalNew(全球市场、全球新)的理念,强调产品的创新性和差异性,全部产品均为自主研创、拥有全球权益,产品多为国际首创的新适应症和国际首创机理的firstinclass新药,覆盖了眼表、眼底和青光眼等眼科重大疾病的眼科新药(其中涵盖2个适应症的国际多中心临床Ⅲ期,3个美国临床II期,2个临床证书申报阶段,还有3个临床前研究项目)。

倪劲松博士,安徽芜湖人,先后毕业于南京大学化学系(学士)、加拿大布鲁克大学(硕士)、加拿大多伦多大学(博士)和美国犹他大学(博士后)。于1997年至2000年在辉瑞制药(Pfizer)担任资深研究科学家,2000年至2015年在艾力健制药(Allergan)担任科学总监,之前在惠氏/辉瑞做高级科学家3年。在这两个任职期间,倪博士参与了很多项目:成功推出许多眼科和皮肤科产品包括®,Combigan®,Lumigan®,Tazorac®和Ozurdex®Lumigan®,AllerganP®,Ozurdex®,Lumigan®,Restasis®(眼力健)和数十亿美元的产品Premarin®(惠氏)。
产品管线
拨云制药的研发管线丰富,在研产品涉及多个治疗领域,包括干眼症、结膜黄斑、糖尿病引发的视网膜病变、降眼压和视网膜保护和近视等。其中,核心产品CBT-001作为治疗翼状胬肉的国际首创新药已获准开展美国临床Ⅲ期;CBT-006运用全球首创“溶脂疏通睑板腺”的机理用于治疗睑板腺异常引发的干眼症,已在美国完成II期临床试验;应用于延缓青少年近视的CBT-009项目已获准在澳大利亚开展I/II期临床试验。
图表36 拔云制药产品管线

核心技术
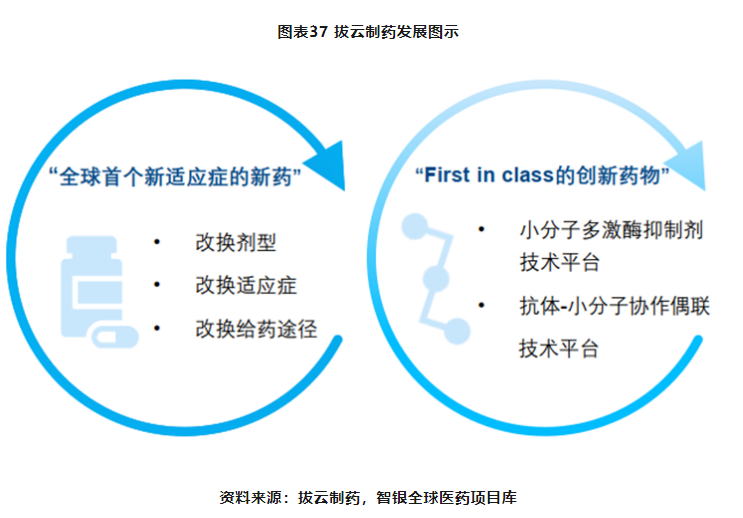
拨云制药的发展目标是建立全球市场,布局全球领先的产品管线。坚持“老药新用与创新药”双轮驱动的研发策略,老药新用主要选择“新适应症、新赛道”,通过改换剂型、改换适应症、改换给药途径的三改方式研发出多款“全球首个新适应症的新药”,同时搭建小分子药物筛选平台和抗体小分子协作偶联(ADS)研发平台,加强创新化合物的开发力度,着重研发完整自主知识产权的First-in-Class的创新药物。
第四部分:不可错过的眼科创新药企业—“普乐康”跳出红海,差异优势
苏州普乐康医药科技有限公司于2019年6月在苏州生物医药产业园注册成立。公司核心团队成员由在艾尔建、辉瑞和强生等全球知名药企及CRO工作多年的海归博士组成,具有多种生物及小分子药物产品开发的成功经验,熟悉生物药开发的生命周期全流程。在成立三年的时间里,公司已被评为苏州工业园区领军、苏州市姑苏领军和江苏省双创人才企业。
聚焦眼睛免疫微环境的调控机制和临床价值,公司全方位布局具有全新作用机制的眼科和自身免疫性疾病的创新药物研发管线,特别是免疫相关性眼病的新药开发。在较短的时间内,已将数个项目推进至临床前研究和临床试验阶段,其中治疗甲状腺相关眼病的药物已获批临床,有望成为国内第一款自主研发治疗该疾病的药物,同时标志着公司的发展进入到临床阶段。另外,公司还在其它眼科治疗领域进行了多个技术平台建设和产品管线布局,尤其是罕见病领域的药物管线布局、致力于成为眼科和自身免疫性疾病的领域的领军企业。

军事医学科学院,博士,导师:吴祖泽院士,贺福初院士;方向:基因药物开发;OHSU/HHMI,美国科学院院士EricGoaux实验室博士后;所研项目获3340万美金风险投资;美国癌症研究协会2002AACR-AflacScholar-in-TrainingAward;科技部主办的第三届中国创新创业大赛医药团体组总决赛第三名,上海赛区第一名;江苏省双创人才、苏州市领军人才、园区领军人才;2022中国眼谷眼视光创新创业全球挑战赛总决赛一等奖。
既往就职于艾尔建负责全球首个锚定蛋白药物Abicipar的CMC开发,治疗湿性年龄黄斑变性(wAMD);就职于laureatebiopharma负责抗体药物生产工艺开发及放大(放大至2500升);就职于军事医学科学院负责国内首个进入临床试验的质粒DNA基因药物,治疗肢体末端缺血,III期临床,2017年中国医药生物技术十大进展;心肌缺血绞痛腺病毒基因药物,II期临床开发。
公司的主要优势在于:其独特的分子设计使其在临床前研究中显示出了非常好的安全性和优于国外同靶点药物的治疗效果;高浓度药物皮下注射制剂的开发成功可以实现病人的自主用药管理,极大地提供了使用的便捷性并减少静脉给药可能的副反应。
技术路径
目前国内眼科药开发基础欠缺,入局较晚,水平低,仿制或license-in为主,同质化严重,而眼科药物技术壁垒高。因此面临着眼科药物发展的困局。眼科创新药依赖于创始人眼科创新药的开发经验。
普乐康基于眼睛免疫微环境免疫赦免的特点与临床价值,精准开发新药,大分子药物开发为主,兼顾小分子药物,剂型覆盖滴眼液、皮下注射和静脉输注等;进行眼科创新药新技术开发应用。
产品管线
目前公司主要有五条产品管线,涉及到五个不同的适应症。
PHP1003是用于甲状腺相关眼病等的治疗药物,是中国国内首个获批临床试验的自主研发的治疗TAO的IGF1R抗体药物,同时也是公司重要的里程碑,标志着公司从临床前阶段进入到临床阶段。此款药物直接对标Horizon的Tepezza。
而PHP0101小分子滴眼剂新型的治疗老花眼的药物。

PHP1003
如前所述,甲状腺相关眼病(thyroidassociatedophthalmopathy,TAO)、甲状腺眼病(TED),是弥漫性毒性甲状腺肿,即Graves病(GD)常见的甲状腺外临床表现,是由甲状腺上皮细胞、眼眶周围脂肪细胞及成纤维细胞表达的自身抗原引发的特异性自身免疫疾病,主要表现为眼球突出、复视、斜视、眼眶疼痛、眼睑肿胀、眼睑退缩、眼睑闭合不全等症状,严重影响容貌并可导致视力受损。甲状腺功能低下病人和甲状腺功能正常人也可发生此病。TAO的发生率占GD患者的25%~50%,在中国未列为罕见病,患病率约0.1%~0.3%,女性发病率远高于男性。此病按照疾病进展分为活动期和静止期,多年来缺乏安全有效的药物。
目前国内甲状腺眼病市场巨大但无有效治疗药物,基本无市场竞争。Teprotumumab价格昂贵,并且未披露在中国上市的计划。
苏州普乐康医药科技有限公司开发的PHP1003临床前研究展示了良好的安全性和显著的有效性,并且相较于Tepezza的静脉输注用药,普乐康开发的皮下注射制剂具有更好的使用便捷性,可以实现自主用药管理,特别是在疫情等情况下该优势和需求显得更为突出,有望为国内甲状腺眼病患者带来第一款安全、有效、买的到、用得起的治疗药物,实现零的突破。
2022年4月20日,药审中心承办了苏州普乐康医药科技有限公司1类生物制品,PHP1003注射液的临床申请。根据苏州普乐康医药的“一种抗IGF-1R抗体及其应用的制作方法”的专利,PHP1003是一种抗胰岛素样生长因子-1受体IGF-1R抗体,用于治疗甲状腺相关性眼病。
目前该药物在国内已进入I期临床,目前受试者入组顺利,预计2023年完成I期临床并开展II期临床。
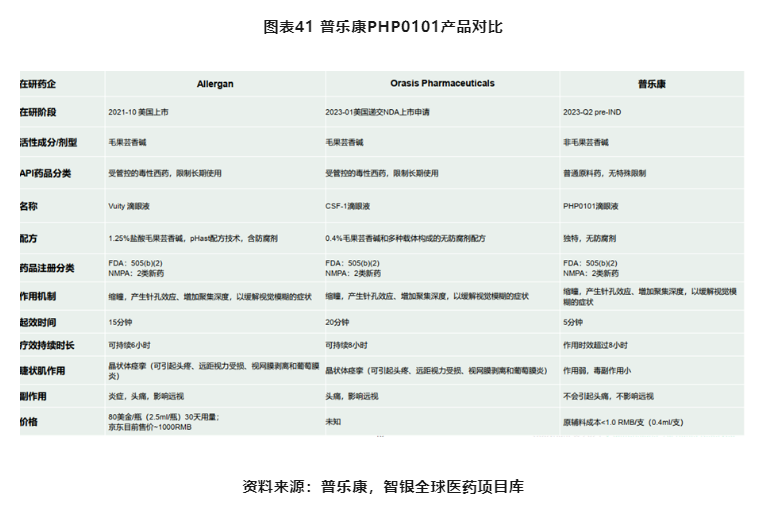
PHP0101
老花眼人群占中国总人口的近三成,除了配镜外国内市场上尚无可用于老花眼治疗的药物。38岁后老花100%发生,中国约有4.4亿,包括众多老花+近视双重患者。40-55岁老花不想戴眼镜,不服老,伴随退休延迟和屏幕用眼时间延长,近千亿潜在老花治疗市场规模
对标2021年10月获批上市的Allergan的老花眼药物Vuity,普乐康开发的治疗老花眼的产品在稳定性、对靶点的选择性、对远视视力的影响和舒适度等方面均优于前者,采用无防腐剂的BFS单剂量包装,能很好地满足老花眼人群长期的安全用药需求,明显改善生活和工作质量。该款新药管线目前正处于CMC开发阶段,正在积极准备推进申报IND。
PHP0003
目前治疗湿性年龄黄斑变性的主要产品为抗VEGF抑制剂,但该类药物需要眼内注射,使用十分不便,病人的接受度较低,易产生耐药,并且也只对一半左右的病人有效。
普乐康开发的治疗wAMD的滴眼剂具有全新的药物作用机制,解决了上述的诸多临床问题。目前该款新药正处于CMC开发阶段。
公司优势
聚焦免疫相关性眼病,基于眼睛免疫微环境免疫赦免的特点,精准开发具有创新作用机理的调节眼内免疫微环境的新药及其临床适应症的拓展,产品线包括大分子、兼顾小分子药物、以及不同剂型的眼科药物。团队拥有顶级的临床资源,前瞻性GlobalValue布局。拥有国际顶尖甲状腺眼病和眼科临床团队支持,以临床急迫性驱动的全球性创新,对标国际领先眼科药物开展差异化竞争。PCT专利,计划中美双报,并规划BD布局。
公司成立之初第二年2021年06月25日,普乐康医药完成数千万人民币的Pre-A轮融资。本轮融资由元生创投、海松资本联合领投,领军创投、元禾控股跟投。此前曾获得国鸿创投独家天使轮融资。本轮所募集资金将用于推进公司目前的眼科药物项目进入临床试验阶段和新产品线布局。

免责声明
本报告仅供智银资本(以下简称“本公司”)的客户使用。本公司不会因接收人收到本报告而视其为客户。
本报告是基于本公司认为可靠的已公开信息,但本公司不保证该等信息的准确性或完整性。本报告所载的资料、工具、意见及推测只提供给客户作参考之用,并非作为或被视为出售或购买证券或其他投资标的的邀请或向人作出邀请。
客户应当认识到有关本报告的相关推荐等只是研究观点的简要沟通,需以本公司刊载的完整报告为准。
本报告所载的资料、意见及推测仅反映本公司于发布本报告当日的判断,本报告所指的证券或投资标的的价格、价值及投资收入可能会波动。在不同时期,本公司可发出与本报告所载资料、意见及推测不一致的报告。
客户应当考虑到本公司可能存在可能影响本报告客观性的利益冲突,不应视本报告为作出投资决策的惟一因素。本报告中所指的投资及服务可能不适合个别客户,不构成客户私人咨询建议。本公司未确保本报告充分考虑到个别客户特殊的投资目标、财务状况或需要。本公司建议客户应考虑本报告的任何意见或建议是否符合其特定状况,以及(若有必要)咨询独立投资顾问。
在任何情况下,本报告中的信息或所表述的意见并不构成对任何人的投资建议。在任何情况下,本公司不对任何人因使用本报告中的任何内容所引致的任何损失负任何责任。
若本报告的接收人非本公司的客户,应在基于本报告作出任何投资决定或就本报告要求任何解释前咨询独立投资顾问。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China