2023年12月,艾伯维宣布以87亿美元收购神经科学领域的生物技术公司Cerevel Therapeutics,囊获多款治疗精神神经类疾病的候选产品组合;紧接着,百时美施贵宝宣布以140亿美元现金收购Karuna Therapeutics,拓展了在神经科学疾病领域的布局。(关联阅读:140亿美金的小分子!Karuna制药背后有何来头?)
随着近段时间神经科学领域交易频现,多家跨国药企大举并购入局,曾被称为新药研发“黑洞”的CNS领域似乎又重新激起了行业内的热情。一些拥有后期资产的神经科学公司或有可能成为大型制药公司潜在的并购标的。
药融云数据www.pharnexcloud.com显示,Xenon Pharmaceuticals是加拿大一家专注于神经科学疾病领域的生物制药公司,主要以小分子、离子通道药物开发为专长,致力于提供创新疗法,以改善神经系统疾病患者的生活。目前该公司正在推进以神经病学为重点的新型产品管线,以解决高度未满足的医疗需求,重点是癫痫,并与学术和行业合作者开展新药研发项目,专注于神经系统药物开发30年的Neurocrine Biosciences是该公司的合作伙伴。
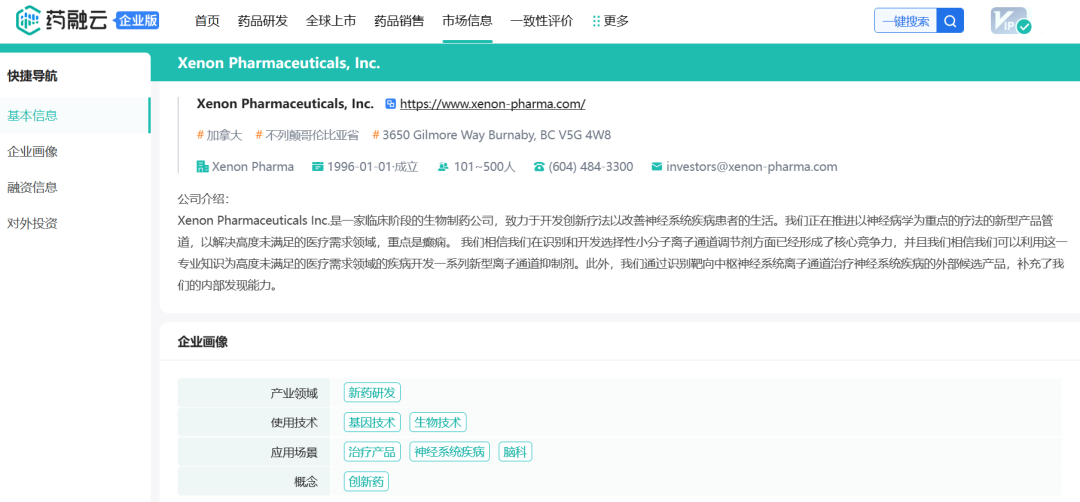
截图自药融云数据库
Xenon创立于1996年,2014年登陆纳斯达克(NASDAQ:XENE),截至2024年3月22日,该公司市值超过33.19亿美元,是加拿大少有的市值较高的创新药企。
Xenon的过去: “世界首个”基因疗法与疼痛研究
Xenon创立之时正值基因组技术取得长足发展的时期,最初公司名为Xenon Bioresearch,2004年更名为Xenon Pharmaceuticals。Xenon当时的定位是一家以临床遗传学为基础的生物制药公司,依托其Extreme Genetics发现平台,研究具有极端特征的罕见人类疾病(包括由离子通道突变引起的疾病),通过识别和表征导致这些特征的单基因缺陷,深入了解人类疾病生物学,以更好地选择治疗靶点。(from families to genes, from genes to drugs.)
荷兰生物技术公司uniQure的Glybera(alipogene tiparvovec)被认为是“西方世界首个基因治疗药物”,2012年获欧盟批准治疗脂蛋白脂肪酶缺乏症(LPLD),后因价格原因撤市。Glybera最初的活性成分来自于Xenon的平台。Xenon曾与不列颠哥伦比亚大学(UBC)的合作者一起证明了,人类脂蛋白脂肪酶(LPL)的单基因突变,称为LPLS447X突变,可引起LPL酶活性增加,从而降低甘油三酯水平。2000年8月,Xenon与UBC签订了一项许可协议,根据该协议,Xenon获得了根据UBC控制的若干知识产权利益的全球独家许可,以开发和商业化基因治疗技术和化合物,包括与LPL突变有关的产品,即LPLS447X。几乎同一时间,Xenon与荷兰AMT公司(Amsterdam Molecular Therapeutics,成立于1998年)签订了分许可和研究协议,将根据Xenon控制的若干知识产权授予AMT全球独家分许可,以开发和商业化与LPL突变相关的技术和化合物,即LPLS447X。
随后Xenon与UBC和AMT合作开展临床前研究,此后AMT便开发了携带LPLS447X基因的LPL基因治疗产品Glybera。不过该药的上市申请曾因受试者只有27例,以及疗效持续性等质疑三次被拒绝。最终AMT面临资金严重短缺的问题,经营困难,在2012年4月被刚成立的uniQure公司收购。同一年,Glybera终获欧盟批准,uniQure在次年与意大利凯西制药(Chiesi)建立合作,共同将Glybera商业化。不过该药定价高达100万美元,成为当时全球最昂贵药物,获批之后仅卖出一剂,而且是在该患者的主治医生想尽办法为其争取到了医疗保险,才得以支付。如此天价让Glybera再也没有被卖出,直到2017年uniQure与凯西制药宣布放弃Glybera,库存中余下的3份分别以1欧元“卖”给了三名欧洲患者。
疼痛研究曾是Xenon的另一个重点。2001年,Xenon得知加拿大纽芬兰的一个家庭有四个成员对疼痛无感,其中一个孩子甚至被钉子穿过了脚都感觉不到疼痛,该公司认为这与遗传学有关。根据新闻报道和口耳相传,Xenon追踪并研究了来自世界各地12个对疼痛不敏感的家庭,Xenon通过研究这些家族的基因组,借助其Extreme Genetics平台发现了对疼痛不敏感的人群的共同特征:单个基因SCN9A的突变,这一突变会导致钠离子通道Nav1.7的功能丧失,进而使人对疼痛不敏感,也就是先天性无痛症(CIP)。这也提示了Nav1.7可能作为镇痛药物开发的关键靶点。
基于此,Xenon开发了Nav1.7的小分子抑制剂,拟用于各种伤害性疼痛和神经性疼痛,如红斑性肢痛症(EM)、带状疱疹后神经痛(PHN)、膝骨关节炎疼痛、牙痛等。在全球疼痛治疗药物市场日渐庞大,阿片类药物带来成瘾性危机的背景下,业界对新型镇痛药物需求迫切,Xenon的研究成功吸引了制药大厂的目光,2011和2012年间,该公司就Nav1.7小分子抑制剂TV-45070(前称XEN402)和GDC-0276(后称RG-7893)、GDC-0310(RG6029)分别与Teva和罗氏旗下基因泰克达成了合作。
不过,针对Nav1.7靶点的药物开发十分困难,全球尚未有该靶点药物成功获批。2017年6月,Xenon与Teva宣布TV-45070局部疗法治疗带状疱疹后神经痛(PHN)的2期临床研究既未达到主要终点,也未达到次要终点。2018年3月,两家公司宣布终止TV-45070的开发合作。另根据药融云数据库www.pharnexcloud.com提供信息,Xenon与基因泰克合作的两款Nav1.7抑制剂也已停止开发。
截图自药融云数据库
此外,Xenon还在2009年与默沙东(通过其瑞士子公司Essex Chemie AG)合作,开发治疗心血管疾病的新型小分子候选药物,该合作已在2012年结束。
新药研发九死一生,曾经的轰轰烈烈到最后也可能落得一地鸡毛。
研发管线进展
经历了管线和战略的逐步调整,Xenon现在的目标是建立一家完全整合且盈利的生物制药公司,通过发现、开发和商业化创新疗法,专注于改善癫痫和其他神经系统疾病患者的健康。
● 利用自身的发现能力,基于该公司对离子通道疾病遗传学的理解,结合专有的生物学和药物化学资产和专业知识,确定开发新的候选产品、药物靶点和/或现有候选产品的新适应症;
● 通过临床开发推进选定的专有候选产品;
● 有选择地建立合作关系,使公司潜在地扩展内部能力和/或获得更广泛的商业机会;
● 通过适应症扩展、收购或引进外部候选产品,识别进一步扩大产品线的机会;
● 选择单独或与其他公司合作将候选产品商业化。
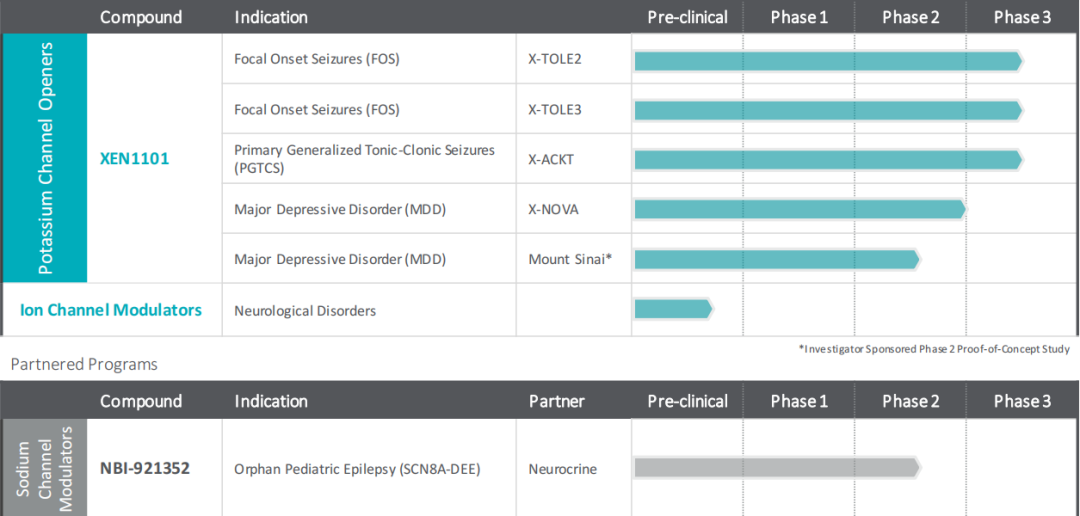
Pipeline更新至2023年12月
与2014年IPO时相比,现在Xenon的临床管线已是大换血,其领先候选产品XEN1101是一款新型小分子Kv7.2/Kv7.3钾通道开放剂,主要开发适应症是癫痫和抑郁症。药融云数据www.pharnexcloud.com显示,该药原研单位是博士伦公司。2017年4月,Xenon与1st Order Pharmaceuticals签订资产购买协议,获得了XEN1101(前称为1OP2198)相关的所有权利。而在此之前,1st Order从加拿大制药公司Bausch Health Companies的间接子公司Valeant Pharmaceuticals Luxembourg S.a.r.l.以及Valeant Pharmaceuticals Ireland Limited、Bausch Health收购了1OP2198,并承担了某些义务,包括潜在的里程碑和特许权使用费。2018年,Xenon从Bausch Health买断了与XEN1101相关的所有未来应支付给Bausch Health的里程碑付款和特许权使用费。
对于癫痫适应症,尽管目前市场上有多种抗癫痫药物(ASM),但由于多达50%的患者难以控制癫痫发作或患有严重的难治性癫痫,因此存在大量未满足医疗需求。局灶性癫痫发作(FOS)占美国癫痫人群中最大的部分,全面性癫痫是第二大常见的癫痫形式,约80%的成年全面性癫痫患者会经历原发性全面强直阵挛癫痫(PGTCS)。
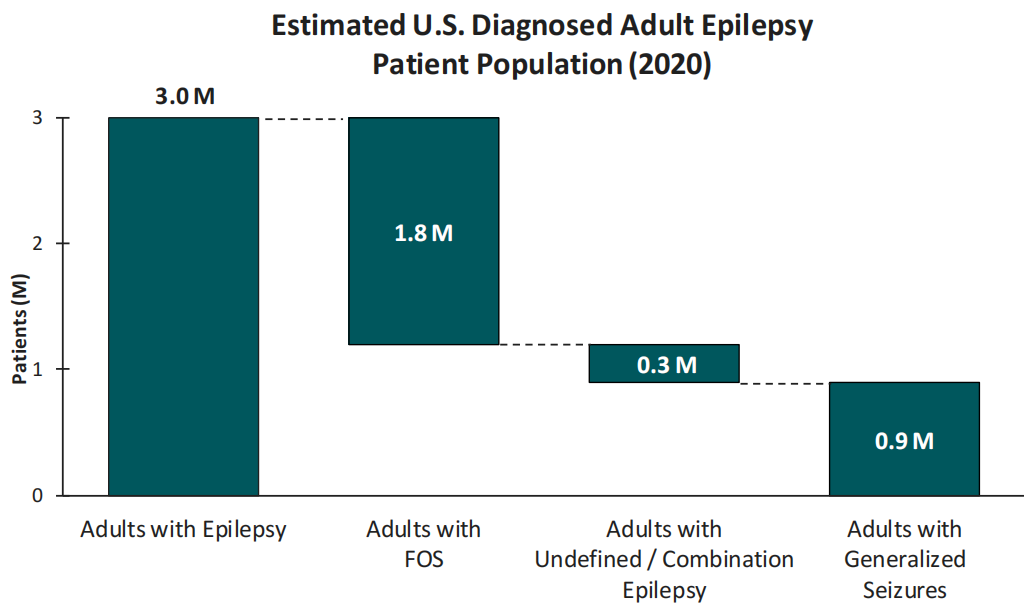
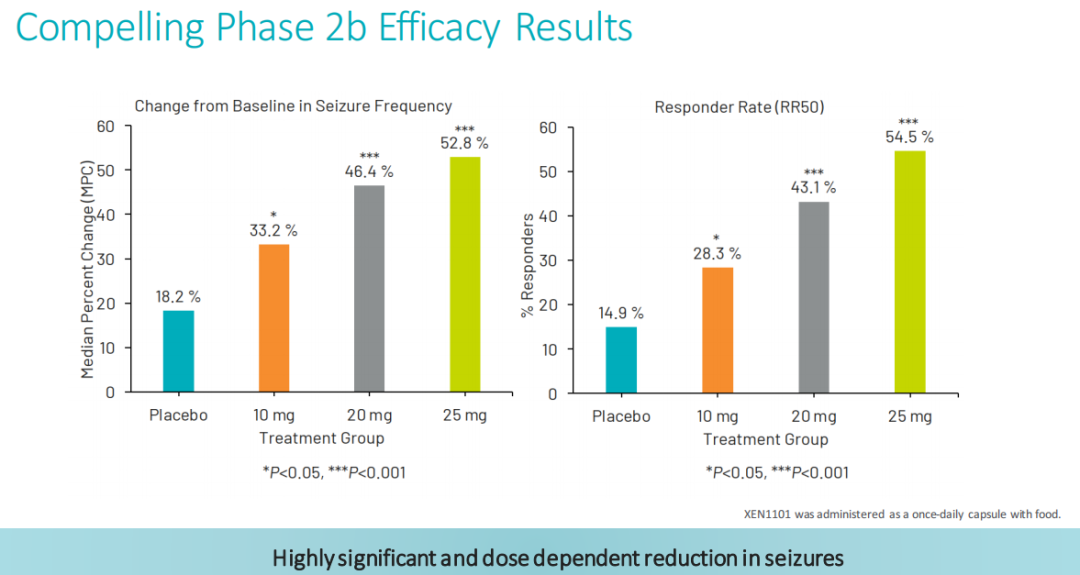
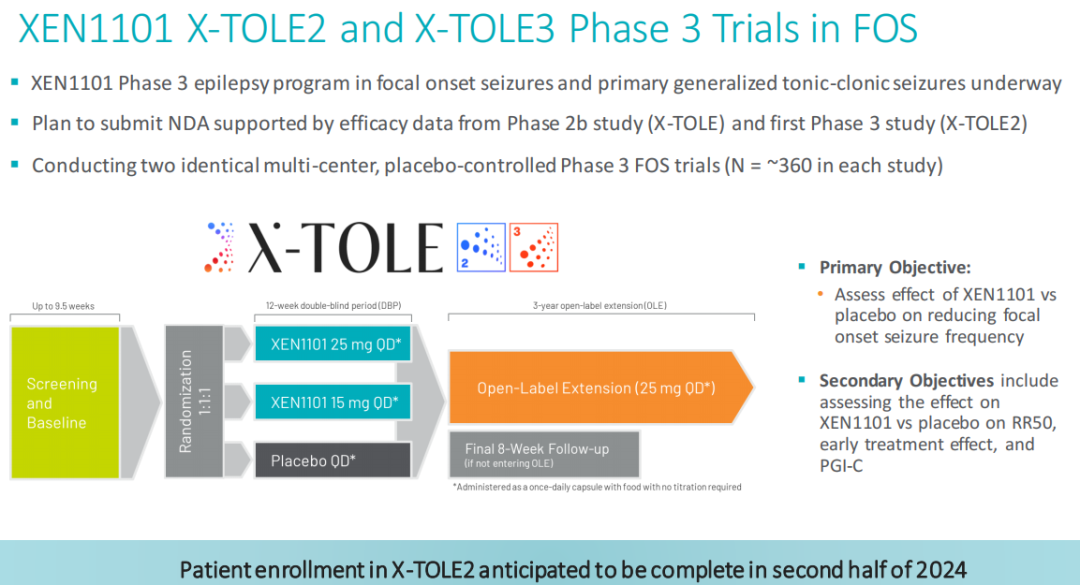
XEN1101治疗局灶性癫痫发作(FOS):Xenon公司正在开展XEN1101治疗局灶性癫痫发作的3期临床研究,其中包括两项相同的3期临床试验,分别是X-TOLE2和X-TOLE3,这些试验是在2b期X-TOLE临床试验之后设计的(X-TOLE试验显示,在难治性FOS群体中,XEN1101对于癫痫发作的减少具有统计学意义)。这两项多中心、随机、双盲、安慰剂对照试验正在评估15 mg或25 mg剂量的XEN1101与食物一起作为辅助治疗的临床疗效、安全性和耐受性,每项研究大约有360名局灶性癫痫发作(FOS)患者。主要疗效终点是XEN1101与安慰剂相比,从基线到双盲期间(DBP)的月度癫痫发作频率的中位百分比变化(MPC)。公司预计X-TOLE2研究的患者入组将于2024年下半年完成。
XEN1101治疗原发性全面强直阵挛癫痫(PGTCS):该公司正在开展一项名为X-ACKT的3期临床试验,以支持XEN1101治疗另一项癫痫适应症,即PGTCS的潜在监管递交。这项多中心、随机、双盲、安慰剂对照研究正在评估25 mg剂量XEN1101作为辅助治疗在大约160名PGTCS患者中的临床疗效、安全性和耐受性。主要疗效终点是XEN1101与安慰剂相比,从基线到双盲期间(DBP)的月度PGTCS发作频率的中位百分比变化(MPC)。

XEN1101治疗癫痫的开放标签扩展研究:在X-TOLE2、X-TOLE3或X-ACKT试验中度过双盲期后,符合条件的患者可以进入长达三年的开放标签扩展(OLE)研究。此外,正在进行的X-TOLE第2b期OLE研究将继续为XEN1101提供重要的长期数据。
XEN1101治疗重度抑郁症(MDD):2023年11月27日,Xenon报告了XEN1101在MDD患者中的2期概念验证X-NOVA临床试验的顶线结果。该试验是一项随机、双盲、安慰剂对照的多中心临床研究,评估了在168名中度至重度抑郁症(MDD)患者中使用10mg和20mg剂量XEN1101的临床疗效、安全性和耐受性。该试验的主要终点是给药第6周时根据Montgomery-Åsberg抑郁量表(MADRS)评分变化,将XEN1101与安慰剂进行比较。根据顶线结果,XEN1101 10mg组平均减少数值为15.61,20mg组为16.94,而安慰剂组为13.90,未达到统计学上的差异,但XEN1101 20mg组与安慰剂组之间存在明确的剂量反应和临床意义,并且该研究达到了次要疗效终点。另外XEN1101在安全性方面也非常出色,且结果显示XEN1101与显著的体重增加无关(体重增加是许多抗抑郁药物的常见副作用)。
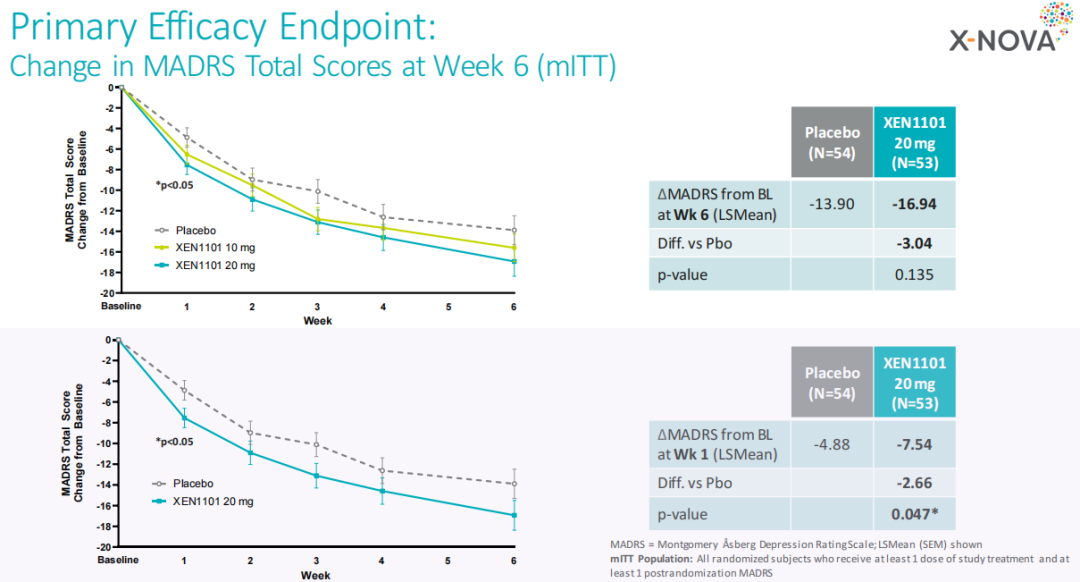
因此,该试验虽未达到主要终点,但Xenon当日股价却上涨了17.8%。次月,Xenon宣布完成了3.45亿美元的大规模公开募股。
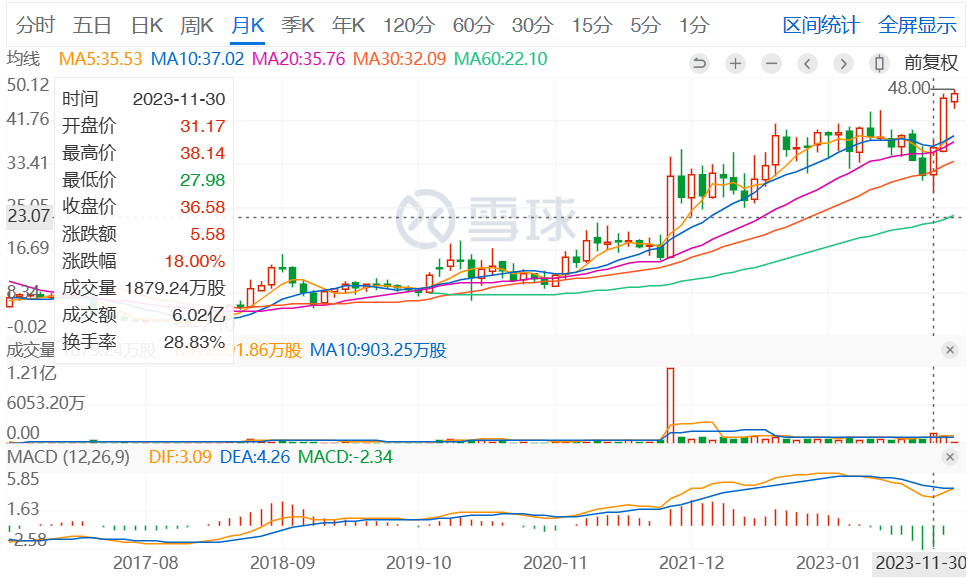
截图自雪球
Xenon正在积极评估各种临床和监管途径,以支持XEN1101治疗MDD的后期临床开发,预计将于2024年启动3期临床研究。Xenon还在评估XEN1101未来开发的其他潜在适应症。
此外,Xenon正与美国西奈山伊坎医学院合作,支持一项由研究者发起的2期概念验证、随机、平行、安慰剂对照的多中心研究,该研究涉及XEN1101治疗约60名MDD患者。研究的主要目的是评估XEN1101对大脑奖励回路的影响,通过功能性磁共振成像(fMRI)评估的双侧腹侧纹状体活动的变化来衡量。次要目标是分别使用MADRS和Snaith-Hamilton快感量表(SHAPS)测试XEN1101与安慰剂相比,对抑郁症和快感缺乏临床测量的影响。
与Neurocrine合作的NBI-921352:NBI-921352是一种选择性Nav1.6钠离子通道抑制剂,正在由Xenon与Neurocrine Biosciences合作开发治疗癫痫,Neurocrine拥有NBI-921352(前称为XEN901)的独家许可。2023年11月,Neurocrine宣布评估NBI-921352在成年局灶性癫痫发作(FOS)患者中疗效的2期临床试验未能证明癫痫发作频率显着降低,Neurocrine不再计划NBI-921352在FOS患者中的进一步开发。不过根据当时的新闻稿透露,另外一项2期临床试验正在进行中,旨在评估NBI-921352在2至21岁的SCN8A基因突变相关发育性癫痫性脑病(SCN8A-DEE)患者中的疗效;作为双方合作的一部分,Neurocrine还在继续推进临床前双选择性Nav1.2/1.6抑制剂。
临床前项目:Xenon继续利用其广泛的离子通道专业知识和药物发现能力来识别经过验证的药物靶点并开发新的候选产品。近期的重点是针对Kv7、Nav1.1和Nav1.7的开发候选药物,Xenon预计多个候选药物将在2024年和2025年进入IND-enabling研究。
财务状况
Xenon Pharmaceuticals目前主要通过出售权益性证券、从被许可方和合作者处获得资金以及债务融资来为公司运营提供资金。截至2023年9月30日,Xenon累计赤字为6.204亿美元。迄今为止,Xenon的收入主要来自合作和许可协议。以下是2022、2021以及2020年度Xenon公司的收入概况:
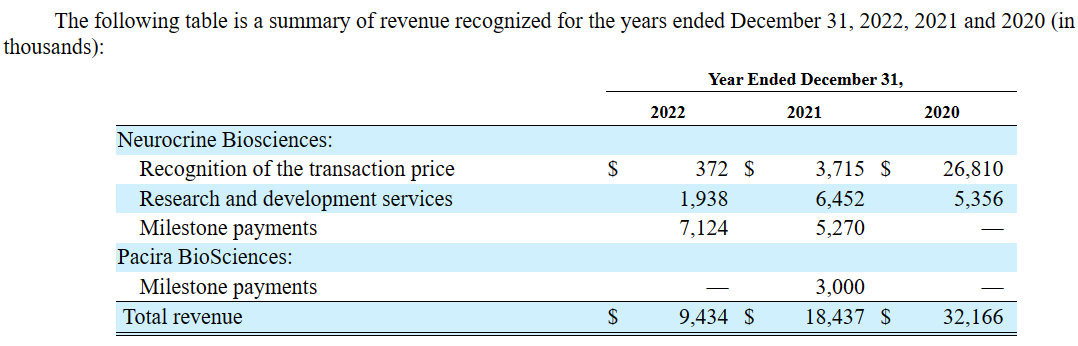
根据Neurocrine的协作条款,2021年9月,基于NBI-921352在欧洲的临床试验申请的监管批准,Xenon收到了总额为1000万美元的里程碑付款(包括450万美元的现金和550万美元的普通股股权投资)。2022年1月,基于美国FDA批准扩大NBI-921352用于SCN8A-DEE人群的研究,包括2至11岁的受试者,Xenon收到了总额为1500万美元的里程碑付款(包括675万美元的现金和825万美元的普通股股权投资)。
2021年,Xenon确认了与非阿片类药物疼痛管理公司Pacira BioSciences之间针对PCRX301的全球开发和商业化权利协议相关的300万美元收入,其中包括FDA批准IND申请的100万美元里程碑付款和1b期临床试验启动的200万美元里程碑付款。此后Xenon未从该合作中获得收入。2022年11月,Pacira BioSciences做出终止PCRX-301临床开发的战略决策。
Pacira BioSciences通过在2021年11月收购Flexion Therapeutics,获得PCRX301(前身为FX301)的全球权利,再之前称为XEN402(也称funapide),该药是一种Nav1.7抑制剂,配制为热敏水凝胶缓释制剂。
以下为Xenon在2020至2022年的运营开支情况:该公司2022年R&D费用为1.058亿美元,G&A费用为3281万美元,增长主要是因为临床试验的推进以及人员相关成本。2022年度净亏损为1.254亿美元。
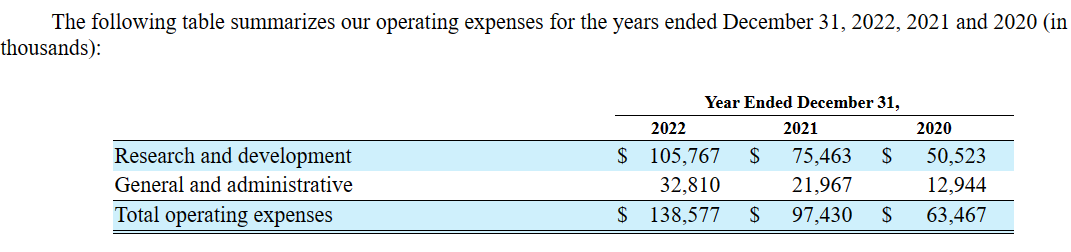
以下为2023年前三季度收入情况:本年度尚未获得许可和合作相关收入。
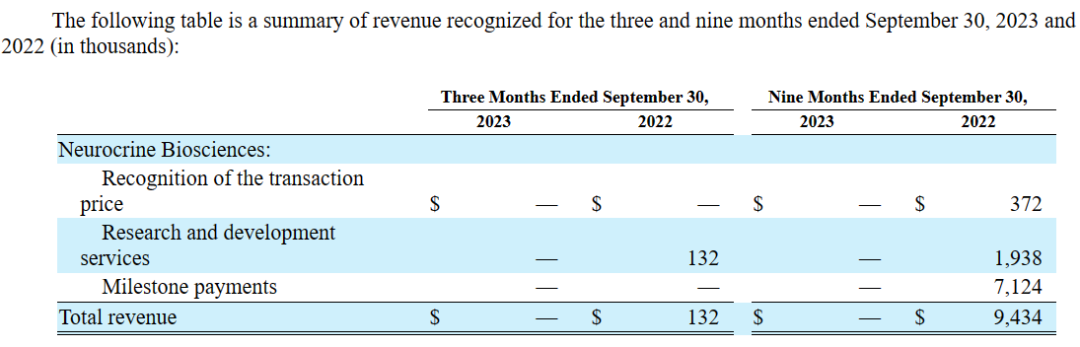
以下为2023年前三季度运营开支情况:
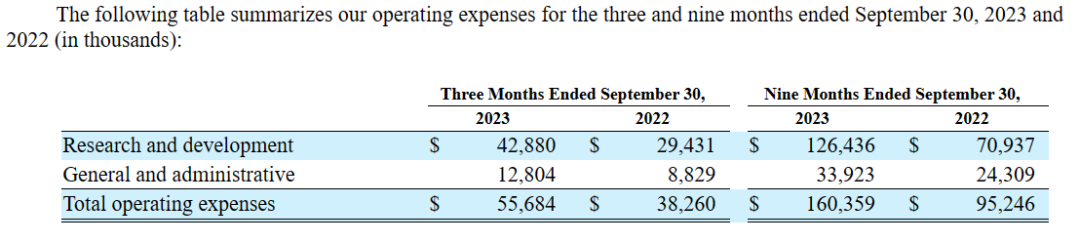
截至2023年9月30日,Xenon公司持有现金和现金等价物及有价证券共6.391亿美元,预计将足够覆盖公司2026年之前的运营支出。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China