在蛋白降解/PROTAC领域,药融云数据(www.pharnexcloud.com)不完全统计,国内的领泰生物、开拓药业、海思科、百济神州、恒瑞医药、海创药业、Cullgen、珃诺生物、海和药物、格博生物、和径医药、标新生物、诺诚健华、成都先导、康朴生物、泰比棣医药、本欣生物、美志医药、亚盛医药、达歌生物(Degron Therapeutics)、和正医药、辉启生物、加科思、科伦药业、凌科药业、南京奥瑞药业、海博为药业、石药集团、嘉兴优博、星亢原生物、苏州德亘生物、爱新医药、凌泰氪生物、分迪科技、多域生物、阿泰克、因明生物、同源康、万春Seed,盛世泰科/美迪西、南京澳健生物、恩瑞生物、汇宇制药、医诺康生物等等入局。
在人类与疾病的较量中,治疗用药物作为其中的重要一环,经历了小分子药物、大分子生物制品、细胞与基因治疗等新兴疗法的开发浪潮。现如今抗体、ADC等大分子药物大行其道,与之相比传统的小分子药物似乎“黯然失色”。不过创新技术的问世,并不只是给传统疗法带来冲击,更为药物开发提供一种新的路径。靶向蛋白降解(TPD)在近几年成为新药研发的热门方向,也是小分子药物最为前沿的突破,有望使小分子药物迎来新的黄金时代。
传统的小分子药物旨在直接抑制或调控靶蛋白的活性以治疗疾病,而靶向蛋白降解剂通过将致病蛋白运送到蛋白酶体(Proteasome)从而将其完全降解,这或将重新定义小分子药物的特征和作用机制。
与抗体和细胞疗法类似,靶向蛋白降解(TPD)也是一种借助人体内天然作用机制的治疗模式,其依赖细胞自身的泛素-蛋白酶体系统(UPP)来降解靶蛋白。泛素(Ubiquitin)是一种进化上高度保守的多肽,由76个氨基酸残基组成,分子量约为8.6kDa,因其广泛存在于真核生物的大多数组织中,所以被称为泛素。它能与蛋白质共价结合,蛋白质一旦被泛素标记(该过程称为泛素化),就会被送到细胞内的“垃圾处理厂”——蛋白酶体进行降解。2004年,以色列科学家Aaron Ciechanover、Avram Hershko和美国科学家Irwin Rose因发现泛素调节的蛋白质降解,共同获得当年诺贝尔化学奖。
泛素化过程是涉及泛素激活酶E1、泛素结合酶E2和泛素连接酶E3的一系列反应。首先E1酶利用ATP使泛素分子C末端腺苷化以激活泛素,随后E1酶将激活的泛素分子转移到E2酶上,形成E2-泛素巯基酯,然后E3酶与靶蛋白(POI)和E2酶相结合,泛素分子依次从E2酶传递到E3酶,再到靶蛋白,最后被泛素标记的靶蛋白由蛋白酶体识别并降解。
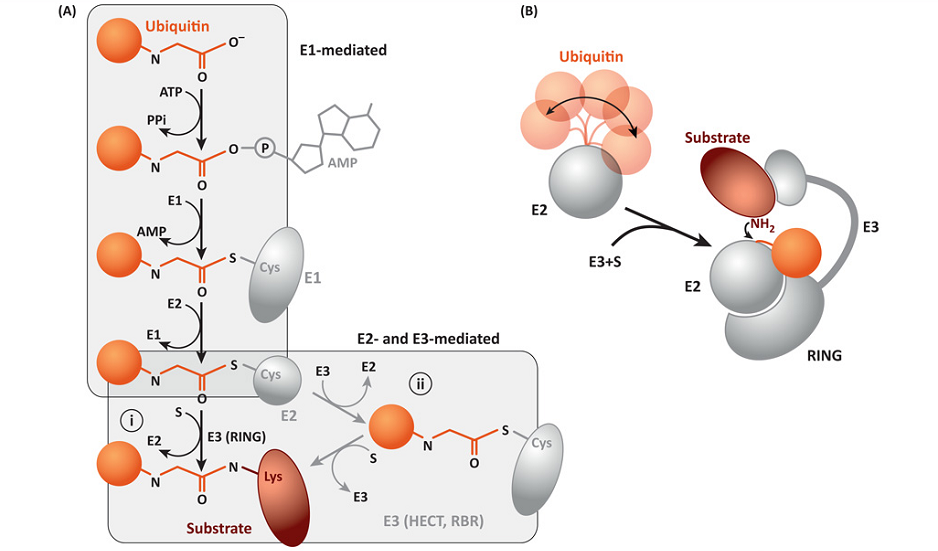
▲泛素化过程 图源:TrendsCell Biol
目前靶向蛋白质降解剂分为两类,一类是分子胶,这类单功能小分子化合物通过修饰泛素化连接酶表面,增强连接酶和潜在蛋白底物之间的蛋白-蛋白相互作用(PPI),促进靶蛋白(POI)的泛素化,从而借助泛素-蛋白酶体系统将其降解。分子胶分子量相对较小,成药性好,但设计难度大;
另一类是PROTAC(Proteolysis Targeting Chimeras,蛋白降解靶向嵌合体),为双功能小分子化合物,一端是能与靶蛋白结合的配体,另一端是能与E3连接酶结合的配体,中间通过linker相连。PROTAC分子结合靶蛋白(POI)和E3连接酶,形成三元复合物,给靶蛋白打上泛素标签,从而借助UPP系统将POI降解,正是这种催化型作用机制(MOA)和事件驱动的药理学将PROTAC与经典小分子抑制剂区分开来,其作用范围更广、活性更高、可靶向“不可成药”靶点,但缺点也很明显,三组份嵌合体结构导致分子量较大,通常超过1000道尔顿,这打破了经典“类药五原则”对传统小分子药物分子量500道尔顿以内的范围界定,导致绝大多数PROTAC分子存在溶解度差、渗透性差、口服生物利用度低等缺点。不过由于PROTAC分子相较于分子胶更能够被设计,以及具有靶向“不可成药”靶点的优势,许多企业在这一领域争相布局。
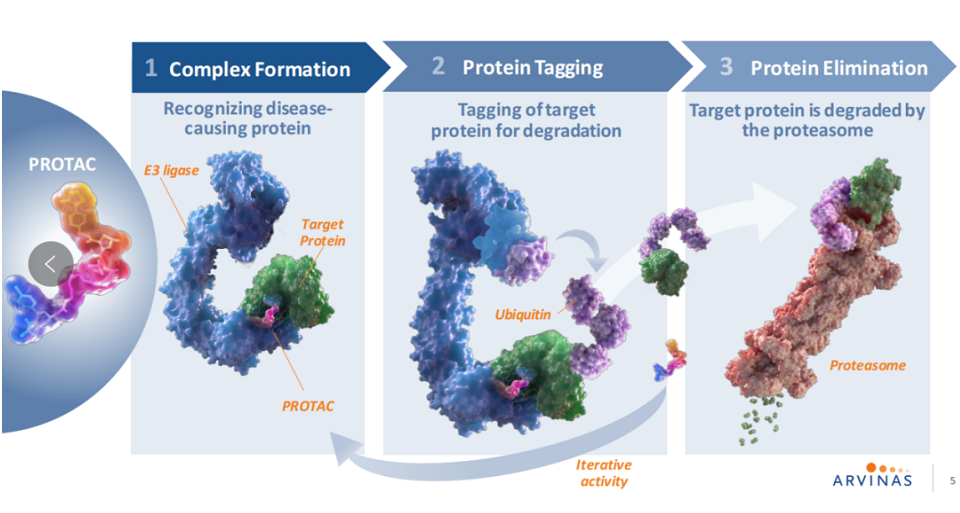
▲PROTAC分子的作用机制
创立于2013年的美国生物技术公司Arvinas无疑是靶向蛋白降解赛道的领头羊,该公司管线中的在研产品最快已处于2期临床阶段。Arvinas位于康涅狄格州纽黑文市(耶鲁大学所在地),Arvinas的创始人、耶鲁大学的Craig Crews教授是靶向蛋白质降解技术的发明者之一,并于2001年发表了第一篇描述PROTAC降解剂的论文,可以说是PROTAC领域的鼻祖。

▲Craig Crews教授 图源:Yale University
Arvinas专有的PROTAC®发现引擎是靶向蛋白降解领域领先的技术平台,利用人体自身的天然蛋白质处理系统选择性、有效地降解和去除致病蛋白质。凭借该发现引擎,公司旨在开发靶向蛋白降解药物,并推向临床,最终使患者获益,他们的药物发现过程主要分为三个步骤:

E3知识库-选择合适的E3连接酶与正确的靶点相匹配 借助AI以及对连接酶结构的理解来识别和设计配体 借助专有的DNA编码文库(DEL)进行高级筛选以优化药物特性 针对过去的“不可成药”靶点,识别新的靶点结合“弹头”
“泛素化区域”-使用结构和生化信息来精确预测靶蛋白上可用泛素“标记”的位点 ANGLE:Arvinas Next Generation LinkerEvolution(Arvinas下一代linker进化)融合了公司PROTAC降解剂linker设计的经验 创建预测性计算模型 利用领先的蛋白质组学能力优化PROTAC降解剂对靶点的选择性
创立“Arvinas Rules”,打破了长期指导小分子药物发现的“类药5原则”,开发口服生物可利用,可穿透血脑屏障的PROTAC降解剂 深入理解体内PK/PD和疗效关系,制造出具有类药物特性和活性的PROTAC降解剂
与其他治疗方式,如小分子、基因疗法相比,PROTAC介导的蛋白质降解具有多种优势:
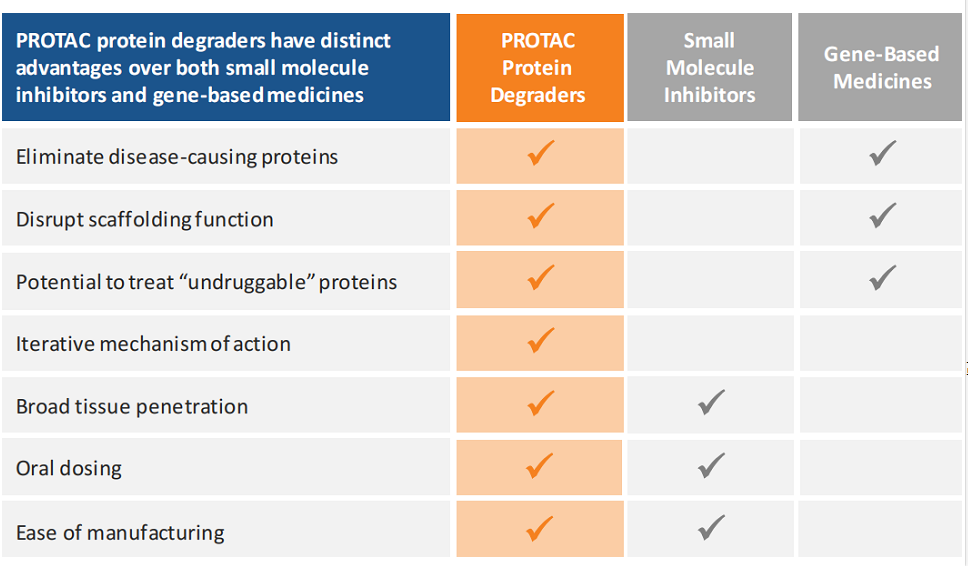
靶向“不可成药”——传统的小分子抑制剂需要与靶蛋白“强”结合,通常是与其活性位点结合。由于PROTAC蛋白质降解剂只需要与靶蛋白“弱”结合即可进行特异性“标记”,因此PROTAC降解剂有潜力靶向过去约80%“不可成药”的蛋白质组。 多种给药途径——PROTAC降解剂可根据疾病和需要,通过口服、注射或输注方式给药。 穿越血脑屏障——在临床前研究中,Arvinas的PROTAC降解剂已成功穿透血脑屏障,这是开发神经退行性疾病药物的关键。 组织特异性靶向的潜力——与传统小分子不同,PROTAC降解剂的活性可以通过募集仅在特定细胞谱系中表达的E3连接酶,以实现靶向特定组织。 小分子的优势——与其他一些新型疗法相比,PROTAC降解剂可在体内广泛分布,且相对易于制造。
Arvinas的PROTAC产品管线主要围绕肿瘤学/免疫肿瘤学治疗领域,并将神经科学作为第二个专注方向。三个进入临床的主要候选产品是Bavdegalutamide(ARV-110)、ARV-471和ARV-766,且针对的是已验证靶点雄激素受体蛋白(AR)、雌激素受体蛋白(ER)。其他肿瘤学在研项目靶点还包括BCL6、KRAS、Myc、HPK1等。神经科学领域靶点包括针对阿尔茨海默病的致病性Tau蛋白、帕金森病的α-突触核蛋白,以及亨廷顿氏病的mHTT蛋白等。

Bavdegalutamide(ARV-110)是一款靶向雄激素受体蛋白(AR)的潜在first-in-class口服PROTAC蛋白降解剂,用于治疗转移性去势抵抗性前列腺癌(mCRPC)患者。当前恩杂鲁胺(enzalutamide)、阿比特龙(abiraterone)是前列腺癌的标准治疗方案,但它们的疗效会因耐药机制的产生而降低,高达25%的患者对这些治疗没有反应,绝大多数有反应的患者最终还是会产生耐药性,导致预后不良。Bavdegalutamide是全球首个PROTAC降解剂,也是首个进入临床阶段的口服PROTAC降解剂,已在先前接受过1-2种新型激素药物治疗的mCRPC患者中显示出了强大的临床活性信号。
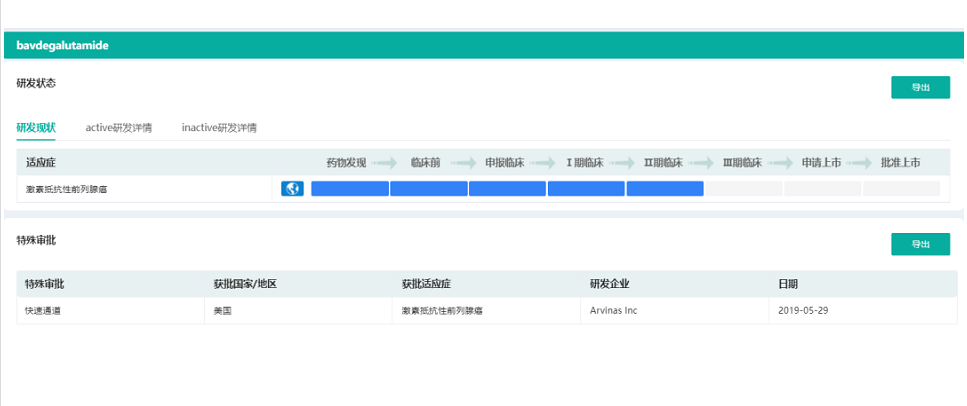
截图自药融云数据库
药融圈旗下, 药融云数据 www.pharnexcloud.com显示,Bavdegalutamide于2019年5月获得了用于mCRPC的快速通道资格,并于2020年第四季度启动了2期单药拓展试验(ARDENT)。Arvinas于2022年2月披露的数据中显示,在携带ART878X/H875Y(T878X为T878A或T878S)突变的患者中,46%的患者前列腺特异性抗原(PSA)水平降低≥50%(PSA50);1期和2期拓展试验(ARDENT)的ART878X/H875Y突变患者中显示出了强大的治疗持续时间;7例RECIST可评估的ART878X/H875Y突变患者中有2例获得确认的持久的部分缓解。Arvinas认为数据支持Bavdegalutamide在分子生物学定义的mCRPC患者中寻求潜在的加速批准途径,并计划于2022年第二季度与FDA进行沟通,以及确定一项伴随诊断合作伙伴关系。公司计划在2022年下半年启动一项针对ART878X/H875Y突变患者的关键临床试验。此外,Arvinas还在2021年第四季度启动了该药联合阿比特龙治疗mCRPC患者的1b期临床试验。
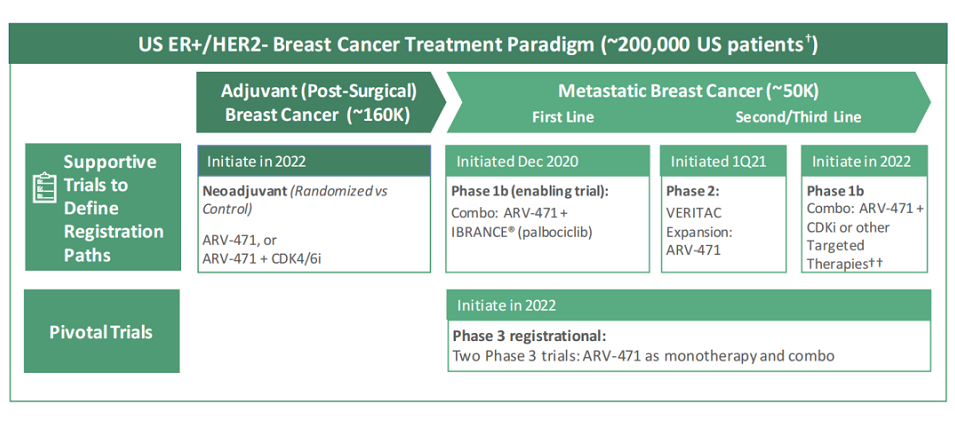
ARV-471是一款在研的靶向雌激素受体蛋白(ER)的潜在first-in-class口服PROTAC蛋白降解剂,用于治疗ER+/HER2-的局部晚期或转移性乳腺癌患者。2021年7月,Arvinas与辉瑞达成合作协议,授予辉瑞ARV-471在全球范围内独家开发和商业化权利,根据协议条款,Arvinas将获得6.5亿美元的预付款以及3.5亿美元的股权投资,同时还将在全球范围内50/50分享未来的利润,并有资格获得高达4亿美元的监管里程碑和高达10亿美元的商业化里程碑。公司于2021年12月在第44届美国圣安东尼奥乳腺癌研讨会(SABCS)中公布了ARV-471的1期临床数据,该药在500mg剂量组中降解了患者体内最多高达89%的ER水平;在CDK4/6抑制剂预处理的患者中临床受益率(CBR)为40%;在晚期患者中也显示出良好的抗肿瘤活性;耐受性良好,未达到最大耐受剂量(MTD)。
与辉瑞建立合作后,ARV-471的开发速度加快,公司计划在2022年下半年公布2期VERITAC试验剂量拓展数据(200mg和500mg),以及1b期与哌柏西利(palbociclib)联用的安全性数据。此外,公司还计划于2022年启动ARV-471与依维莫司(everolimus)联合治疗转移性乳腺癌患者的1b期试验、与CDK抑制剂或其他靶向疗法联用的1b期试验、作为早期乳腺癌患者新辅助治疗的2期临床试验,以及2项单药和联合治疗转移性乳腺癌患者的关键3期临床试验。
Arvinas的第三款进入临床的在研药物ARV-766是一款靶向雄激素受体蛋白(AR)的口服PROTAC蛋白降解剂,用于治疗患有mCRPC的男性。在临床前研究中,ARV-766降解了所有测试的AR耐药驱动点突变,包括L702H,这是一种与阿比特龙和其他AR通路疗法治疗相关的突变,而Bavdegalutamide在临床前研究中并没有实现该位点的降解。2021年,公司启动了ARV-766的1期临床试验,旨在评估ARV-766的安全性、耐受性和药代动力学,其中还包括作为次要终点的抗肿瘤活性测量,包括前列腺特异性抗原(PSA)的降低。公司计划在2022年下半年提供1期剂量递增数据,并启动治疗男性mCRPC的2期扩展试验。
AR-V7是雄激素受体(AR)的剪接变体,针对AR-V7,公司开发了下一代AR PROTAC降解剂,可同时靶向AR-V7和全长AR。
针对过去的“不可成药”靶点,Arvinas已将KRAS作为PROTAC技术的概念证明,公司成功开发了具有体内活性的KRAS G12C特异性PROTAC降解剂,异种移植模型中,该“PROTAC®Y”降解剂在单次给药6小时后降解了体内80%以上的KRAS G12C。同时,Arvinas开发的靶向BCL6的PROTAC降解剂已在弥漫性大B细胞淋巴瘤(DLBCL)的临床前模型中显示出强大的疗效。此外,公司还在开发针对Myc、HPK1等靶点的PROTAC降解剂以潜在地治疗恶性实体瘤。
在神经科学领域,Arvinas已经开发出了针对Tau蛋白和针对α-突触核蛋白的PROTAC降解剂,在临床前研究中,成功实现了血脑屏障的渗透,同时公司也开展了针对mHTT等靶点的研究。
Arvinas预计到2023年将新增4个项目进入IND阶段。
为了充分发挥APROTAC技术的潜力,Arvinas与多家企业建立了合作伙伴关系,包括基因泰克、辉瑞、拜耳。OerthBio LLC是Arvinas和拜耳共同成立的合资实体,旨在研究、开发和商品化农业领域的PROTAC靶向蛋白降解剂。

2021年8月,领先的AI制药企业英矽智能(InsilicoMedicine)宣布将与Arvinas携手开发新型PROTAC疗法。该合作基于英矽智能的人工智能平台,以及双方科研团队在新型PROTAC疗法方面的密切合作。此次合作将针对现有靶点和下一代靶点,通过人工智能预测三元复合物的结构包括蛋白与蛋白间的相互作用来设计PROTAC分子,以展示人工智能与药物发现最重要的前沿技术之一PROTAC相结合带来的突破。

图源:英矽智能
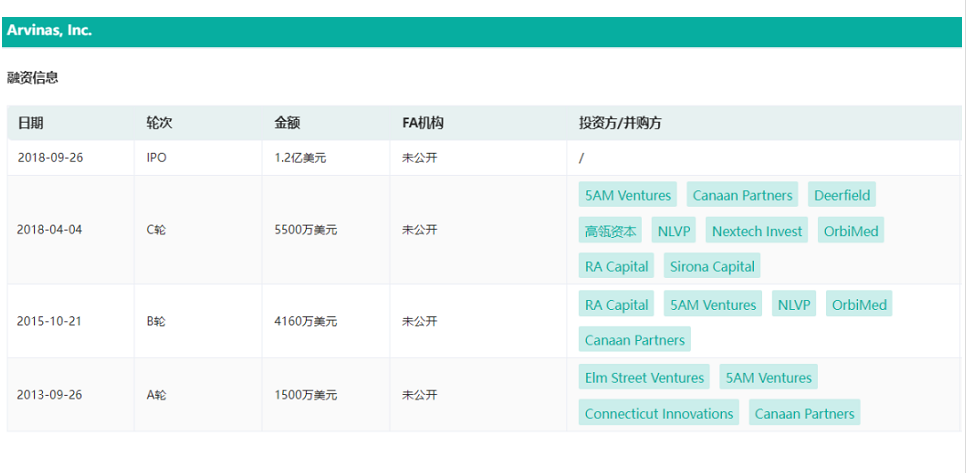
药融云数据 www.pharnexcloud.com显示,Arvinas在一级市场完成了3轮融资,主要投资方包括Canaan Partners、5AM Ventures等,国内的高瓴资本参与了C轮融资。2018年9月,Arvinas在纳斯达克完成1.2亿美元的IPO(NASDAQ:ARVN),发行价每股16美元。
截图自药融云数据库
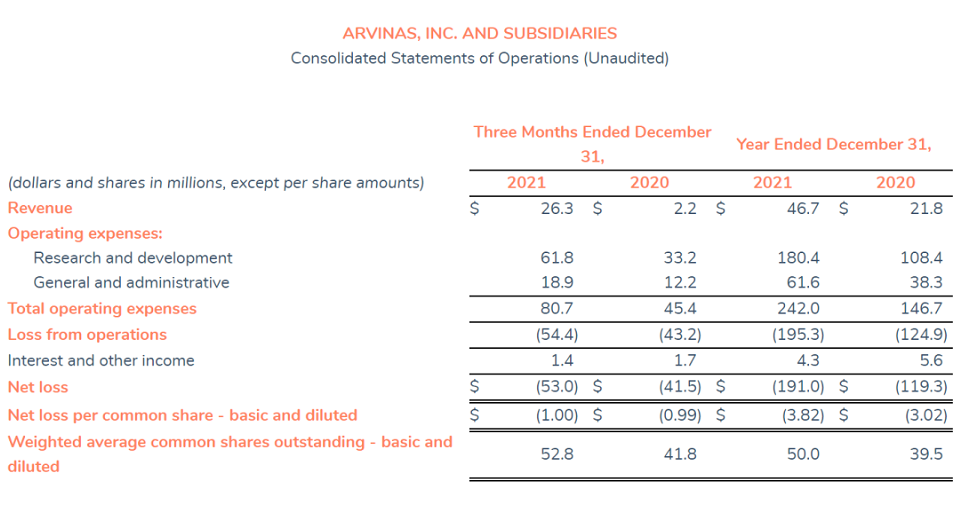
2021全年Arvinas公司总收入4670万美元,主要来源于研究合作和许可收入;全年研发支出为1.804亿美元,主要是由于平台和探索性项目开发,临床试验推进引起相关费用增加;一般及行政开支为6160万美元;公司全年净亏损为1.91亿美元。
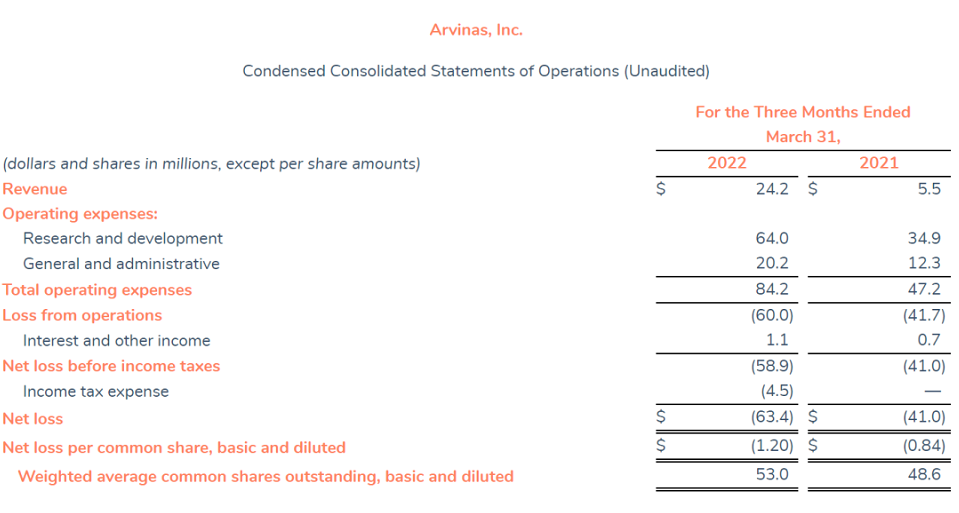
2022年第一季度公司总收入2420万美元,研发支出为6400万美元,一般及行政开支为2020万美元,公司第一季度净亏损为6340万美元。
截至2022年3月31日,Arvinas公司拥有现金、现金等价物、限定用途现金和有价证券共14.329亿美元,公司累计赤字为7.463亿美元。
PROTAC从当初的概念提出到现在已经进入第3个十年。2015年,基于E3连接酶VHL和CRBN的小分子PROATC相继被报道,其活性被证明达到了纳摩尔级别,激起了该领域的热潮。PROTAC的发明人之一,生物化学家Deshaies曾宣称,PROTAC或将成为一种重要的新药类别,可能超过有史以来最热门的两个药物开发领域——蛋白激酶抑制剂和单克隆抗体。Arvinas作为PROATC领域的领先企业,虽然面临巨大挑战,但其领先的候选产品也已取得不错的早期临床结果。目前大多数企业研究的主要还是先前已验证的靶点,这表明PROTAC作为一项新兴技术还处于研究早期,但随着技术可行性得到进一步验证,未来将有更多针对难成药靶点的研究出现。
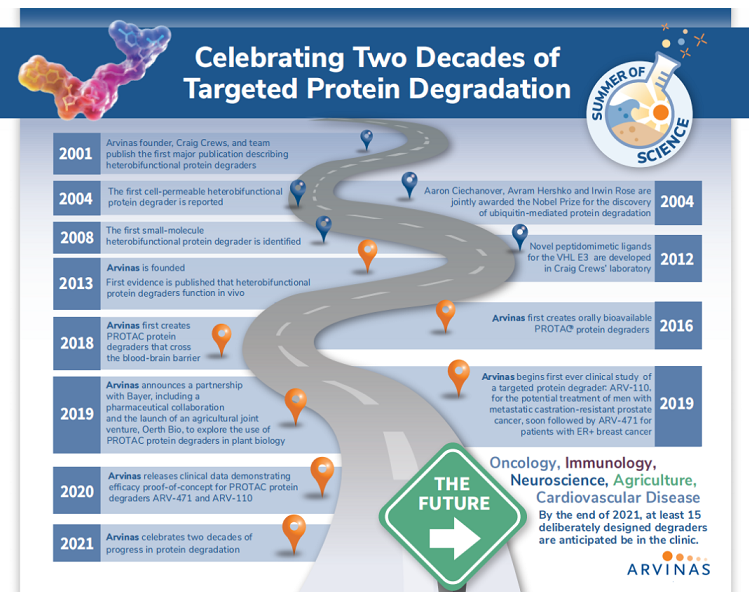
▲PROTAC发展历程
在蛋白降解/PROTAC领域,药融云数据,www.pharnexcloud.com显示,国内的领泰生物、开拓药业、海思科、百济神州、恒瑞医药、海创药业、Cullgen、珃诺生物、海和药物、格博生物、和径医药、标新生物、诺诚健华、成都先导、康朴生物、泰比棣医药、本欣生物、美志医药、亚盛医药、达歌生物(Degron Therapeutics)、和正医药、辉启生物、加科思、科伦药业、凌科药业、南京奥瑞药业、海博为药业、石药集团、嘉兴优博、星亢原生物、苏州德亘生物、爱新医药、凌泰氪生物、分迪科技、多域生物、阿泰克、因明生物、同源康、万春Seed,盛世泰科/美迪西、南京澳健生物、恩瑞生物、汇宇制药、医诺康生物等等入局。
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场
参考:
NMPA/CDE;
FDA/EMA/PMDA;
相关公司公开披露(正文图片除标注外,均来自企业官方);
https://www.arvinas.com/;
Kleiger G,Mayor T. Perilous journey: a tour of the ubiquitin-proteasome system.Trends Cell Biol. 2014 Jun;24(6):352-9. doi:10.1016/j.tcb.2013.12.003. Epub 2014 Jan 20. PMID: 24457024; PMCID:PMC4037451.;
Békés,M., Langley, D.R. & Crews, C.M. PROTAC targeted proteindegraders: the past is prologue. Nat Rev Drug Discov 21, 181–200(2022). https://doi.org/10.1038/s41573-021-00371-6.;
Megan S.Protein-slaying drugs could be the next blockbuster therapies. Nature567, 298-300 (2019). doi:https://doi.org/10.1038/d41586-019-00879-3.;等等。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China