Nuvalent, Inc.(美国纳斯达克股票代码:NUVL)于2017年1月25日在美国特拉华州注册成立,是一家临床试验阶段的生物制药公司,专注于为癌症患者创建精准的新型靶向治疗。

Nuvalent利用公司团队在化学和基于结构的药物设计方面的深厚专业知识来开发创新的小分子,其设计目的是克服现有疗法对“临床验证”激酶靶点的限制,或其他人已开发出用于临床环境的已建立、已批准疗法的激酶靶点的限制。
目前可用的激酶抑制剂所面临的限制可包括(I)激酶抗性,或激酶靶标中新突变的出现,其可导致对现有疗法的抗性,(II)激酶选择性,或现有疗法抑制其它结构相似的激酶靶标并导致脱靶不良事件的可能性,以及(III)有限的脑外显率,或该疗法治疗已扩散或转移至脑的疾病的能力。
通过优先考虑靶标选择性,Nuvalent相信其候选药物有可能克服耐药性,避免剂量限制的脱靶不良事件,解决脑转移,并推动更持久的反应。这可能导致潜在的更深入、更持久的反应和最小的不良事件,相信这些潜在的益处可能支持在治疗模式中更早的临床应用机会。Nuvalent正在推进ROS1+和ALK+非小细胞肺癌(NSCLC)、HER2外显子20插入阳性肿瘤项目和多个药物发现阶段研究项目的并行领先项目的强大产品管线。
2023年11月14日,Nuvalent展示了NVL-655的ALKOVE-1试验的初步1期临床数据,启动了NVL-520的ARROS-1试验的2期部分,并继续推进NVL-330的临床开发;
任命行业资深人士Perrin Wilson博士为业务发展和战略高级副总裁;
截至2023年9月30日,3亿美元公开募股的净收益,以及现金、现金等价物和有价证券,预计将把运营跑道延长至2027年。
①ALKOVE-1试验报告的初步1期临床数据支持NVL-655治疗ALK阳性NSCLC患者的最佳潜力:Nuvalent最近在马萨诸塞州波士顿举行的第35届AACR-NCI-EORTC研讨会上报告了其正在进行的ALKOVE-1 1/2期临床试验治疗晚期ALK阳性非小细胞肺癌(NSCLC)患者的1期部分的初步剂量递增数据。
在重度预处理的ALK阳性NSCLC患者中证实了初步活性,包括可能已用尽所有可用治疗(包括劳拉替尼)、有脑转移史或具有单一或复合ALK耐药突变的患者亚组。此外,NVL-655表现出良好的初步安全性,与其ALK选择性、TRK备用设计一致。
ALKOVE-1临床试验继续在试验的1期部分招募患者,重点是进一步描述安全性、药代动力学和药效学特征,确定推荐的2期剂量(RP2D),以及NVL-655的最大耐受剂量(如适用)。根据RP2D的选择,该试验旨在直接过渡到第2阶段,该阶段将评估NVL-655在几个扩展患者队列中的安全性和活性,这些扩展患者队列是根据他们先前接受的抗癌治疗的数量和类型确定的。2期队列旨在支持ALK阳性NSCLC患者的潜在登记,这些患者既未使用过劳拉替尼,也接受过劳拉替尼治疗。
除了计划的第2阶段队列外,NuValent还打算在重度预处理ALK阳性NSCLC患者中使用这些初步数据,以指导与医生的讨论,这将为TKI-Naïve ALK阳性NSCLC的发展策略提供信息。
②启动了NVL-520的ARROS-1试验的第2阶段部分,旨在为晚期ROS1阳性NSCLC患者注册:Nuvalent宣布,在与美国食品和药物管理局(FDA)达成一致后,启动了ARROS-1试验的第2阶段部分,每天服用100毫克RP2D。该试验的2期部分包括TKI初治和TKI预治疗的ROS1阳性NSCLC患者的潜在登记队列。该公司预计将在2024年的医学会议上分享ARROS-1试验的最新数据。
③通过IND使能研究推进NVL-330:NuValent正在通过IND使能研究继续推进NVL-330,其新型HER2选择性抑制剂正在开发中,用于治疗HER2外显子20插入阳性癌症。
Nuvalent首席执行官James Porter博士表示:“今年是Nuvalent公司执行力令人难以置信的一年。随着我们最近在ANE大会上的发言,我们在ROS1和ALK阳性癌症领域的两个新型平行先导项目都已提交了初步概念验证数据,我们的第三个候选开发项目NVL-330正在向临床开发推进”。他还表示:“随着我们将重点转向执行全球开发计划,以支持潜在的NDA申报和继续扩大产品组合,我们致力于保持迄今为止建立的高标准和紧迫感。我们将继续壮大我们的团队,以支持下一阶段的开发工作,我们非常高兴地欢迎Perrin Wilson 博士的加入,他在业务开发和商业战略方面拥有深厚的专业知识。”
2023年11月14日,Nuvalent宣布任命Perrin Wilson博士为业务开发和战略高级副总裁,增强了其领导团队的实力。Wilson博士具备超过15年的经验,涵盖业务发展和商业职能的多个领域。他曾在Forma Therapeutics/Novo Nordisk担任关键职务,包括Forma业务发展和整合管理办公室负责人、业务发展副总裁以及全球市场高级总监,镇痛症业务战略。在Forma的任职期间,Wilson博士成功领导了Novo Nordisk的收购,以及将Forma的肿瘤学产品组合外包给三个不同合作伙伴。他负责制定了Forma领先分子的全球品牌计划,同时支持其在美国以外市场的推广和生命周期管理战略。此外,在Takeda的七年工作经验中,Wilson博士曾在各种业务发展和商业职务中取得了卓越成绩,领导了多笔交易以加强Takeda的肿瘤学产品线,包括ARIAD的成功收购。他还在Takeda全球战略和上市前准备方面发挥了关键作用,特别是针对Takeda的骨髓增生异常综合症项目。Wilson博士在Lafayette College获得了生物学学士学位,并在洛克菲勒大学获得了生物医学科学博士学位。他的丰富经验和卓越领导将为公司未来的发展和战略规划提供有力支持。
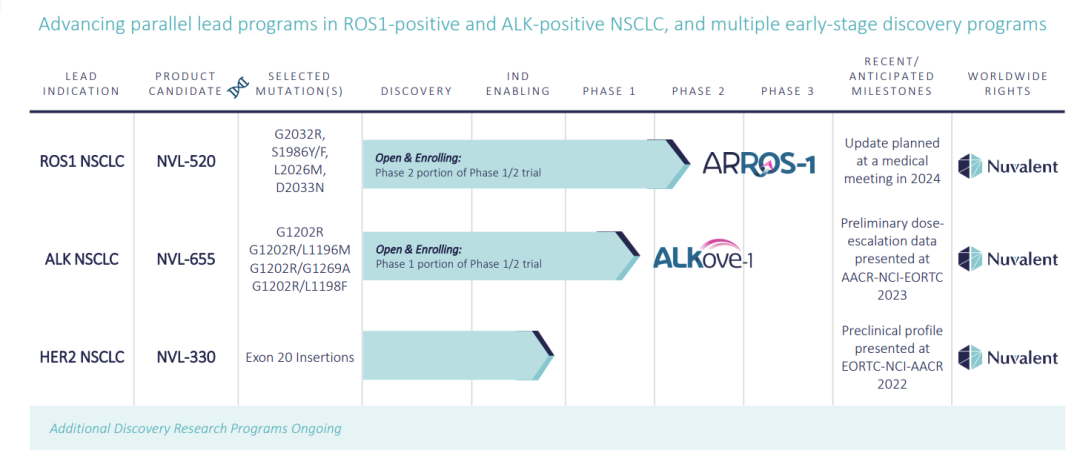
(▲在研管线,更新截至2023年11月14日,源自Nuvalent官网)
NVL-520
该公司的第一个领先候选产品NVL-520正在为ROS原癌基因1(ROS1)阳性非小细胞肺癌(NSCLC)患者开发。NVL-520是一种新型的ROS1选择性抑制剂,旨在解决紧急治疗抵抗、中枢神经系统(CNS)相关不良事件和脑转移的临床挑战,这可能会限制目前可用的ROS1酪氨酸激酶抑制剂(TKIs)的使用。ARROS-1临床试验是一项首次在人类中进行的1/2期、多中心、开放标签、剂量递增和扩展研究,旨在评估NVL-520作为晚期ROS1阳性NSCLC和其他实体瘤患者的口服单一疗法。
ARROS-1临床试验的1期部分于2022年1月开始给药。在2022年10月的EORTC-NCI-AACR研讨会上,该公司展示了ARROS-1临床试验1期剂量递增部分的初步数据,该数据基于2022年9月1日的招募截止日期和2022年9月13日的数据截止日期。该数据表明,NVL-520耐受性良好,未观察到剂量限制性毒性、治疗相关严重不良事件、治疗相关头晕。或导致剂量减少或停药的不良事件。还观察到有利的药代动力学(PK),队列内患者变异性低,暴露量随剂量水平增加而增加。在重度预治疗人群中评估的所有剂量水平均观察到客观反应(RECIST 1.1),包括既往接受过两种或两种以上TKIs和一种或多种化疗的患者,以及既往接受过劳拉替尼或瑞波替尼治疗的患者。在ROS1 G2032R突变患者和CNS转移患者中也观察到反应。
2023年9月,Nuvalent宣布启动ARROS-1临床试验的第2阶段部分,随后与FDA就每日100 mg的第2阶段推荐剂量(RP2D)达成一致。RP2D的选择基于额外的第1阶段剂量递增数据,数据截止日期为2023年5月17日(2023年5月数据)。2023年5月的数据包括87名ROS1阳性患者的安全性数据库,这些患者接受了每日25 mg至150 mg的6个剂量水平,其中37名患者的剂量水平大于或等于每日100 mg。选择每日100 mg作为RP2D的依据如下:
• 100 mg每日剂量水平维持稳态血浆水平高于所有目标疗效阈值(外周和中枢神经系统中的ROS1野生型和ROS1 G2032R);
• 在数据截止日期之前,所有剂量水平均观察到良好的耐受性;和
• 在评估的剂量水平(每日25 mg–150 mg)中,未观察到安全性和有效性的临床显著暴露-反应关系。在2023年5月的数据中,在ROS1阳性NSCLC患者中继续观察到早期抗肿瘤活性,包括重度预处理患者、既往接受氯拉替尼或瑞波特替尼治疗的患者、ROS1 G2032R耐药突变患者和CNS转移患者的客观反应(RECIST 1.1)。良好的初步安全性继续提示高度ROS1选择性、原肌球蛋白受体激酶(Trk)保留设计的潜力。Nuvalent希望在2024年的医学会议上分享ARROS-1试验的最新进展。
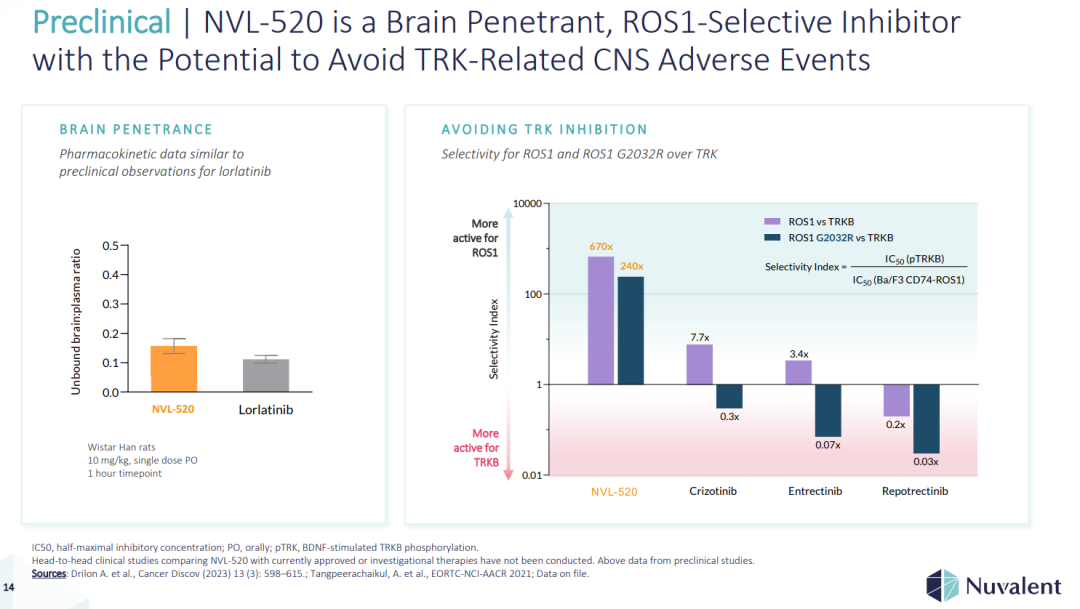
(▲NVL-520是一种脑渗透剂,ROS1选择性抑制剂,有可能避免TRK相关的CNS不良事件,图源自Nuvalent官网)
ARROS-1临床试验的2期部分旨在评估NVL-520在晚期ROS1阳性NSCLC和其他实体瘤患者的RP2D中的总体活性,检查基于这些患者先前接受的抗癌治疗的几个特定患者队列。2期队列已被设计用于支持激酶抑制剂初治或既往接受过治疗的ROS1阳性NSCLC患者的潜在注册。
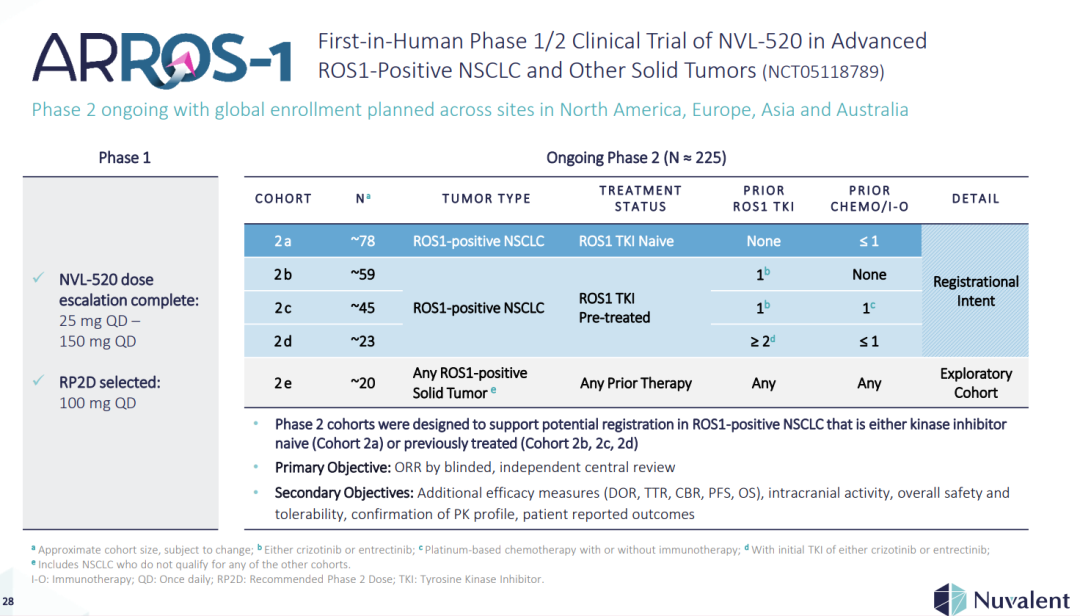
(▲NVL-520在晚期ROS1阳性NSCLC和其他实体瘤中的首次人体1/2期临床试验(NCT05118789),图源自Nuvalent官网)
NVL-655
Nuvalent的第二个领先候选产品NVL-655正在为间变性淋巴瘤激酶(ALK)阳性NSCLC患者开发。NVL-655是一种脑渗透性ALK选择性抑制剂,旨在解决紧急治疗耐药性、CNS相关不良事件和脑转移的临床挑战,这些挑战可能会限制第一代(1G;克唑替尼)、第二代(2G;Ceritinib、Alectinib或Brigatinib)和第三代(3G;劳拉替尼)ALK抑制剂。
临床前数据显示,NVL-655具有脑穿透性,抑制野生型ALK融合,在对ALK抑制剂产生耐药性的突变存在时仍具有活性,并且与结构相关的原肌球蛋白受体激酶B(TrkB)相比,对野生型ALK及其耐药变异体均表现出选择性,从而表明有可能最大限度地减少脱靶TrkB相关的CNS不良事件。
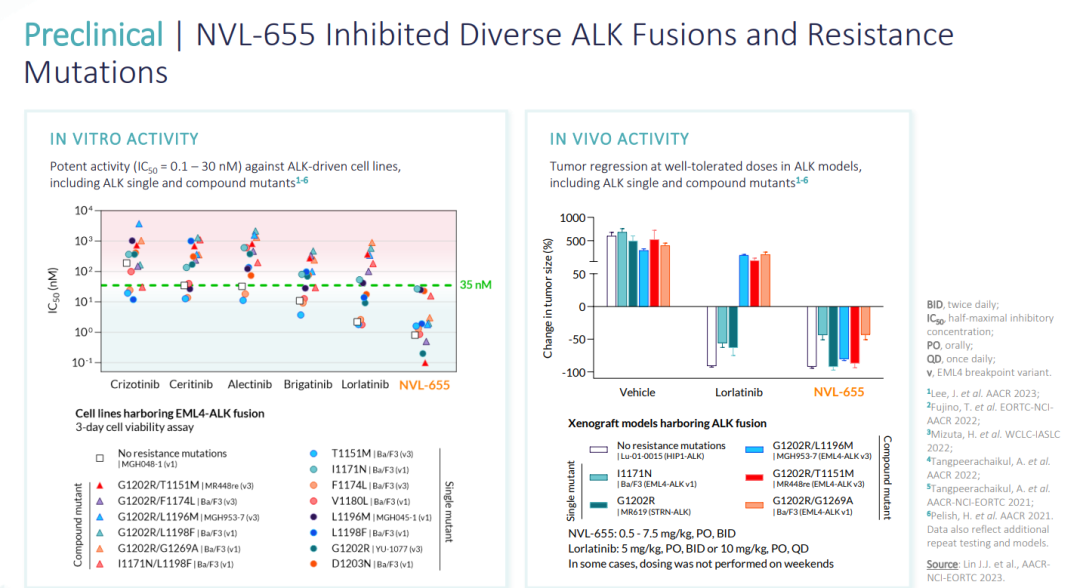
(▲NVL-655抑制多种ALK融合和耐药突变,图源自Nuvalent官网)
ALKOVE-1临床试验是一项首次在人类中进行的1/2期、多中心、开放标签、剂量递增和扩展研究,旨在评估NVL-655作为晚期ALK阳性NSCLC和其他实体瘤患者的口服单一疗法。
2023年10月13日,ALKOVE-1临床试验1期部分的初步剂量递增数据在AACR-NCI-EORTC研讨会上公布。
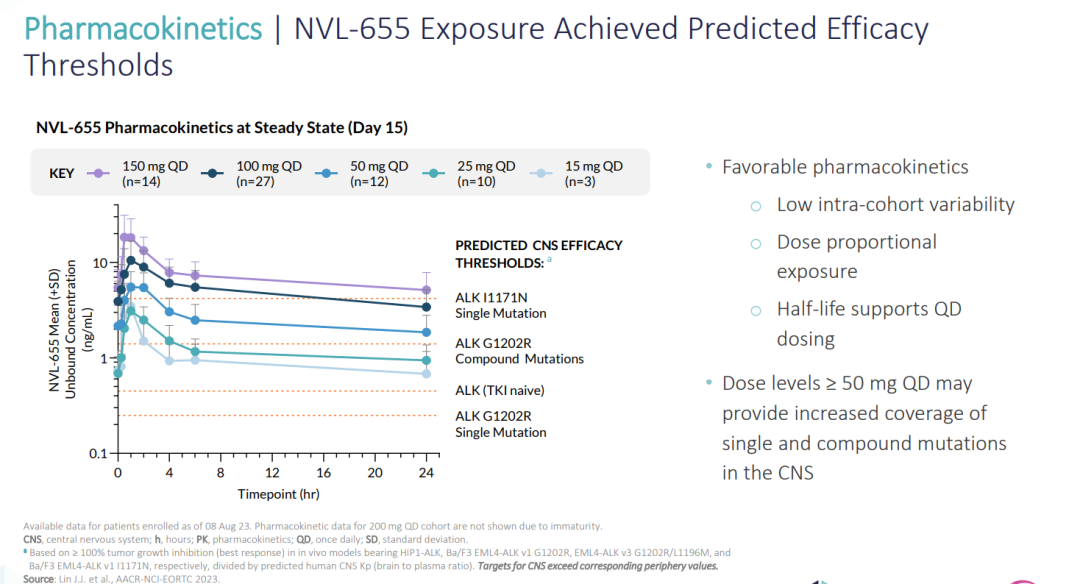
(▲NVL-655暴露量达到预期疗效阈值,图源自Nuvalent官网)
截至2023年8月8日初步数据的招募和数据截止日期,93名患者参加了ALKOVE-1试验的1期部分,其中91名患者患有ALK阳性NSCLC,58%(54/93)有CNS转移史。
对患者群体进行了大量的预处理:
• 100%(93/93)接受了2g ALK TKI或劳拉替尼;
• 77%(72/93)接受了两种或两种以上的ALK TKI,包括一种2g ALK TKI和劳拉替尼;
• 44%(41/93)接受了三种或三种以上的ALK TKI,包括一种2g ALK TKI和劳拉替尼;和
• 46%(43/93)存在已确定的继发性ALK突变,其中26%(24/93)存在任何复合ALK突变。
截至初步数据的截止日期,患者在6个NVL-655剂量队列中接受治疗,分别为15 mg、25 mg、50 mg、100 mg、150 mg和200 mg,每日一次(QD)。截至数据截止日,对NVL-655的初步安全性、PK和药效学(PD)进行了评估,主要发现包括:
• 在ALKOVE-1的剂量递增部分招募的93名患者中,观察到NVL-655治疗具有良好的初步安全性,与ALK选择性、TRK保留设计一致。
大多数治疗相关不良事件(TRAEs)是低度和可控制的,TRAEs的最高发生率是ALT升高(19%,18/93任何级别;6%,6/93≥3级),AST升高(18%,17/93任何级别;4%,4/93≥3级)和恶心(10%,9/93均为1级或2级)。
需要调整剂量的病例并不多见,2%(2/93)的病例停药,5%(5/93)的病例剂量减少。 在200 mg QD剂量水平下,存在一种剂量限制性毒性,即短暂的无症状4级CPK升高。
未达到最大耐受剂量(MTD),初步总体安全性与避免TRK相关神经毒性一致。
• 对于ALK、ALK单一突变和化合物G1202R突变以及其他顽固性ALK单一突变(如I1171N),所观察到的有利的初步安全性特征允许NVL-655暴露水平高于目标CNS功效阈值。
观察到良好的PK和低队列内患者PK变异性,剂量比例暴露量和半衰期支持每日一次给药。
该初步PK数据表明,50 mg QD或更高的剂量水平可增加CNS中单一和复合突变的覆盖率。
• 通过集中确认的ctDNA分析得出的初步PD结果显示,NVL-655治疗在广泛的剂量范围内诱导了多种ALK耐药突变等位基因的清除。值得注意的是,在16例经中心证实的单一或复合ALK G1202R或I1171X(X=N或T)突变患者中,有14例患者的清除率为100%,其中13例患者之前接受过劳拉替尼治疗。
截至初步数据截止日,51例NSCLC患者可通过研究者评估进行疗效评价。关键发现包括ALK阳性NSCLC患者的早期抗肿瘤活性,包括以下患者的部分缓解(RECIST 1.1):
• 重度预处理患者:在可评价疗效的患者中观察到客观缓解率(ORR)为39%(20/51,4例待确认),截至数据截止日,所有肿瘤缓解患者均继续接受治疗,无疾病进展。
对于50 mg或更高的剂量水平,可以增加CNS中单一和复合突变的覆盖率,观察到的ORR为44%(18/41)。
在可能已用尽所有可用治疗方案(≥3个既往ALK TKI,包括2g ALK TKI和劳拉替尼)的患者中,观察到的ORR为40%(10/25)(不考虑既往化疗)和42%(8/19)(既往化疗)
• ALK单一或复合耐药突变患者:任何ALK耐药突变患者的ORR均为54%(15/28),其中复合ALK突变患者的ORR为56%(9/16),ALK G1202R单一或复合突变患者的ORR为71%(12/17)。
• CNS转移患者:在有任何CNS转移史的患者中观察到ORR为52%(15/29)。所有有CNS疾病史的肿瘤缓解患者均继续接受治疗,未出现CNS进展。
• 未用过劳拉替尼的患者:在接受至少一次2g+/-1G ALK TKI治疗且之前未接受过劳拉替尼治疗的患者中,7名患者中有5名(71%)有反应。
截至初步数据的截止日期,67%(34/51)可评价疗效的患者仍在接受NVL-655治疗,治疗时间长达12个月(中位治疗时间为3.4个月)。所有有肿瘤反应的患者均继续接受治疗,无疾病进展。
结合截至数据截止日所观察到的良好的初步安全性,这些数据表明,NVL-655有机会成为一种潜在的最佳疗法,可能能够提升ALK阳性NSCLC患者的治疗模式。
ALKOVE-1临床试验继续在试验的1期部分招募患者,并侧重于进一步描述NVL-655的安全性、PK和PD特征,确定RP2D以及MTD(如适用)。
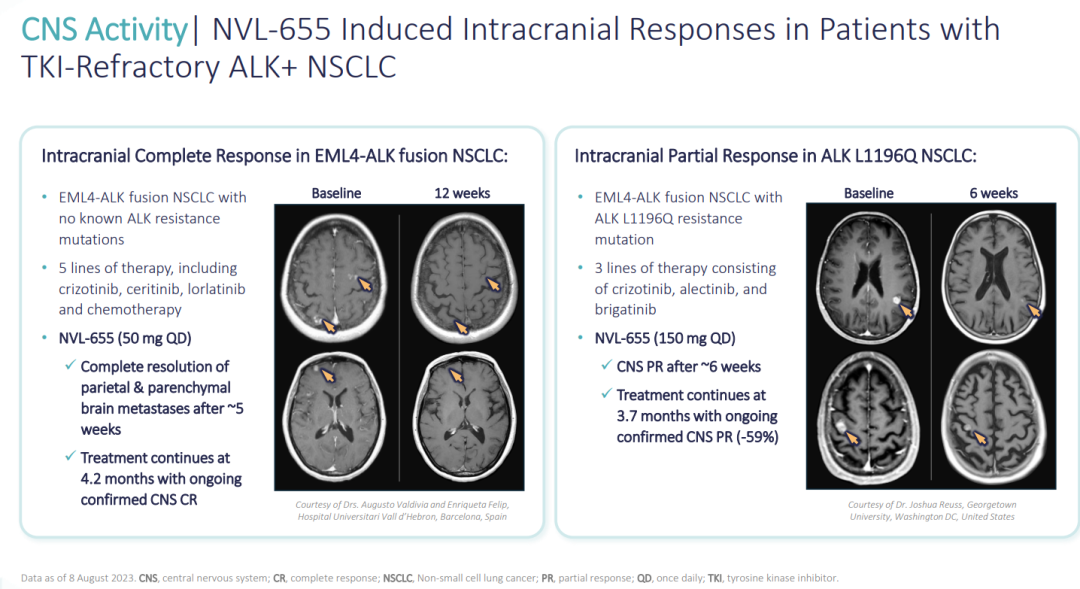
(▲NVL-655在TKI难治性ALK+NSCLC患者中诱导的颅内反应,图源自Nuvalent官网)
根据RP2D的选择,该试验旨在直接过渡到第2阶段,该阶段将评估NVL-655在几个扩展患者队列中的安全性和活性,这些扩展患者队列是根据他们先前接受的抗癌治疗的数量和类型确定的。2期队列旨在支持ALK阳性NSCLC患者的潜在登记,这些患者既未使用过劳拉替尼,也接受过劳拉替尼治疗。
除了计划的2期队列研究外,Nuvalent还打算在重度预治疗的ALK阳性NSCLC患者中使用这些初步数据,以指导与医生的讨论,这将为TKI-Native ALK阳性NSCLC的发展策略提供信息。
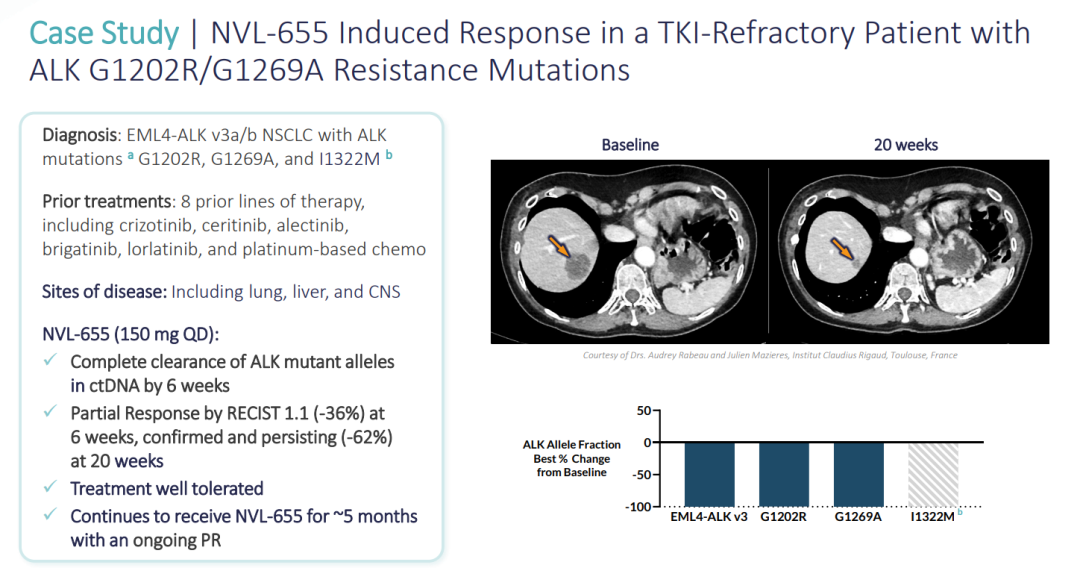
(▲NVL-655在具有ALK G1202R/G1269A耐药突变的TKI难治性患者中诱导应答,图源自Nuvalent官网)
NVL-330
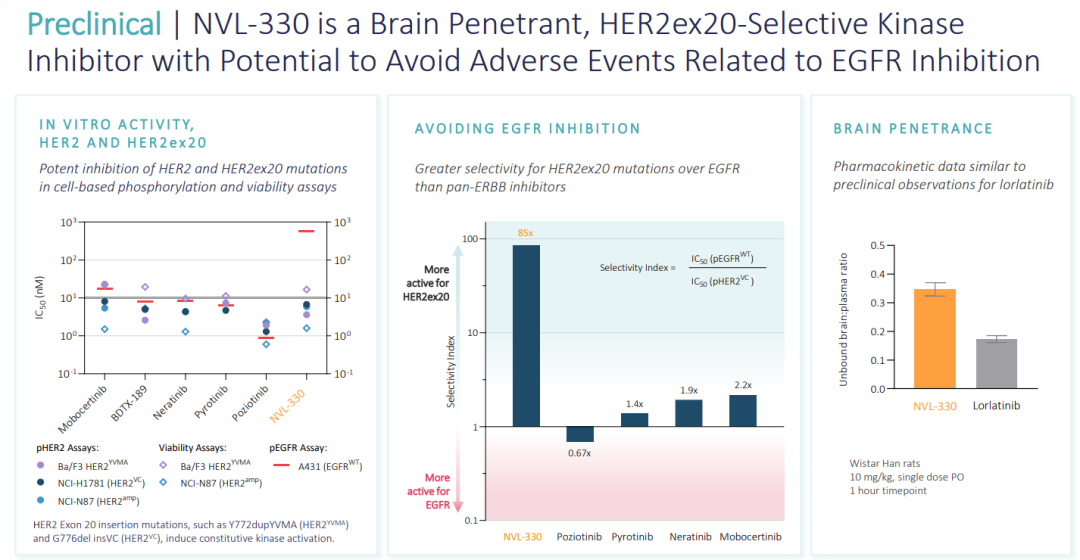
(▲NVL-330是一种脑渗透剂,HER2ex20选择性激酶抑制剂,有可能避免与EGFR抑制相关的不良事件,图源自Nuvalent官网)
Nuvalent最新的候选产品NVL-330是一种脑渗透性人表皮生长因子受体2(HER2)选择性抑制剂,旨在满足治疗由缺失、插入或重复(统称为HER2外显子20插入或HER2ex20)引起的HER2突变引起的肿瘤、治疗脑转移和避免治疗限制性不良事件(包括野生型表皮生长因子受体(EGFR)的脱靶抑制)的综合医疗需求。临床前数据显示,NVL-330在基于细胞的测定中抑制HER2ex20,是脑渗透剂,并且对HER2ex20的选择性超过结构相关的野生型EGFR。该计划的IND赋能研究正在进行中。根据对医疗需求的评估,该公司已经优先考虑了一些额外的小分子研究项目,对这些项目的研究正在进行中。
从2018年开始正式运营至今,Nuvalent几乎将所有精力和财务资源都集中在项目的研发活动上,包括NVL-520、NVL-655和NVL-330,建立和维护知识产权组合,组织和配备公司,业务规划,筹集资金,并为这些运营提供一般和行政支持。截至目前没有任何获准销售的产品,也没有从产品销售或任何其他来源获得收入。
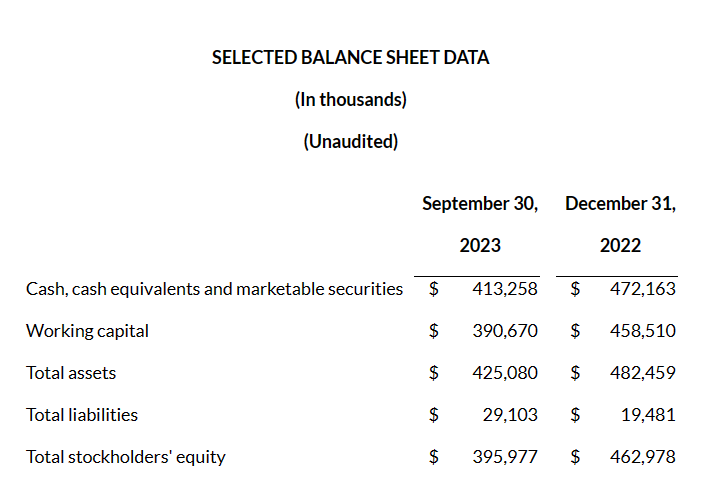
Nuvalent自成立以来遭受了重大的经营亏损,截至2023年9月30日的九个月,该公司净亏损为8790万美元,截至2022年12月31日的一年,报告净亏损为8190万美元。截至2023年9月30日,该公司累计赤字为2.48亿美元。
2023年第三季度报告
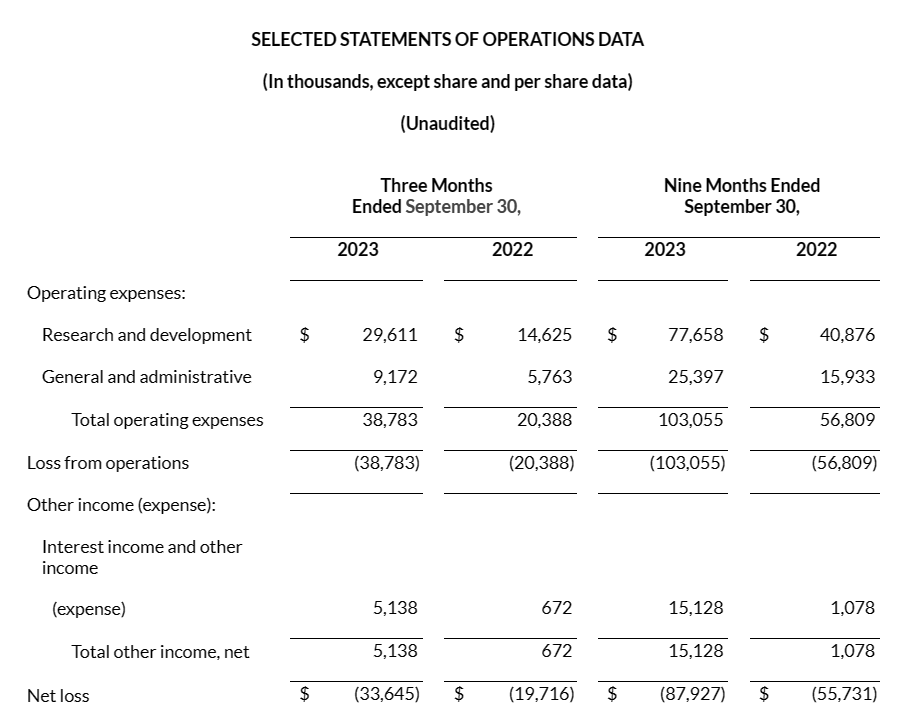
2023年11月14日,该公司公布2023年第三季度报告。2023年第三季度:研发费用为2960万美元;一般及行政开支为920万美元;净亏损为3360万美元,每股亏损0.59美元。截至2023年9月30日,现金、现金等价物和有价证券为4.133亿美元,加上公开发售的净收益约2.82亿美元,预计能将公司运营维持至2027年。
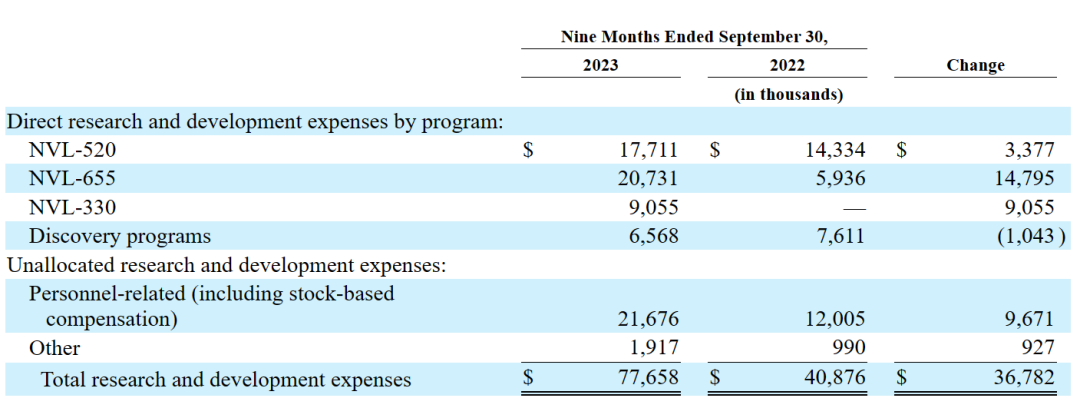
截至2023年9月30日的9个月,研发费用为7770万美元,而截至2022年9月30日的9个月为4090万美元。与NVL-520相关的直接研发费用增加340万美元,主要是由于1/2期ARROS-1临床试验的临床成本增加,部分被制造成本的减少所抵消。与NVL-655相关的直接研发费用增加1480万美元,主要是由于ALKOVE-1临床试验的第一阶段所产生的临床和制造成本增加。
与NVL-330相关的直接研发费用增加了910万美元,主要是由于IND研究的制造成本和转化开发成本。提名NVL-330作为2022年第三季度的开发候选项目。发现项目减少100万美元是由于确定了NVL-330的开发候选项目,其成本现在单独跟踪。人事相关费用增加970万美元,主要是由于员工人数增加。截至2023年9月30日和2022年9月30日的九个月,人事相关费用分别包括820万美元和300万美元的股权奖励支出。
2022财年年报
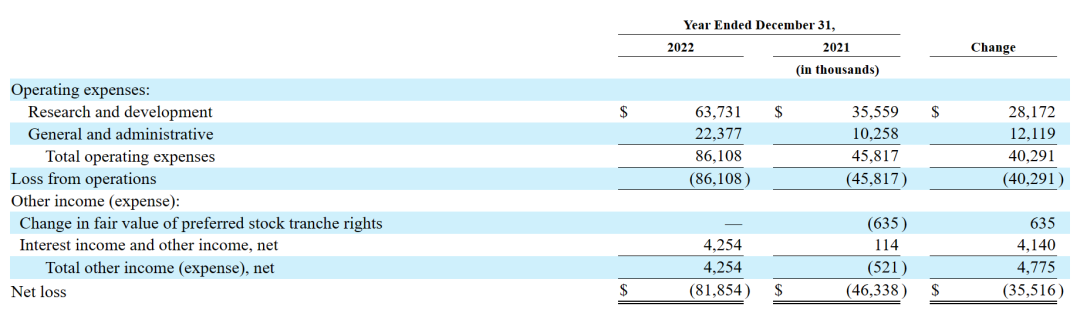
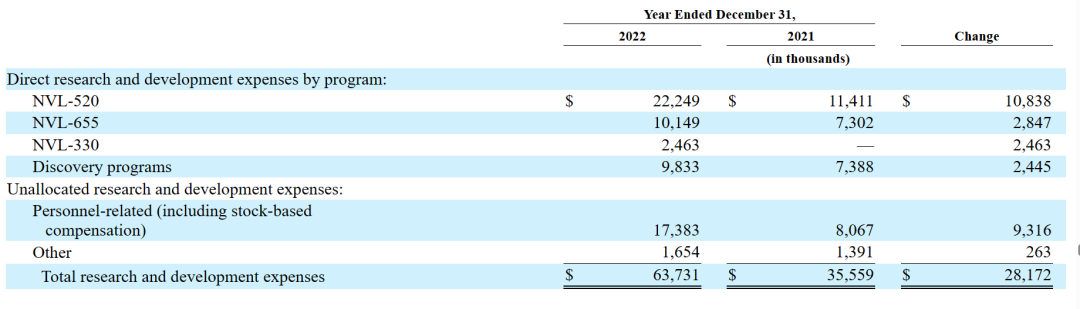
2023年3月16日,该公司公布2022财年年报。2022财年净亏损8185万美元,与2021财年亏损额4634万美元相比,亏损增加了3552万美元。
其中,2022财年全年的一般及行政开支为2240万美元,而2021财年年度该数值为1030万美元;研发费用为6370万美元,而截至2021年12月31日,研发费用为3,560万美元。与NVL-520相关的直接研发费用增加了1,080万美元,主要是由于该公司将NVL-520推进到ARROS-1临床试验的1期部分,导致制造和临床成本增加。与NVL-655相关的直接研发费用增加280万美元,主要是由于随着将NVL-655推进到ALKOVE-1临床试验的第一阶段,临床成本增加。
该公司于2021年8月2日完成其普通股的首次公开募股,并以每股17.00美元的公开发售价发行及出售10,612,500股A类普通股及600,000股B类普通股,包括1,462,500股A类普通股(根据包销商全面行使购买额外股份的选择权)。
2022年11月3日,公司发行并出售了7,895,522股A类普通股,包括承销商全额行使其购买1,029,850股额外A类普通股的期权,以每股33.50美元的公开发行价格进行后续公开发行,扣除承销折扣和佣金以及发行成本后,净收益为2.479亿美元。
2023年10月16日,Nuvalent宣布,其先前宣布的5,357,143股A类普通股的承销公开发行定价为每股56.00美元。所有股票均由NuValent发行。在扣除承销折扣、佣金和其他发行费用之前,此次发行的总收益预计约为3亿美元。
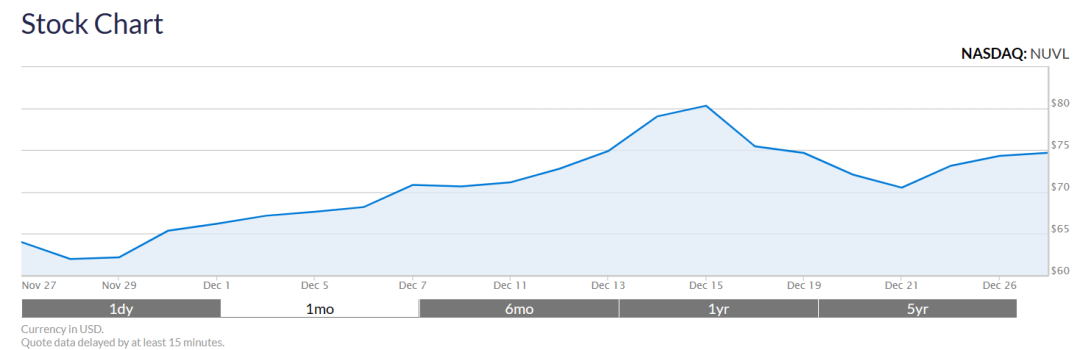
截至2023年12月27日,Nuvalent公司股价每股75.05美元,市值约47亿美元。截止2024年4月19日,目前公司市值约40.21亿美元,每股62.76美元。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China