2代EGFR-TKIs的出现,极大地提高了癌症患者(尤其是NSCLC患者)的生存期及生活质量;3代品种奥希替尼,又及时地填补了无进展生存期后所产生的T790M耐药;虽然,在解决T790M耐药后仍然存在后续进一步的耐药问题,但4代EGFR-TKIs的开发已经在路上。在此,特统计自首个EGFR-TKI吉非替尼至今,全球上市的11个EGFR-TKIs。
EGFR-TKI 1/2/3代发展历程
1988年,首次有研究者提出将EGFR作为癌症的潜在靶点;15年后首个EGFR-TKI吉非替尼获FDA批准上市;2005年,与1代药物耐药相关的T790M突变被发现;2013年,2代代表药物阿法替尼获批上市;2015年,3代EGFR-TKI奥希替尼获批上市,其对患有第1代和第2代EGFR-TKI治疗失败的晚期EGFR突变型NSCLC患者表现出高而持久的应答......
EGFR的结构及功能
EGFR基因,位于人类7号染色体短臂的12-14区,包含28个外显子,其中18~24外显子可以编码该受体的酪氨酸激酶部分;但超过90%的EGFR突变是发生在19~21外显子,尤其是19外显子,约占所有突变的60%。而外显子19碱基缺失和外显子21的点突变往往是对EGFR-TKI治疗敏感的。
EGFR由1186个氨基酸残基构成、分子量为170kD的糖蛋白,是一种跨膜受体,属于一个包括4种相关蛋白的家族,包括EGFR(erbB-1/HER1)、erbB-2(HER-2)、erbB-3和erbB-4。erbB-1广泛分布于除血管组织外的上皮细胞膜上;erbB-2在正常人体腔上皮、腺上皮及胚胎中均有普遍的微弱表达;erbB-3在除造血系统外的多数部位有表达;erbB-4在除肾小球及周围神经外的所有成年组织均可检测到其表达。
EGFR可分为胞外区、跨膜区和胞内区3部分。迄今发现,EGFR共有6种配体:表皮生长因子(epidermal growth factor,EGF)、转化生长因子A(TGFA)、amphire-guin、betacelluin(BTC)、heparin-binding EGF(HBEGF)和EPR。EGFR与其配体的结合具有高亲和性、可饱和性和特异性。配体与受体结合后,引起受体的二聚化作用,形成同型或异型二聚体。二聚化的受体发生交联磷酸化,即一个受体和另外一个受体上特定酪氨酸残基磷酸化,激活胞内区的TK亚区,从而激发下一级信号传导。
EGFR的活化可分为3个步骤:1)EGFR与配体结合后可导致受体形成同源二聚体,也可与其他EGFR家族形成异源二聚体;2)二聚体的形成促使EGFR胞内区6个特异的受体酪氨酸残基磷酸化,分别依次将外界各种信号转导至胞内,主要通过两条途径将信号传递至细胞核,一条是Ras-Raf-MAPK途径;另一条是PI3K-Akt-mTOR途径;3)当信号传导至细胞核后,引起核内基因转录水平的增加,使细胞增殖、转化,EGFR表达增加。
全球已上市的11个EGFR-TKIs
通过查询,全球目前已获批上市的EGFR-TKIs共11个,按照上市时间顺序依次是吉非替尼、盐酸厄洛替尼、二甲苯磺酸拉帕替尼水合物、盐酸埃克替尼、马来酸阿法替尼、甲磺酸奥希替尼、奥莫替尼、马来酸来那替尼、马来酸吡咯替尼、达可替尼、甲磺酸阿美替尼,现一一介绍。
NO1
吉非替尼(2002)
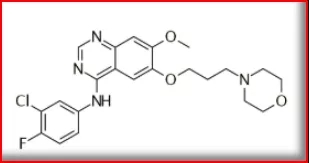
首个EGFR酪氨酸激酶选择性抑制剂,适用于单药继续治疗铂类和多西他赛化疗失败的局部晚期或转移性非小细胞肺癌。研发公司为阿斯利康,2002年7月获PMDA批准上市,2003年5月获FDA批准上市,2005年2月获NMPA批准上市,2009年6月获EMA批准上市,由阿斯利康上市销售,商品名为Iressa®。全球销售额方面,原研2015~2019年均销售额近于5亿美元。
NO2
盐酸厄洛替尼(2004)
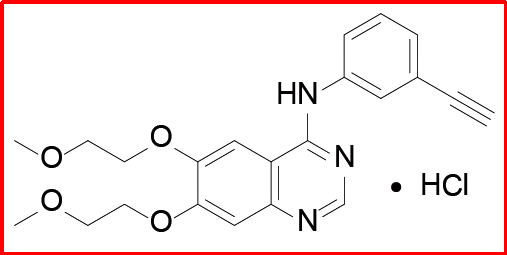
研发公司为基因泰克(被罗氏收购)和安斯泰来,该药一线用于治疗非小细胞肺癌(NSCLC)和胰腺癌。2004年11月获FDA批准上市,2005年9月获EMA批准上市,2007年10月获PMDA批准上市,由基因泰克和安斯泰来在美国上市销售,商品名为Tarceva®。全球销售额方面,2011~2014年均>18亿美元。
一项随机、公开标签的临床试验,接受厄洛替尼治疗的患者与化疗患者相比的PFS具有显著改善(10.4个月 vs 5.2个月);接受厄洛替尼治疗的患者与化疗患者的ORR分别为65%和16%,而OS则没有显著差异。
一项在局部晚期、不可切除或转移性胰腺癌患者中进行的随机、双盲、安慰剂对照的试验,厄洛替尼与吉西他滨联用组和安慰剂与吉西他滨联用组的OS中位数分别为6.5个月和6.0个月,PFS中位数分别为3.8个月和3.6个月,ORR分别为8.6%和7.9%。
NO3
二甲苯磺酸拉帕替尼水合物(2007)
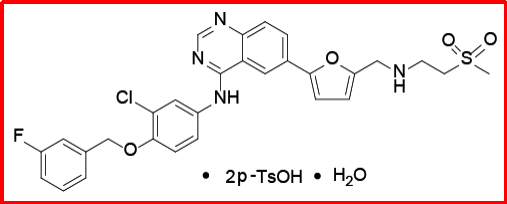
最初由GSK研发,用于治疗转移的或者晚期的乳腺癌以及女性绝经后伴随荷尔蒙-受体呈阳性的转移性乳腺癌。2007年3月获FDA批准上市,2008年6月获EMA批准上市,2009年4月获PMDA批准上市,商品名为Tykerb®,后来随着诺华收购葛兰素史克抗肿瘤药物部门,现在由诺华负责上市销售。
在一项随机、III期试验中评估了拉帕替尼联合卡培他滨治疗乳腺癌的疗效和安全性。拉帕替尼联合卡培他滨治疗组和卡培他滨单独治疗组的中位TTP分别为27.1周vs18.6周(独立评估结果)和23.9周vs 18.3周(研究者评估);拉帕替尼联合卡培他滨治疗组和卡培他滨单独治疗组的反应率分别为23.7% vs 13.9%(独立评估结果)和31.8% vs 17.4%(研究者评估)。
另一项随机、III期试验中证实了拉帕替尼联合芳香酶抑制剂的有效性和安全性,拉帕替尼+曲妥珠单抗+芳香酶抑制剂组与曲妥珠单抗+芳香酶抑制剂组的中位PFS分别为11.0个月和5.6个月,反应率分别为22.5%和8.5%。
NO4
盐酸埃克替尼(2011)
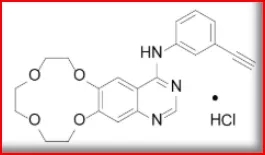
研发公司为贝达药业,2011年6月获NMPA批准上市,适用于EGFR具有敏感基因突变的局部晚期或转移性NSCLC的一线治疗,由贝达药业在中国上市销售,商品名为Conmana®/凯美纳®。
2005年12月贝达以1.1类新药提交埃克替尼的临床申请,并于2006年6月获得临床试验批件;2008年埃克替尼在北京协和医院完成临床I期试验;2009年2月,埃克替尼的III期临床试验正式启动;2010年提交埃克替尼的生产申请;2011年4月,埃克替尼获得生产批件。销售额方面,2016-2019年的全球销售额在1.5~2.2亿美元之间。
一项在全国27家医院完成的大规模随机、双盲双模拟、阳性治疗药物(吉非替尼)对照的多中心III期临床试验,在接受过化疗的晚期NSCLC患者中,与吉非替尼进行安全性与疗效比较。试验结果表明,盐酸埃克替尼对晚期NSCLC的疗效与吉非替尼相当,安全性较吉非替尼更优。
NO5
马来酸阿法替尼(2013)

研发公司为勃林格殷格翰(Boehringer Ingelheim),用于一线治疗转移性非小细胞肺癌。2013年7月获FDA批准上市,2013年9月获EMA批准上市,2014年1月获PMDA批准上市,由勃林格殷格翰上市销售,商品名为Gilotrif®。
一项随机、多中心、开放标签,作为一线药物治疗EGFR突变的晚期非小细胞肺癌的试验中,马来酸阿法替尼PFS的中位数为11.1月,较化疗组(6.9月)有显著性差异。
一项随机、多中心、开放标签、对照组,治疗经一线化疗后的转移性鳞状非小细胞肺癌试验中,马来酸阿法替尼PFS中位数为2.4月,对照组厄洛替尼的PFS为1.9月;其OS中位数为7.9月,对照厄洛替尼的OS为6.8月。
NO6
甲磺酸奥希替尼(2015)
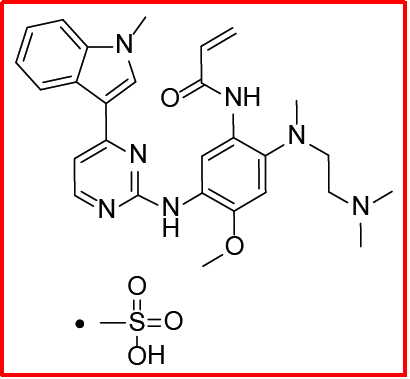
该品种由阿斯利康研发,获批治疗EGFR-T790突变阳性非小细胞肺癌;2015年11月获FDA批准上市,2016年2月获EMA批准上市,2016年3月获PMDA批准上市,2017年3月获NMPA批准上市,商品名泰瑞莎®。全球销售额方面,该品种2017年近于10亿美元,2018年达到18.6亿美元,2019年快速增长为31.89亿美元。
基于III期临床研究数据,与目前标准一线治疗(厄洛替尼或吉非替尼)相比,奥希替尼降低了54%的疾病进展风险。在双盲研究中,标准疗法的中位PFS为10.2个月,而使用奥希替尼的中位PFS为18.9个月。对200名患者进行了基线脑扫描,其中128例患有可测量或不可测量的CNS病变;使用osimertinib 16.5个月后未达到中位CNS无进展生存期,但是使用标准EGFR TKIs的中位CNS无进展生存期为13.9个月。2018年4月,奥希替尼获FDA批准用于EGFR突变阳性(外显子19缺失或外显子21突变)NSCLC转移患者的一线治疗,之前为二线用药获批。
NO7
奥莫替尼(2015)
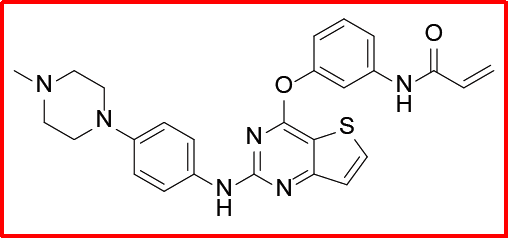
该品种最初由韩美制药研发,用于治疗晚期或转移性T790M突变阳性非小细胞肺癌;2015年12月Olmutinib获得FDA突破性疗法认定用于NSCLC治疗;2016年5月获韩国MFDS批准上市,商品名为Olita®;2016年5月再鼎医药向NMPA提交1.1类化药临床申请。
2017年在亚洲ESMO会议上,一项对一线EGFR-TKI治疗失败的T790M阳性NSCLC患者的临床II期试验结果公布:115名平均年龄63岁可进行独立评估的患者中,Olmutinib显示出适度的活性和可耐受的安全性,mPFS为6.9个月,DCR为87.8%,最常见的AEs是腹泻,但研究过程中有一患者因TEN致死。
NO8
马来酸来那替尼(2017)
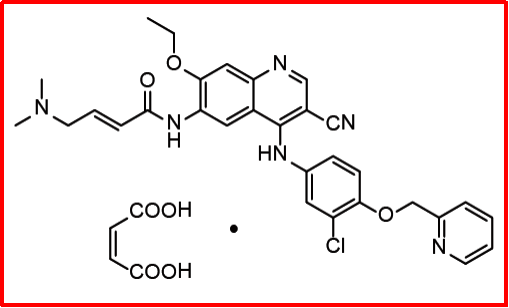
该品种最初由辉瑞研发,2011年授权给Puma;用于治疗既往接受过曲妥珠单抗治疗的HER2阳性转移性乳腺癌。2017年7月得FDA批准上市,2018年8月获EMA批准上市,2020年4月获NMPA批准上市,商品名是Nerlynx®。PS:2018年2月,北海康成(北京)医药科技有限公司与Puma Biotechnology签署了Nerlynx®在中国进行开发和商业化的独占许可协议。全球销售额方面,2018-2019年的全球年销>2亿美元。
一项多中心、随机、双盲、安慰剂对照的ExteNET试验,纳入接受过trastuzumab辅助治疗的HER2阳性乳腺癌患者妇女2840位,主要临床终点为无侵袭性疾病生存率(iDFS),第24个月来那替尼和安慰剂组iDFS为94.2% vs 91.9% ,风险比为0.66。
NO9
马来酸吡咯替尼(2018)

研发公司为江苏恒瑞,2018年8月获NMPA批准上市,用于治疗HER2阳性的转移性乳腺癌患者,商品名为艾瑞妮®。2011年5月,向NMPA提交IND申请;2012年4月,获得中国化药1.1类临床批件;2013年,启动对HER2阳性乳腺癌患者的临床I期试验;2015年,启动对HER2表达阳性转移性乳腺癌患者的临床I/II期试验;2017年8月,在中国提交上市申请,用于治疗HER2阳性的转移性乳腺癌;2018年8月,吡咯替尼凭II期临床试验结果在中国有条件获批上市;2019年4月,马来酸吡咯替尼片在中国启动一项Ⅲ期临床试验,拟在HER2阳性复发/转移乳腺癌患者中评价马来酸吡咯替尼片联合曲妥珠单抗、多西他赛一线治疗的有效性和安全性。
在针对治疗经蒽环类和紫杉类药物治疗失败且复发/转移后化疗不超过2线的乳腺癌患者,马来酸吡咯替尼片联合卡培他滨片(ORR为78.5%,mPFS为18.1个月),与甲苯磺酸拉帕替尼片联合卡培他滨片(ORR为57.1%,mPFS为7.0个月)相比,生存期显著延长,具有统计学显著意义,患者的疾病进展或死亡风险下降63.7%,且耐受性良好。
NO10
达可替尼(2018)
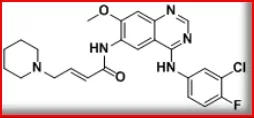
最初的研发公司为辉瑞,2012年授权SFJ Pharmaceuticals合作开发,2018年9月获FDA批准上市,2019年1月获PMDA批准上市,2019年4月获EMA批准上市,2019年5月获NMPA批准上市,批准用于治疗携带EGFR基因外显子19缺失或外显子21 L858R置换突变的转移性NSCLC患者,商品名为Vizimpro®和多泽润®。
一项ARCHER 1050随机、多中心、国际性、开放标签的临床III期试验结果显示:452名患者被随机分为两组,接受达可替尼或者活性对照的治疗,达可替尼与活性对照相比,显著延长了患者的中位PFS;达可替尼治疗组PFS为14.7个月,活性对照组为9.2个月。
NO11
甲磺酸阿美替尼(2020)
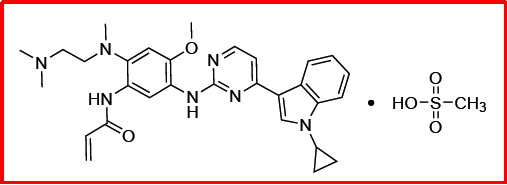
研发公司江苏豪森,被批准用于治疗T790M突变阳性的非小细胞肺癌,商品名阿美乐®。2016年7月,多中心临床试验获FDA批准;2016年8月,向NMPA提交HS-10296的IND申请,2017年3月获批临床;2018年10月,随机、对照、双盲、多中心、III期临床试验评价HS-10296对照吉非替尼一线治疗表皮生长因子受体敏感突变的局部晚期或转移性非小细胞肺癌的有效性和安全性研究启动;2019年4月,在中国的NDA获CDE受理;2020年3月,获NMPA批准上市。
一项开放标签多中心临床I期结果显示:117名患者均接受至少一种剂量的HS-10296治疗,常见的不良事件为1/2级,药物相关的严重不良事件为贫血、血肌酐升高等。此外在具有EGFR T790M突变的82名可评估患者中,ORR为52.4%,而DCR为91.5%,而110 mg组DCR比55 mg组更优(97.2%VS.86.1%)。
参考资料:
1. A phase I study for tolerability, safety, and pharmacokinetics of pyrotinib, a novel irreversible HER2 and EGFR inhibitor, in Chinese patients with HER2+metastatic breast cancer. DOI: 10.1200/jco.2015.33.15_suppl.e11596 Journal of Clinical Oncology 33, no. 15_suppl - published online before print.
2. Phase I Study and Biomarker Analysis of Pyrotinib, a Novel Irreversible Pan-ErbB Receptor Tyrosine Kinase Inhibitor, in Patients With Human Epidermal Growth Factor Receptor 2–Positive Metastatic Breast Cancer, https://doi.org/10.1200/JCO.2016.69.6179.
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China