药融云数据www.pharnexcloud.com监测显示:2017年1月,强生以300亿美元的价格收购总部位于瑞士的生物制药公司Actelion,Actelion是世界领先的肺动脉高压药物研发商,其创新产品与强生旗下杨森制药的产品组合互补。而Actelion的研发部门也在被收购后拆分出来,新公司Idorsia拥有Actelion公司的早期临床开发资产,2017年6月,Idorsia在瑞士证券交易所上市,首日交易结束时市值约15亿瑞士法郎(16.57亿美元,以1.00美元=0.91瑞士法郎计算)。虽然Idorsia在名义上算是一家新公司,但分拆之时公司CEO Jean-Paul Clozel(Actelion的前CEO)就带着之前的几百名员工一起整建制转到了这家新公司,Jean-Paul Clozel表示他的理想是创造另一个Actelion。

Idorsia当前的产品管线主要涵盖心血管、免疫疾病以及中枢神经系统。作为拥有广泛创新药物的公司,即使成立时间不足十年,Idorsia的研发团队却有几十年的研发经验;主要产品管线均为 GPCR 类靶点。
药融云数据库:企业信息
从药融云数据库获悉,2024年3月20日,美国FDA批准TRYVIO(aprocitentan)用于与其他抗高血压药物联合治疗高血压,以降低其他药物未得到充分控制的成年患者的血压。这是近40年来第一个通过新的治疗途径起作用的口服抗高血压疗法。然而就在获批前6个月,Aprocitentan刚经历了“退货”风波,Idorsia承诺向强生旗下的杨森制药支付高达3.06亿瑞士法郎,但须美国FDA和欧洲EMA批准其上市申请。杨森制药对Aprocitentan IP(不包括肺动脉高压)的许可终止,把品牌名称和相关商业材料转让给Idorsia。

看着即将被提上日程的大额交易以及快抄底的流动资产,Idorsia在近年也在与众多有意向合作伙伴交易,2023年7月,Idorsia以4亿瑞士法郎(4.42亿美元)的总对价将亚太区(中国除外)业务出售给Sosei Heptares,该交易还转让了PIVLAZ(clazosentan)在亚太地区(中国除外)地区的许可;2024年3月,Idorsia与Viatris达成合作,由Viatris负责Selatogrel和Cenerimod的全球开发和商业化权利,其中Cenerimod的全球开发和商业化不包括日本、韩国和亚太地区的某些国家。
注:PIVLAZ(clazosentan)是Idorsia的首个商业产品,用于预防动脉瘤性蛛网膜下腔出血(aSAH)固定后的脑血管痉挛、血管痉挛相关的脑梗塞和脑缺血症状,2022年1月在日本获批,同年4月在日本上市;2023年12月在韩国获批。

研发管线
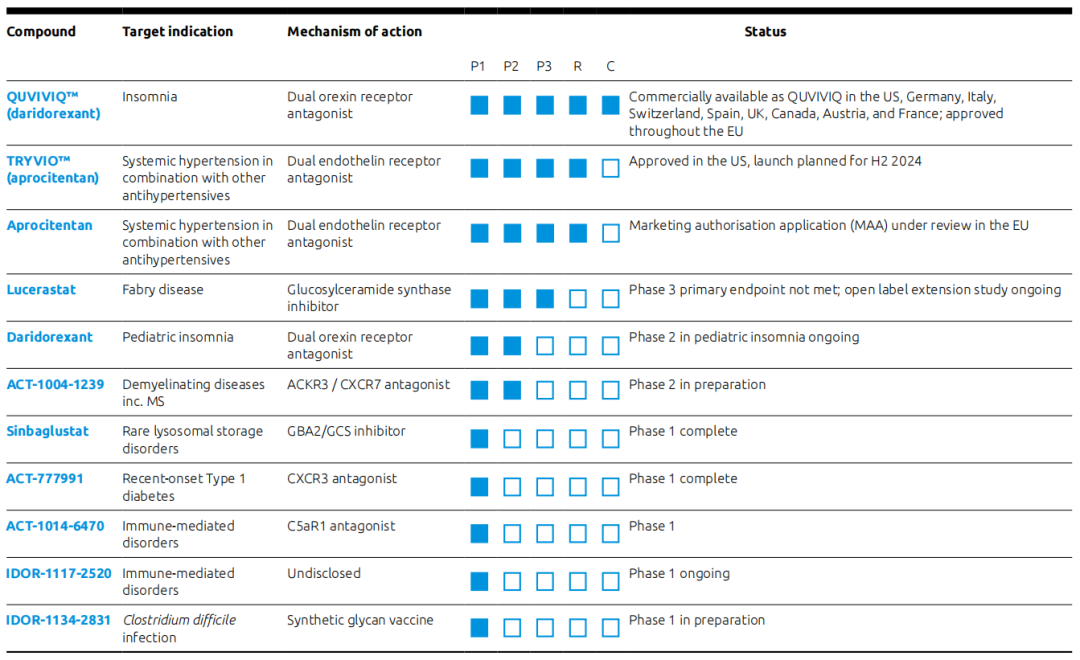
Idorsia的产品管线涵盖多个领域,包括中枢神经系统、心血管和免疫疾病,以及孤儿病。同时公司还拥有一个疫苗平台,用于发现和开发含有合成抗原聚糖分子的糖缀合物疫苗。
1. QUVIVIQ(daridorexant)
Daridorexant是一种双重食欲素受体拮抗剂(DORA),可阻断促进觉醒的食欲素神经肽与其受体结合。与一般通过镇静大脑来诱导睡眠的疗法不同,Daridorexant仅阻断食欲素神经肽对食欲素受体的激活,因此其减少了唤醒驱动,诱导睡眠发生,而不改变睡眠阶段的比例(注:食欲素是一种类似蛋白质的小分子,由大脑产生,可促进清醒)。2022年1月,Quviviq(daridorexant)25mg和50mg被FDA批准用于治疗入睡和/或睡眠维持困难的成年失眠患者,并于当年5月在美国推出。目前该产品已在美国、英国、意大利、德国、瑞士和加拿大等地获批上市。
药融云数据库:药品基本信息
2022年发布的临床试验3期数据显示,在接受Daridorexant给药1个月、3个月后,与安慰剂相比显著改善了患者入睡、睡眠维持及自我报告的总睡眠时间,不改变睡眠结构,且未发现依赖性、反跳性失眠、戒断症状和药物滥用证据,显著区分于苯二氮䓬受体激动剂报告的结果。此外,研究表明Daridorexant除可改善慢性失眠障碍成年人群的夜间睡眠外,还可改善患者的日间功能,是目前唯一被欧洲药品管理局(EMA)批准改善日间功能的DORA类失眠药物。目前针对儿童失眠症的研究进行到临床试验2期,且还在进行Daridorexant对失眠和共病夜尿症患者疗效的批准后研究。

在国内,尚无此类双重食欲素受体拮抗剂类失眠药上市,2022年11月,Idorsia和先声药业就Daridorexant在中国的开发签订独家许可协议,根据协议,先声药业获得大中华地区(中国大陆、香港、澳门)开发和商业化Daridorexant的独家权利,先声药业负责在中国开展该项目的临床研发。2023年7月20日,先声药业宣布盐酸Daridorexant片已获得国家药品监督管理局签发的药物临床试验批准通知书,拟用于治疗症状持续存在至少3个月且对日间功能产生影响的成人失眠患者。
2. TRYVIO(aprocitentan)
Aprocitentan是一款新型口服双重内皮素受体拮抗剂,可抑制ET-1与ETA和ETB受体的结合。它是马昔腾坦(内皮素受体拮抗剂)的活性代谢产物,较马昔腾坦具有更高的半衰期。2022年12月Idorsia向FDA提交了Aprocitentan的新药上市申请(NDA),并于2023年1月底向EMA提交了上市许可申请(MAA)。2024年3月20日,FDA批准TRYVIO(aprocitentan)联合其他抗高血压药物用于治疗成人高血压,以降低血压未得到有效控制的成年患者群体的血压水平,Idorsia预计在2024年下半年推出TRYVIO。
Lucerastat是一种葡萄糖神经酰胺合成酶(GCS)抑制剂,通过减少GB3的合成而不是促进分解来发挥作用,从而减少破坏性的积累。法布里病是一种罕见的遗传性溶酶体贮积症,患者体内的GLA基因往往出现突变,GLA基因突变使α-半乳糖苷酶A(α-Gal A)缺乏或功能障碍,这种酶通常会分解身体细胞中一种被称为球三糖神经酰胺(GB3)的脂肪物质。随着时间的推移,缺乏α-半乳糖苷酶A会使代谢产物Gb3在体内不断累积,当这些物质在血管、肾脏、心脏和大脑等组织与器官中积累到一定含量时,就会造成损害,影响它们的功能。

药融云数据库:药品基本信息
Lucerastat的临床试验3期研究(又名MODIFY项目)旨在确定口服单药治疗成年法布里病患者的疗效和安全性。将118名患者以2:1的比例随机接受Lucerastat(80名患者)或安慰剂(38名患者)治疗,在为期6个月的双盲期结束时,107名患者参加了一项正在进行的开放标签扩展(OLE)研究,该研究旨在确定Lucerastat口服治疗的长期安全性和耐受性,并在长达48个月的额外时间内进一步评估其对成年法布里病患者肾脏和心脏功能的临床效果。2022年10月,Idorsia对OLE研究进行了中期分析,所有继续参与该研究的患者现已接受了至少12个月的Lucerastat治疗。该分析证实了对血浆GB3减少的长期影响,并显示在治疗6个月后肾功能上观察到的信号在更长的治疗持续时间后仍可观察到,支持对肾功能的潜在积极长期影响,分析还显示,安全性和耐受性与6个月随机治疗期间观察到的情况一致。目前OLE研究仍在继续,Idorsia正在与卫生当局就Lucerastat的监管途径进行沟通。
ACT-1004-1239是一流的强效选择性ACKR3/CXCR7拮抗剂。临床前数据显示了抗炎和髓鞘形成作用,且临床试验1期的SAD和MAD研究已经完成,目前正在准备针对多发性硬化症的临床试验2期研究。
Sinbaglustat是一种非溶酶体葡萄糖神经酰胺酶/葡萄糖神经酰胺合成酶(GBA2/GCS)抑制剂,具有治疗罕见溶酶体贮积症的潜力。在临床试验一期药理学项目之后,该公司进行了一项名为“Retrieve ”的自然史研究,研究收集了患有早期罕见溶酶体贮积症(LSD)的儿科患者的疾病信息,基于这一信息,该公司目前正在考虑Sinbaglustat的开发方案。
ACT-1014-6470是一种C5aR1拮抗剂,目前针对免疫介导疾病的研究进行到临床试验1期。IDOR-1117-2520针对免疫介导的疾病的研究也进行到临床试验1期。ACT-777991是一种CXCR3拮抗剂,目标适应症为新近发病的1型糖尿病,当前进行到临床试验1期。IDOR-1134-2831是一种针对艰难梭菌感染的合成聚糖疫苗。目前准备在健康志愿者和患者中进行测试,针对患者的研究将阐明该产品在临床开发的早期时间点在患者人群中预防艰难梭菌感染复发的潜力。

寻求多方合作
对于Idorsia来说,成熟的合作伙伴是获得技术和产品的战略渠道,公司一直在寻求合适的外部项目合作伙伴。
2023年7月,Idorsia宣布以4亿瑞士法郎的总对价将亚太区(中国除外)业务出售给Sosei Heptares,该交易包括Sosei Heptares收购Idorsia在日本和韩国的附属公司,转让PIVLAZ(clazosentan)在亚太地区(中国除外)地区的许可,Daridorexant在亚太地区(中国除外)地区的共同独家许可,以及与授予Mochida Pharmaceutical的daridorexant共同独家许可相关的所有潜在里程碑的转让。该交易还包括Sosei Heptares在支付单独的期权费后,获得Cenerimod和Lucerastat在该地区开发和商业化的许可权。
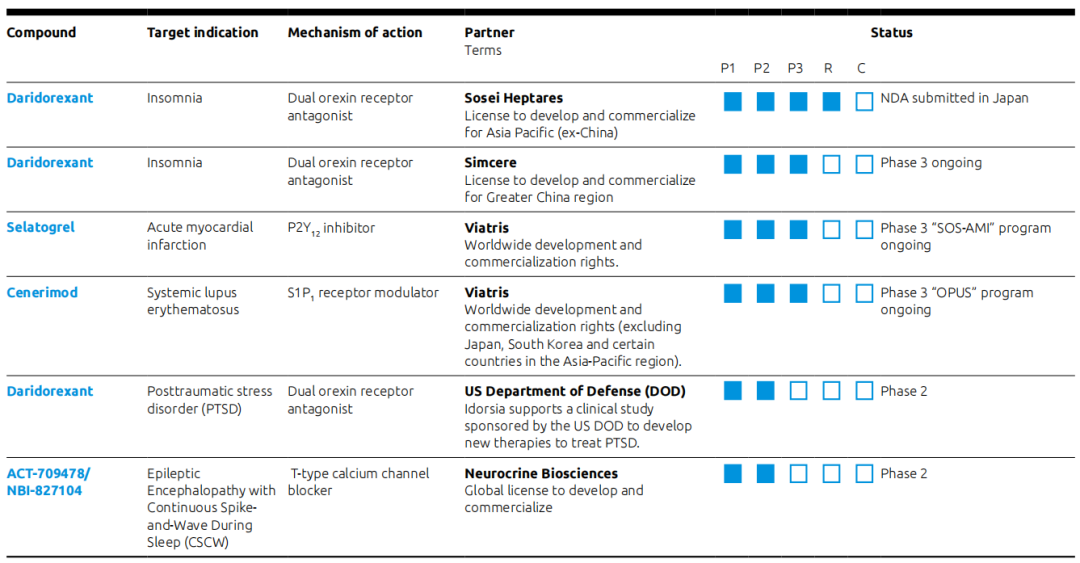
Daridorexant在亚太地区(中国除外)的业务已授权给了Sosei Heptares,日本厚生劳动省正在审查一项新药申请。在大中华地区的开发和商业化权利授权给了先声药业。同时Idorsia支持一项由美国国防部(DOD)发起的临床研究,旨在开发治疗创伤后应激障碍(PTSD)的新疗法,临床试验2期研究将评估潜在治疗干预(包括Daridorexant)对患有PTSD的美国现役军人和退伍军人的安全性、耐受性和有效性。
2024年3月18日,Idorsia宣布已成功完成和Viatris(晖致,全球医疗保健公司)的全球研发合作交易,Viatris负责Selatogrel(针对急性心肌梗死)和Cenerimod(针对系统性红斑狼疮)的全球开发和商业化,其中Cenerimod的全球开发和商业化不包括日本、韩国和亚太地区的某些国家。这两个管线目前均进行到临床试验3期。

ACT-709478(NBI-827104)是一种T型钙通道阻滞剂,主要针对癫痫伴慢波睡眠期持续棘慢波(CSCW)。Neurocrine Biosciences拥有开发和商业化ACT-709478的全球许可,在一项临床试验2期开放标签扩展(OLE)研究中,用于治疗癫痫伴慢波睡眠期持续棘慢波综合征的儿童受试者,虽然盲法研究没有达到主要终点,但ACT-709478总体上耐受性良好,接下来由Neurocrine继续分析来自OLE研究的全部数据,以确定下一步行动。

“斩线”,裁员,求生存
2023年7月,Idorsia宣布实施成本削减计划,目标是将现金消耗减少约50%,公司将审查研发管线和产品,优先考虑可以通过合理的财务投资快速推进的资产,在项目组合审查之后,与公司优先事项不一致的项目将被暂停或准备合作或对外许可。同时还会考虑对位于瑞士Allschwil总部的研发和相关支持职能部门多达500人进行优化。
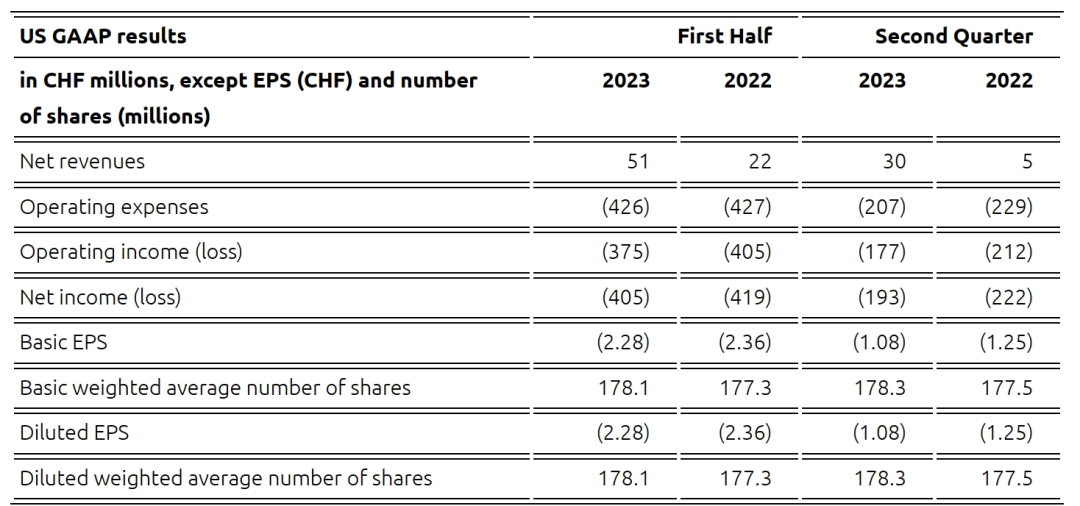
从2023年上半年财务情况来看,上半年净收入5100万瑞士法郎(5634万美元);运营费用4.26亿瑞士法郎(4.71亿美元),其中500万瑞士法郎(552万美元)与销售成本有关,研发费用为1.72亿瑞士法郎(1.90亿美元),销售费用2.49亿瑞士法郎(2.75亿美元);净亏损4.05亿瑞士法郎(4.47亿美元),上年同期为4.19亿瑞士法郎(4.63亿美元),净亏损的减少主要是由于净收入的增加和运营费用的减少。
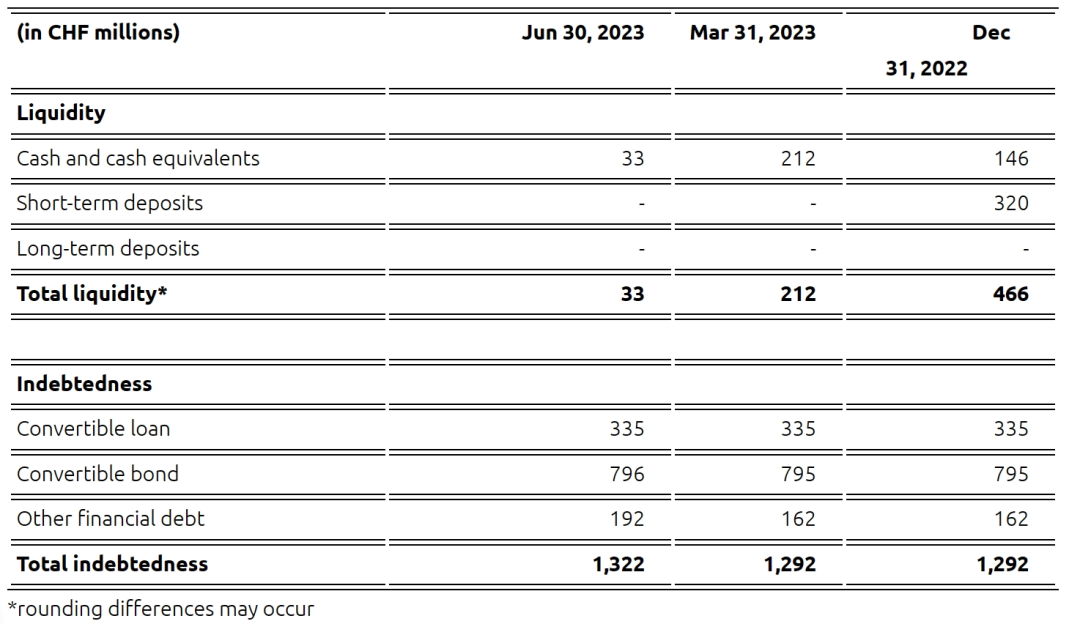
截至2023年6月30日,Idorsia流动资金只有3300万瑞士法郎(3646万美元),Idorsia在前后公布了与Sosei Heptares的交易以及Aprocitentan“退回”的消息,紧接着几个月之后宣布与Viatris(晖致)的研发合作,而原定于2024年2月的2023年度财务业绩并没有如期公布。
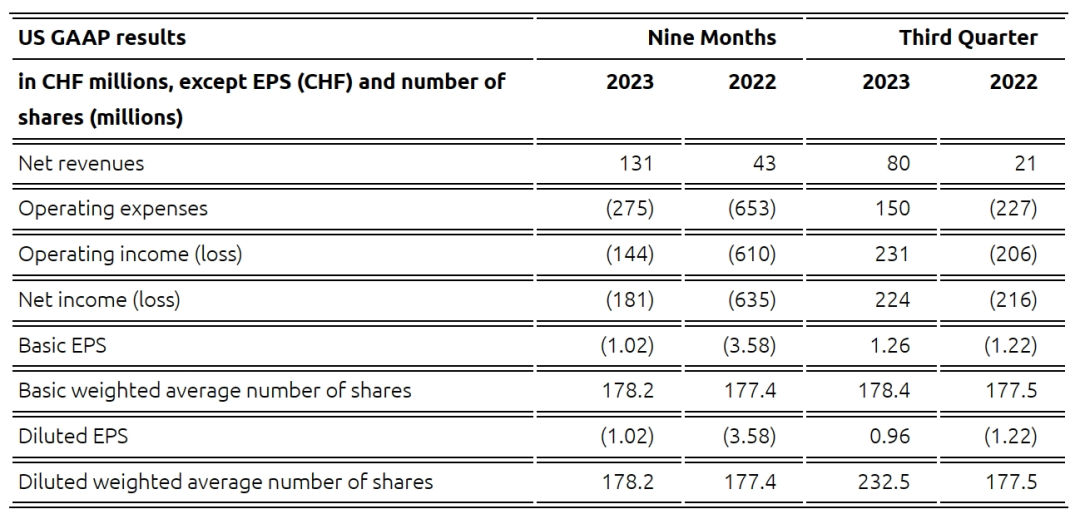
目前从截至2023年9月30日报告的财务业绩来看,2023年前九个月净收入为1.31亿瑞士法郎(1.45亿美元),包括QUVIVIQ的2000万瑞士法郎和PIVLAZ的3400万瑞士法郎销售额、与Sosei Heptares交易的6800万瑞士法郎以及其他合同收入。运营费用为2.75亿瑞士法郎(3.04亿美元),其中销售成本700万瑞士法郎、研发费用2.35亿瑞士法郎。净亏损1.81亿瑞士法郎(2.00亿美元),上年同期净亏损6.35亿瑞士法郎,该项减少主要归因于与Sosei Heptares交易的一次性收入,同时也受到所有职能部门收入增加和运营费用降低的推动。
截至2023年9月30日,Idorsia流动资产为2.55亿瑞士法郎(2.82亿美元),预计支撑公司运行到2024年第一季度。2024年第一季度与Viatris的交易以及QUVIVIQ的获批,或许会使公司的财政紧张得到缓解,当然这得看产品后续的推出情况,如果能够达到预期,或许后面就不需要通过大幅度“取舍管线”来生存了。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China