美国:誉为“重磅炸弹”的Aducanumab商业化溃败
今年年初,国外生物制药网站Fierce Pharma评选出了2021年度最值得期待的10款上市新药。其中,渤健(Biogen)备受瞩目的阿尔茨海默症(AD)候选药物Aducanumab占据榜首。由于AD的发病原因和机制至今尚未明确,目前针对该病的药物研发都是基于各种假说,包括大脑β-淀粉样蛋白(Aβ)沉积、神经纤维缠结等。渤健的Aducanumab就是基于β-淀粉样蛋白假说而研发的一种单克隆抗体药物。
自2003年来,海外阿尔茨海默症领域没有任何新药获得批准,因此Aducanumab的审评过程吸引了业内多方人员的关注,如果该药成功获批上市,有可能会成为首个有意义地改变阿尔茨海默症进程的疗法。
不过Aducanumab的上市之路可谓饱受争议。2020年8月,美国FDA受理Aducanumab的生物制剂上市许可申请,并授予其优先审评资格,但在2020年11月,FDA药物咨询委员会成员对该药物提出反对意见,原因是Aducanumab在两项设计相同的3期临床试验中获得了截然相反的试验结果,而且由于部分患者出现了淀粉样蛋白相关成像异常(ARIA),导致3期临床试验的方案在试验进行过程中经历过两次修订,而两项试验的提前终止也造成了临床数据的不完整。
截图自JAMA
2021年3月,FDA外周和中枢神经系统(CNS)药物咨询委员会的3名成员Caleb Alexander, Scott Emerson和Aaron Kesselheim在JAMA杂志发文再次表达了他们对该药物的反对意见,这给Aducanumab的上市之路又增添了争议。FDA不得不将该药的上市审批时间推迟到2021年的6月7日。

美国时间2021年6月7日,美国FDA宣布Aducanumab(商品名为Aduhelm)获得加速/附条件批准上市,用于治疗阿尔茨海默病患者/阿尔茨海默病人群中特定患者(Alzheimer disease,AD),FDA CDER 官员 Patrizia Cavazzoni 表示:在加速批准路径下,当一个药被证明对替代终点的影响可以合理可能地预测对患者的临床获益,但药物的临床获益仍存在一些不确定性时,FDA 可以批准可能比现有治疗药提供有意义的治疗获益的用于严重或危及生命的疾病的药物。
药融云数据(www.pharnexcloud.com)显示,在美国市场:Biogen的Aducanumab的定价为每次注射4312美元(以平均体重74kg计),每年治疗成本高达5.6万美元,远超其他AD药物。截止到2021年9月30日,本品仅售卖了不足200万美元。2021年Q3仅剩30万美元销售。新药获批上市,离成功更近一步,但是商业化是所有企业的大考验。
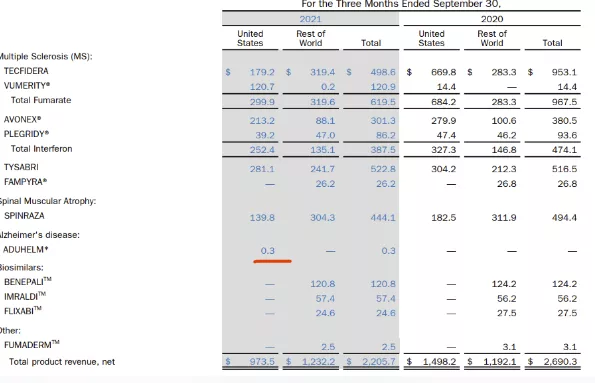
近期,美国媒体Biospace报道,渤健计划裁掉1000多名员工,以节省高达7.5亿美元的资金来处理有关Aducanumab的争议。与本次裁员计划同步离开渤健的高管还有—渤健首席研发官Alfred Sandrock。
甘露特纳胶囊(九期一,GV-971):该药品被列入“重大新药创制国家科技重大专项”支持范围。2020年、2021年均申报成功国家医保初步形式审查,且均顺利通过了专家评审。2020年谈判失败,未被纳入国家医保目录。在今年的调整中,经过32名专家评审,得到了70.47的平均分,按规则给予该药谈判资格。通过谈判,降价66.92%纳入《国家基本医疗保险、工伤保险和生育保险药品目录(2021年)》。具体而言:九期一进入医保目录后,按每月4盒计算,患者用药费用将由原每月自费3580元,降至1184元,若按全国门诊平均50%医保报销比例计算,患者每月自付不到600元。
本品为有条件批准上市;国家药监局要求申请人上市后继续进行药理机制方面的研究和长期安全性有效性研究,完善寡糖的分析方法,按时提交有关试验数据。
甘露特纳胶囊(九期一,GV-971)在中国34个地点招募的818名患者中治疗轻、中度阿尔茨海默病的三期临床试验的数据:
在这项双盲、安慰剂对照、多中心试验中,818名患者被随机分为口服GV-971药物450毫克/次,每日两次,或安慰剂治疗36周。试验参与者年龄在50-85岁之间,符合轻度至中度阿尔茨海默病的临床标准,MMSE评分在11-26分之间,磁共振显示内侧颞叶萎缩视觉评定量表≥2级、Fazekas脑白质损害评定量表<3级、脑腔隙性梗死病灶不超过2个和脑关键区域无腔隙性梗死病灶。主要疗效终点是ADAS-Cog 12(阿尔茨海默病评定量表-认知量表)自基线至36周的变化,次要疗效终点包括CIBIC plus, ADCS-ADL和NPI自基线至36周的变化。安全性评估包括AE、实验室评估、生命体征、心电图、体格检查。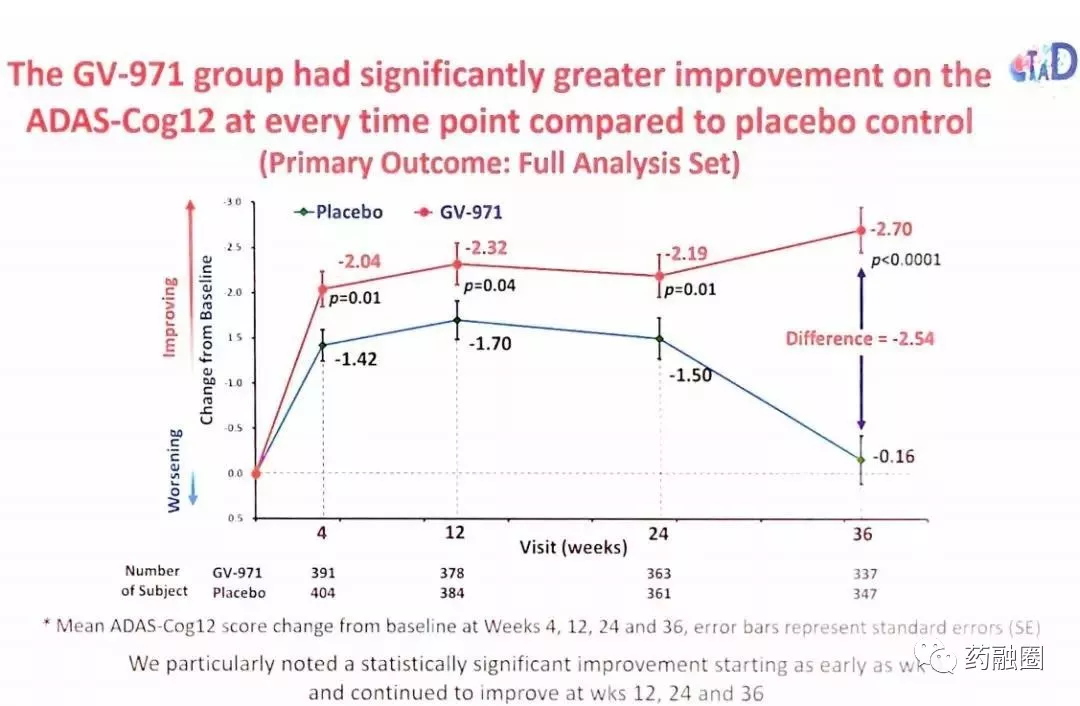
公司表示:GV-971在主要疗效终点ADAS-Cog12方面显示出有统计学意义的改善(p<0.0001)。GV-971与安慰剂在36周时ADAS-Cog12评分的平均差值为2.54。GV-971与安慰剂之间的这一统计学差异早在第4周就被观察到,并在每次后续评估时持续存在。药物安慰剂的差异在MMSE评分范围分别为11-14、15-19和20-26分的三个子组中也有统计学意义。在CIBIC-plus (P=0.059)方面没观察到显著的改善趋势。ADCS-ADL和NPI方面也没有观察到统计学上的显著差异。每日两次口服药物治疗拥有良好的安全性和耐受性。存在不良或严重不良反应的参与者百分比没有统计学上的显著组间差异。

GV-971相关专利为WO-2018032272;目前美国3期临床试验正在进行中,让我们试目以待美国的临床数据。
据悉,按照现行规则,为保证药品有效性,我国国家医保局主要从以下几个方面着手:
一是药品必须通过我国药监部门审评,获批上市。《基本医疗保险用药管理暂行办法》第七条规定,纳入国家《药品目录》的药品,应当是经过国家药品监管部门批准,取得药品注册证书的化学药、生物制品、中成药(民族药)。近年来国家医保药品目录调整,主要面向近几年新获批上市的药品。
二是企业必须提交能够证明药品有效性的资料。在申报、评审、谈判等阶段,均组织相关企业按要求提交有效性等方面的数据资料及对应证据。为保证资料真实性,在申报环节对企业提交资料进行公示,接受全社会监督。请药监局、卫健委等部门提供药品支持资料,为评审提供支撑。
三是药品能够通过专家评审。按照调整规则,符合申报条件、申报成功的药品,需要接受药学、临床医学、药物经济学、医保管理等方面专家的多轮论证。在2021年的评审中,医保局研究制定了评审指标体系,专家们从安全性、有效性、经济性、创新性(传承与创新)、公平性等方面,分别对西药和中成药进行了评审。
参考:
NMPA/CDE;
药融云数据,www.pharnexcloud.com;
FDA/EMA;
相关公司公开披露;
https://www.biogen.com/en_us/history-overview.html;
美版“971”|FDA力排众议,批准Biogen阿尔兹海默单抗Aducanumab;售价高昂;等等。
本文摘自---药融圈
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China