近日国内AAV基因治疗领域群情振奋,4月19、20日国家药品监督管理局药品评审中心(CDE)相继公布了两款AAV基因药物的临床试验申请获批公示。其中一款候选药物是朗信生物旗下上海朗昇生物科技有限公司(以下简称“朗信生物”)自主研发的LX101注射液,用于治疗RPE65双等位基因突变相关的遗传性视网膜变性;另一款是上海天泽云泰生物医药有限公司 (以下简称“天泽云泰”)研发的VGB-R04 注射液,用于治疗B型血友病。作为朗信生物和天泽云泰的CDMO合作伙伴,VGB-R04和LX101项目的亲历者与见证者,宜明细胞与有荣焉!(作者注:两个项目中宜明细胞提供了CDMO全程服务,包括菌种库构建、GMP质粒开发生产、GMP AAV开发生产、方法学开发检测以及稳定性研究等。)
这两个IND的获批,再次将AAV置于聚光灯之下。AAV因其免疫原性极低、安全性高、宿主细胞范围广、扩散能力强、表达稳定以及特异性强等优势,一直受到基因治疗领域青睐,同时,AAV载体生产制备过程中质量稳定性、纯度也越来越受到人们的重视。
AAV载体由两部分组成:二十面体样的衣壳及其包裹着的单链转基因DNA。在AAV载体组装过程中,会产生三种衣壳:完整衣壳(full capsid)、部分衣壳(partial capsid),和空衣壳(empty capsid)。其中完整衣壳包含正确的DNA序列,是人们所期待的产品;部分衣壳和空衣壳则属于生产中的杂质,有如下几种危害:1), 不仅仅影响产品的纯度,2), 还会增加最终产品的免疫原性,3), 并且会与完整衣壳竞争感染细胞上的载体结合受体,从而抑制完整衣壳的转导,增加总体病毒载量。部分衣壳与空衣壳地存在严重地影响了AAV产品的安全性和有效性,因此监管机构强烈建议在整个生产过程中监控空/完整衣壳比(空壳率)。
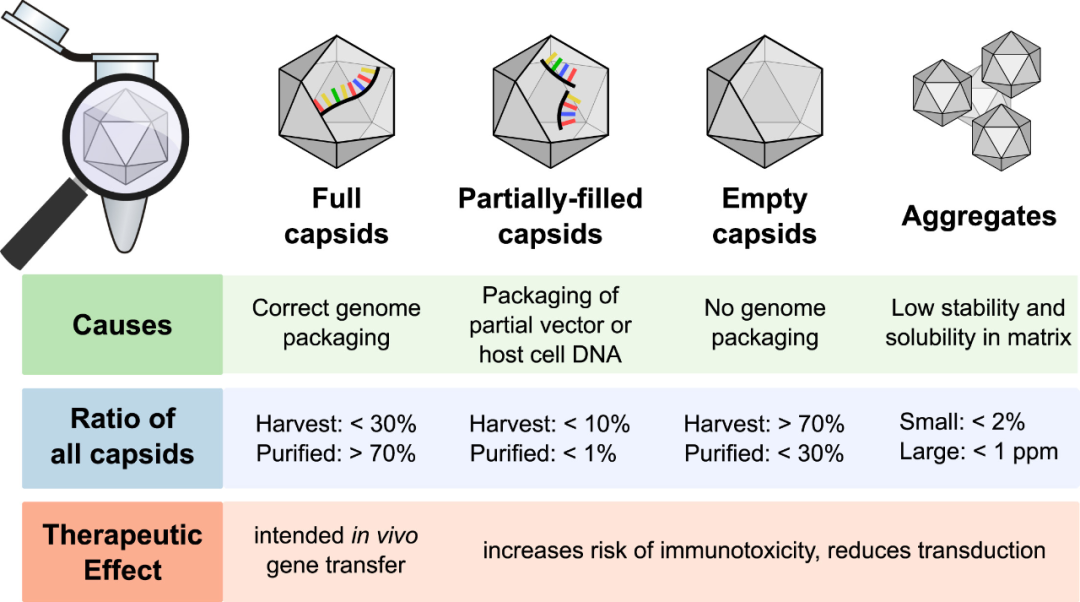
图1 :AAV制备过程中所产生的病毒颗粒类型(图片来源:https://doi.org/10.1016/j.omtm.2021.02.010)
但是如何测量空壳率不仅仅是AAV商业化生产的一个难点,也是药学研究一个难点。宜明细胞深耕基因治疗领域十余年,致力于细胞与基因治疗技术的开发和应用,是AAV载体制造的专家。为了保证AAV产品的安全性、批次一致性、确定剂量等关键质量属性,宜明细胞打造了一个高精准度、全面的(可覆盖各个血清型)、可实现相互验证的AAV空壳率检测平台,实现了AAV一站式自主检测,降低空壳率检测成本并且极大地缩短了检测周期。
本平台应用多种技术表征空衣壳的含量,主要包括透射电镜(Transmission Electron Microscopy ,TEM)、离子交换色谱法(Anion-Exchange Chromatography ,AEC)、分析超速离心技术(Analytical UltraCentrifugation AUC),以及qPCR、酶联免疫吸附试验(Enzyme-Linked ImmunoSorbent Assay, ELISA)、光密度法(Optical Density, OD )等常用 的技术。我们将重点进行介绍。
透射电镜(Transmission electron microscopy,TEM)
TEM是比较常用的测定空壳率的参考方法,也常常用于识别聚集物、变形衣壳和非衣壳颗粒(如宿主细胞碎片)。TEM是利用加速电子束通过电磁透镜穿透样品,聚焦生成纳米级分辨率图像。TEM使用阴性染色,观测样品为亮,背景为暗。对于AAV (直径约25 nm)来说,样品图像中染色衣壳、部分染色衣壳和未染色衣壳分别代表空衣壳、部分完整衣壳和完整衣壳。
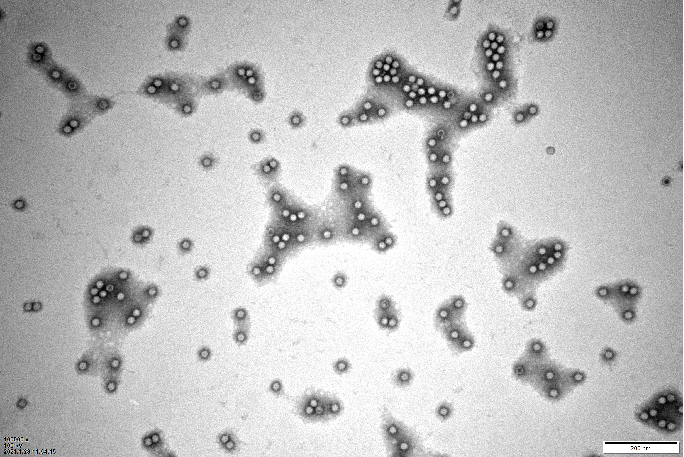
图2|TEM图像:AAV空壳率10%。空衣壳呈现一个中心有黑暗点的亮环;完整衣壳呈现出中心明亮的颗粒状病毒;部分衣壳显示中心稍微偏暗(数据源自:宜明细胞)
TEM常用于检测AAV样品空壳率、聚集和纯度等指标。这一方法样品制备简单,可直接目视检测,但是也存在局限性。TEM只应用于纯化后的样品,样品中的蛋白质和细胞碎片会干扰TEM图像中AAV衣壳的准确识别。TEM依赖于人工视觉识别进行量化。为了统计学的显著性,工作人员必须对数千个衣壳进行成像和分析(单个图像的衣壳含量变化约为2%)。另外,颗粒部分填充以及染色不均匀会无法清晰识别各类衣壳亚种。因此,在宜明细胞,TEM的结果常用于参考数据,与其他正交验证方法(AEC、AUC等)一起评估。
阴离子交换色谱法(anion-exchange chromatography,AEC)
AEC可以用于多种血清型空衣壳颗粒和完整衣壳颗粒的分离。因为不同血清型的衣壳所带的负电荷,与包装了完整基因组DNA后的病毒颗粒所带的负电荷有差异,导致不同的衣壳亚种之间的等电点不同。AEC就是基于这一差异在正电荷固定相上进行样品的分离。应用紫外检测器的AEC具有较高的重复性(<1% ~ 4% CV)和中等精确度(2% ~ 5% CV),其精确度可以通过与TEM和AUC测试结果相比较来评估,但是受限于检测器的灵敏度,样品浓度不得低于1011 vg/mL。因此如果样品浓度足够,AEC的高通量和可重复性非常适于在工艺开发中常规使用。将AEC应用于HPLC系统(需配备OD/FS检测器),可检测洗脱液的含量比,是宜明细胞AAV下游生产工艺中最主要的纯化方式之一。不过AEC分辨率还有待提高,空衣壳、部分完整衣壳和完整衣壳的基线分离仍未解决。
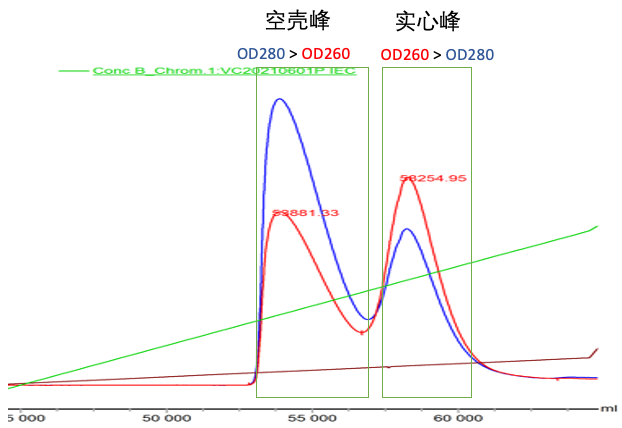
图3|AEC分离空壳与完整衣壳(数据源自:宜明细胞)
分析型超速离心技术(Analytical Ultracentrifugation,AUC)
AUC是表征生物大分子特性、研究生物分子理化性质的主要技术手段,也是目前能够精确表征AAV病毒颗粒特性,测定聚合物,量化空衣壳、部分完整衣壳和完整衣壳的相对含量的重要手段之一。因其远高于其他技术手段的数据分辨率,AUC被业界视为检测空壳率的金标准。近期宜明细胞斥巨资为苏州/济南基地购置了Optima AUC,便于产品空壳率检测,以及细胞培养条件的优化。
AUC可以通过紫外线吸收或Raleigh干涉实时扫描离心过程中样品各个组份的分布状态,通过分析其随时间的变化过程,以计算出不同组分的沉降系数。然后再依据空壳病毒与全病毒颗粒沉降系数的不同,精确地测定出AAV载体的空壳率。AUC同时可以检测中间产物、病毒载体碎片、基因组碎片、病毒聚集体等。
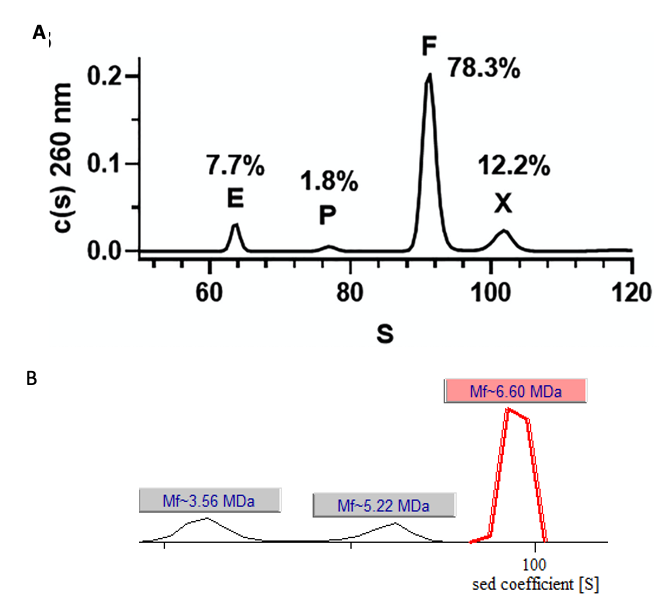
图4|AAV样品的AUC沉降系数分布(数据A源自:DOI: 10.1016/j.omtm.2019.09.006;数据B源自:宜明细胞)。图中各字母代表含义:E (Empty capsid),空衣壳 60s;P (partial capsid),部分完整衣壳60-100s;F, 完整衣壳(Full capsid)100s;X, 不明物
AUC在定量含量比方面有显著优势,一是可重复性高,变异系数(coefficient of variation, CV)仅为2%;二是分辨率高,可有效区分部分完整衣壳、空衣壳和完整衣壳。但是AUC也有自身的限制。 首先只能用于无残留杂质或赋形剂的纯化样品的检测。其次检测样品用量很大,比如样品滴度须在2 ~5 × 1012 cp/mL(CP:capsid particle)物理滴度水平上进行以及400-500 μL的使用量,这在生产的早期阶段无疑是不小的损失。另外AUC测试用时较长,通常在6小时左右,而且每次只能测试3个或者7个样品,因此在工艺开发过程中常规使用AUC也是极具挑战性的。事实上,AUC非常适合作为正交方法来验证其他更快但是分辨率较低的方法,比如AEC。
另外 qPCR作为分子生物学实验的常规技术,常用于量化AAV载体基因组的滴度。ELISA是通过底物酶促反应显色来测定衣壳蛋白的滴度。这两种技术应用广泛,但是都属于间接检测,不能准确定量。 OD通过测量260 nm和280 nm处核酸和蛋白的吸收来定量衣壳蛋白的滴度和AAV载体的含量比。OD法精确度和重复性不高,因此数据仅用于参考。
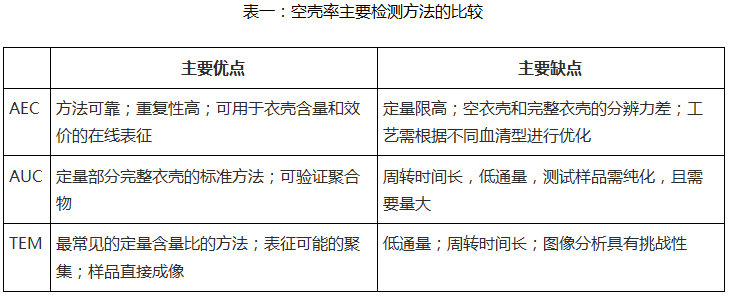
综上所述,在AAV空壳率的检测过程中每种量化含量比的方法都要在通量和分辨率之间进行权衡。在快速的高通量方法中,AEC是最具前景的。TEM则可以提供更直观的数据。在高分辨率的方法中,AUC独领风骚,是目前唯一可行的、可定量部分完整衣壳的“金标准”。AUC 可提供高分辨率AAV样品分析信息,可实现定量鉴别空心、实心、部分实心颗粒及聚集体。宜明细胞的空壳率检测平台将三种检测方法相互结合参照验证,全面表征AAV产品,全面提高空壳率方法学验证能力和放行检测的速度,确保高品质AAV产品的持续稳定供应;同时可以为业内类似产品提供检测服务。
今年三月,宜明细胞的苏州基地生产已正式启用,拥有近万平米的GMP厂房,符合国际一流标准的CGMP生产线数十条,原核发酵规模为10L-50L-200L,真核细胞培养规模为50L-200L-500L-2000L。
更先进: AAV病毒滴度产率高达1E14VG/L;
更安全:领先的方法学开发验证及检测能力;
更高远:全面为CGT企业提供CDMO整体解决方案,助力基因治疗产业蓬勃发展。
初心如磐,笃行致远,宜明细胞将不断践行初心,让良药更快惠及患者!
Ubrigene, Serve with hearts!
本文摘自---药融圈
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China