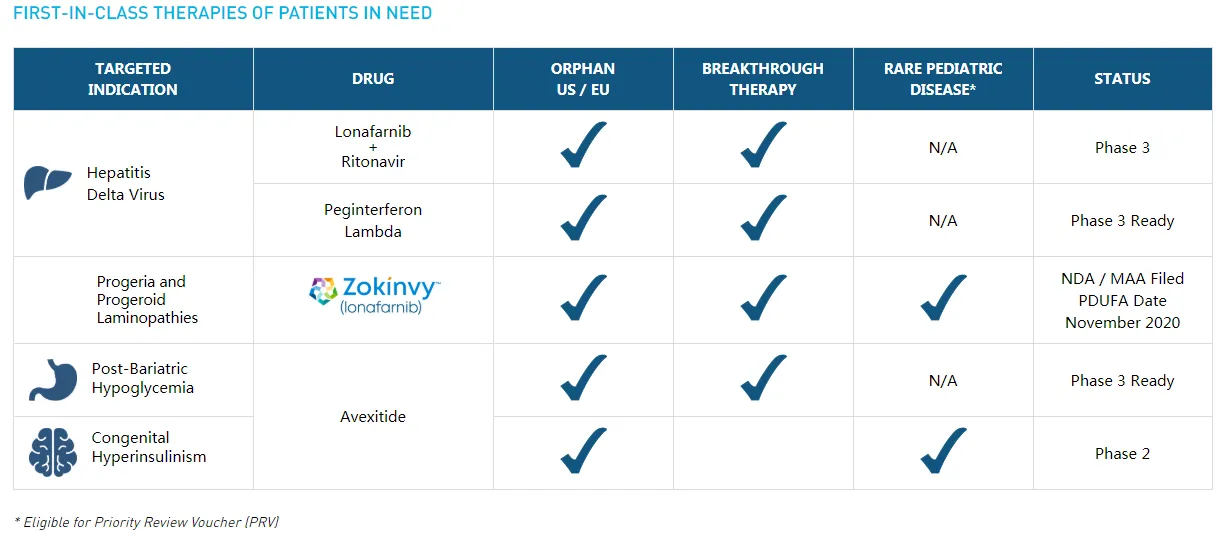
Eiger BioPharmaceuticals(纳斯达克代码:EIGR),最早成立于2008年,当时专注研发罕见疾病及超罕见疾病新药。

2020年5月,美国FDA接受其开发的First-in-class新药-口服法尼基转移酶抑制剂剂(FTI)Zokinvy(lonafarnib)治疗12个月以上的早衰症(HGPS)和早衰样核纤层蛋白病(progeroid Laminopathies ,PL)患者的新药申请(NDA),同时授予其优先审评资格(审评时限由标准的10个月缩短至6个月)。
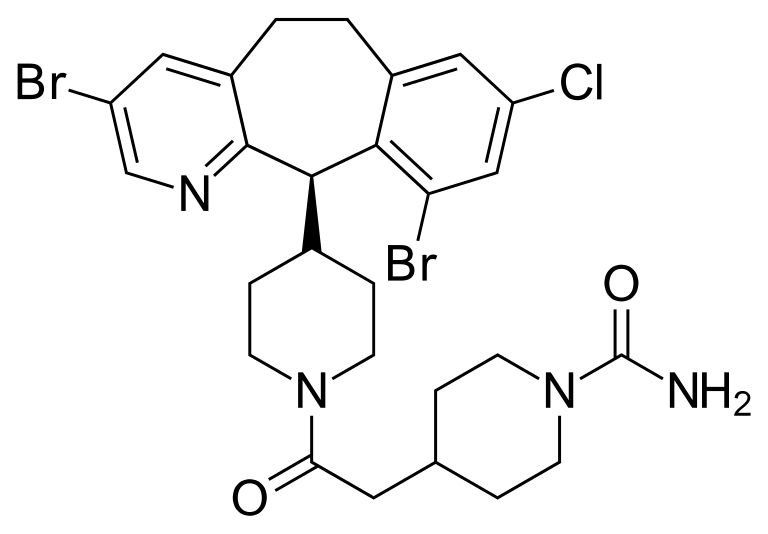
Zokinvy主要活性成分lonafarnib结构式
2020年11月20,这款突破性疗法新药Zokinvy(lonafarnib)正式获得美国FDA批准上市。FDA指出这是其批准的首个早衰症新药。本品最早由Eiger BioPharmaceuticals从默沙东(Merck Sharp & Dohme Corp.)引进。
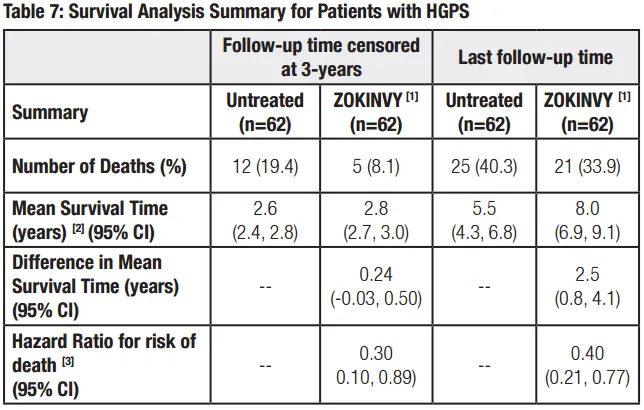
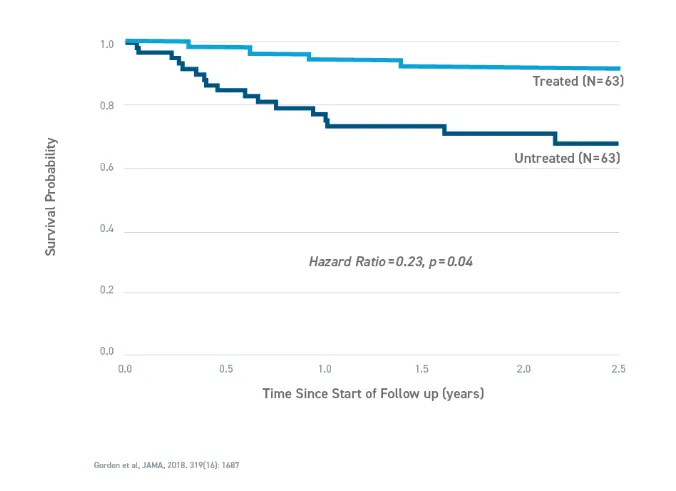
当时获批上市的临床试验基础:一项观察性队列研究评估了接受lonafarnib单药治疗的早衰儿童(n = 63)(单臂)和单独自然史中未接受lonafarnib治疗的早衰儿童(n = 63)的死亡率。这些接受治疗的儿童按性别、年龄和居住地区与未接受治疗的患者相对应。用lonafarnib单药治疗的剂量为150 mg / m2 ,每日两次。63例接受lonafarnib治疗的患者有4例死亡(6.3%),而未治疗的历史对照组中有17例死亡(27%)。与未经治疗的对照组相比,接受lonafarnib治疗的儿童在平均2.2年的随访期内死亡率降低了77%(HR=0.23,P = 0.04)。接受lonafarnib治疗的早衰症患者,平均寿命比未接受治疗的患者延长了3个月,在最长的11年随访时间内平均寿命延长了2.5年。此前相关临床结果发表在2018年的美国医学会杂志(JAMA)上。
2020年11月23日,Eiger BioPharmaceuticals宣布总价9500万美元出售美国FDA授予的优先审评券(Priority Review Voucher ,PRV)。不过The Progeria Research Foundation (早衰症研究基金会)分享一半的权益。(优先审评券制度是FDA为鼓励制药企业开发针对某些热带疾病、罕见病等药物所推行的一种福利补偿制度。凡是按照官方所列疾病清单成功开发出的相关药物的药企可获得一张优先审评券。Priority Review Voucher可由获得的药企自行使用,或者转手卖给其他制药企业)

在2021年时候,Zokinvy年治疗费用目前约为103.2万美元,研发的公司Eiger BioPharmaceuticals开展了ONECARE计划,为患者提供商业医疗保险等支持。
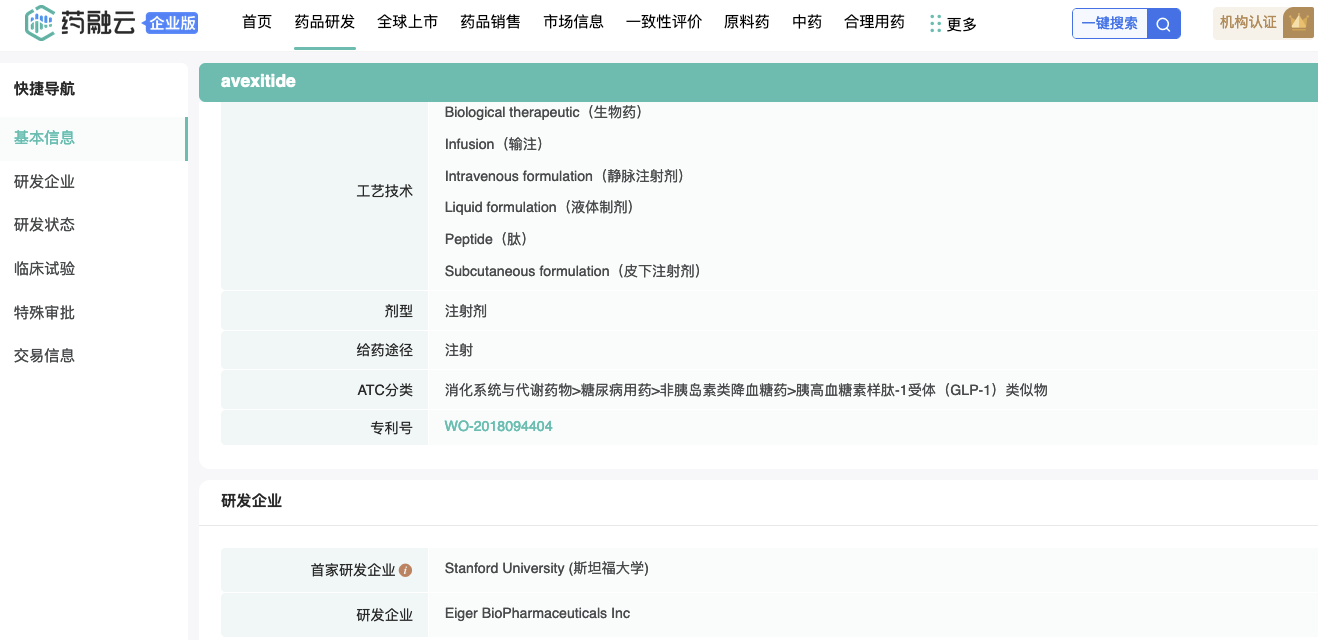
2023年6月29日,Eiger biopharmacpharmaceuticals宣布,在优先级评估之后,公司对研发管线进行了调整,将专注于GLP-1受体拮抗剂药物。公司将重点开发GLP-1药物Avexitide(用于治疗减肥后低血糖症(PBH)和先天性高胰岛素血症(HI))(2015年9月从斯坦福大学引进,相关专利WO-2018094404),以及继续商业化Zokinvy。此外,公司决定裁员25%,减少与丁型肝炎(HDV)开发项目相关的研发支出。
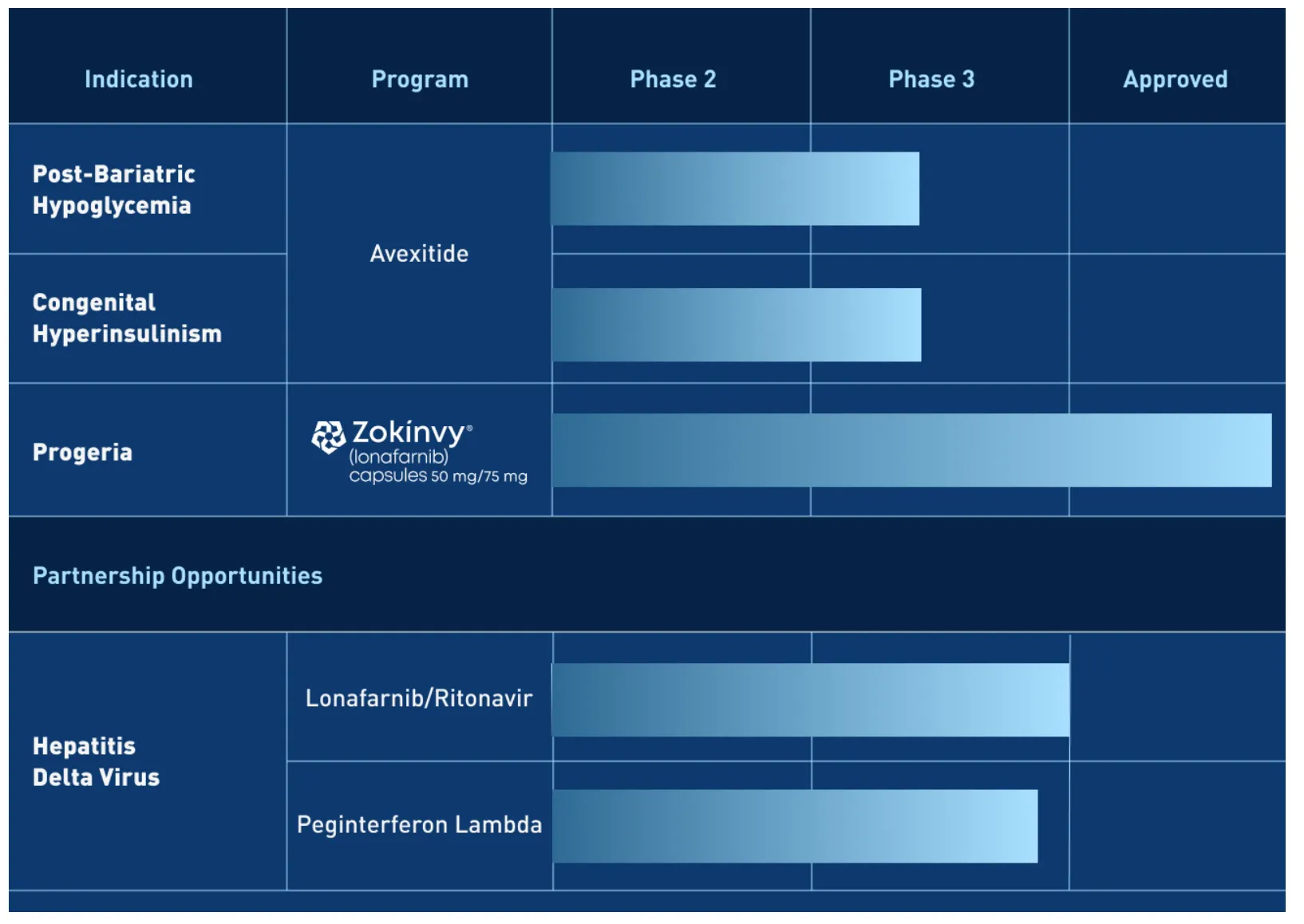
2024年4月1日,Eiger biopharmacpharmaceuticals根据破产法第11章申请破产,将从纳斯达克退市。

Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China