1
礼来以19.3亿美元收购减肥药制造商Versanis

2
融资3.4亿,GLP-1降糖药药企申请IPO

3
首个国产GLP-1减肥药获批,来自华东医药
4
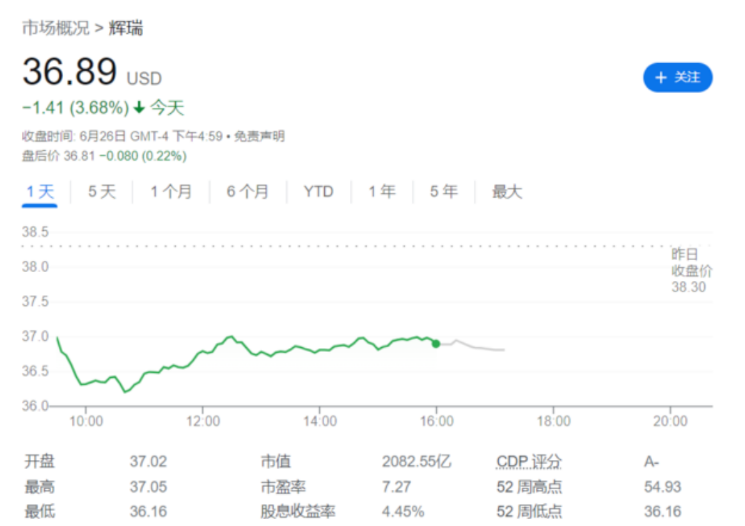
患者转氨酶升高,辉瑞放弃Lotiglipron药物的研发
6月26日,制药巨头辉瑞宣布,由于在中期临床研究中服用Lotiglipron药的患者转氨酶升高,公司将停止开发其尚处于临床试验阶段的肥胖症和糖尿病药物Lotiglipron,将把重点放在另一种口服减肥药物Danuglipron上,该药物正在进行二期临床试验。
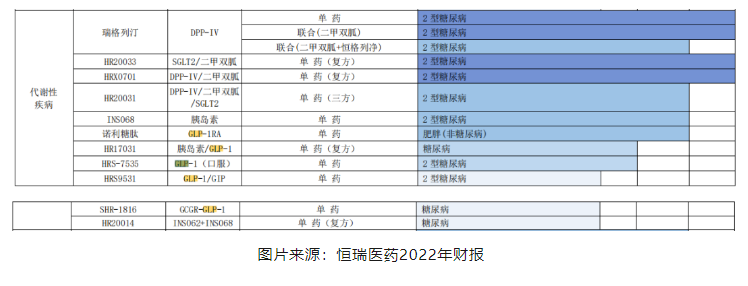
5
恒瑞公布2款GLP-1减肥药的最新数据,患者体重均明显下降
6
联邦制药:一款减肥药临床试验申请获药监局受理
6月16日,联邦制药公告:公司全资附属公司联邦生物科 技(珠海横琴)有限公司自主研发的 1 类创新药 UBT251 注射液关于成人 2 型糖尿病、 体重管理和非酒精性脂肪肝/非酒精性脂肪肝炎适应症的临床试验注册申请获得中国 国家药品监督管理局受理及缴费通知书。 临床前多种动物模型研究结果显示, UBT251 显著降低血糖和体重,改善肝脏脂肪变性和纤维化,模型动物体内治疗效果 优于已上市的 GLP-1 受体单靶点药物司美格鲁肽(Semaglutide)及 GLP-1/GIP 双靶点 药物替尔泊肽(Tirzepatide)。 7 Carmot融资3.7亿美元,以推进治疗肥胖症和糖尿病的研发
8 诺和诺德:口服司美格鲁肽新规格III期研究成功
3月24日,诺和诺德公布口服司美格鲁肽Rybelsus用于治疗2型糖尿病试验结果,数据显示血糖降低和体重减轻。
在IIIb期试验中,Novo将其25毫克和50毫克剂量的口服司美格鲁肽Rybelsus与目前最大批准剂量的14毫克版本进行了比较。该试验研究了在需要强化治疗的2型糖尿病患者中,当添加到稳定剂量的一到三种口服降糖药时,剂量如何比较。
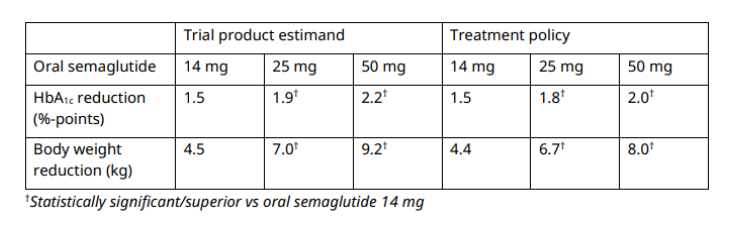
诺和诺德的口服司美格鲁肽目前被批准为Rvbelsus,服用3毫克,7毫克和14毫克剂量。FDA于去年7月批准了14和2毫克剂量的标签扩展,作为2019型糖尿病的一线治疗该更新是在1年首次批准之后进行的,当时该药物作为第一种进入2型糖尿病市场的GLP-<>药丸进入市场。至目前为止仍然是唯一的一种。
9
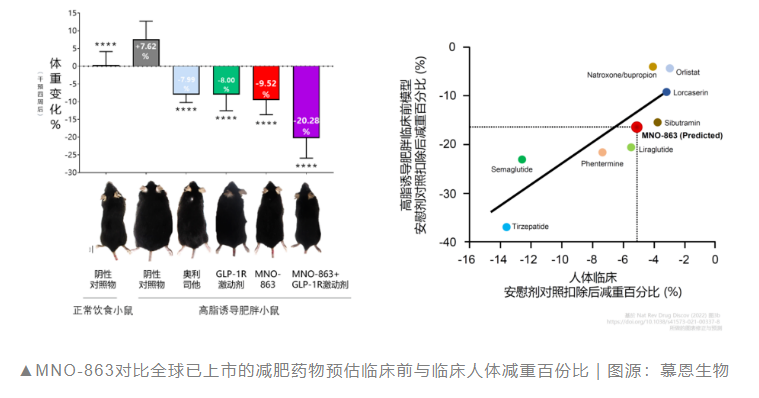
慕恩生物:减肥活菌新药在美国获批临床
3月10日,慕恩生物宣布,其自主研发的创新减肥活菌药物MNO-863临床1期试验已于近期正式获得美国FDA批准启动,拟用适应症为肥胖治疗(BMI≥30kg/m²)。
MNO-863通过脑肠轴热量摄取控制、提升能量燃烧、增强糖脂代谢及调节肠道菌群与代谢物组成等多靶向创新型作用机理,能够达到持续降低患者体重的目的,而且具备较好的安全性与多药物协同性。
目前,公司已有三项临床在研阶段药物与多个临床前药物管线研发,包括: 肿瘤、肥胖、二型糖尿病、非酒精性脂肪性肝炎等多项未满足医疗需求的治疗领域。
10
礼来:减肥药替尔泊肽在中国III期试验获得积极结果
2月6日,礼来宣布:其在研的减肥药物GIP和GLP-1双受体激动剂Tirzepatide(替尔泊肽)用于肥胖或超重成人患者的中国III期临床试验,取得积极结果,达到主要终点和所有关键次要终点。该试验中,Tirzepatide的总体安全性与先前试验报道相似,未发现新的安全性信号。
参考资料:
各公司官网
药融云数据库
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China