靶向蛋白降解技术(Targeted Protein Degradation,TPD) 是近几十年里新兴的一项蛋白质降解技术,其可以利用细胞自身的蛋白质清除机制(如溶酶体降解、蛋白酶体降解)来降解目标蛋白质。TPD的细分领域包括分子胶、PROTAC、LYTAC、AUTAC、AbTAC等,与传统的小分子抑制剂相比,TPD技术极大地扩展了可成药蛋白靶点的范围,并且在降解靶蛋白后可消除其所有功能直到蛋白重新合成。此外,TPD还可最大限度减少潜在的耐药性,并且可以循环利用,在催化剂量下起效,提高了药物的安全性,是目前制药界研究最为火热的领域之一。
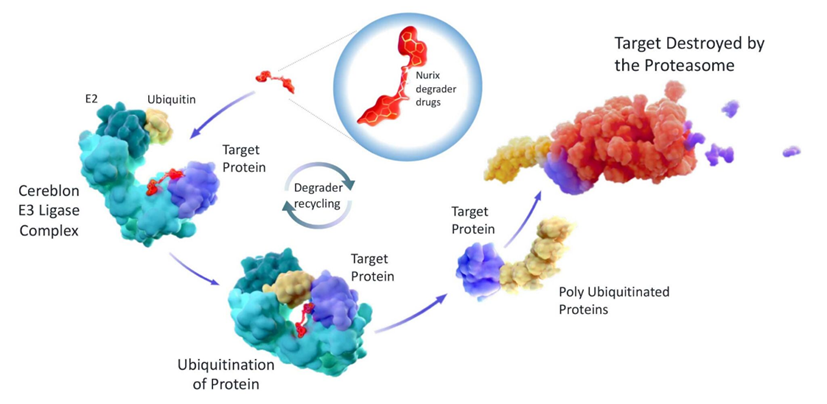
图1,TPD技术原理
目前FDA 已批准了3款分子胶药物,即沙利度胺(Contergan)、来那度胺 (Revlimid) 和泊马度胺 (Pomalyst),用于治疗多发性骨髓瘤、骨髓增生异常综合征等,其中来那度胺在2021年的销售额达到了128.9亿美元。除分子胶以外的其他细分技术领域则暂未有药物获得FDA批准,进度最快的为PROTAC分子,截至2023年8月25日,已有29个PROTAC分子推进到临床试验其中,I期21个,II期7个,III期1个(为ARV-471,正处于乳腺癌的临床III期试验,预计将于2024年8月完成主要试验)。
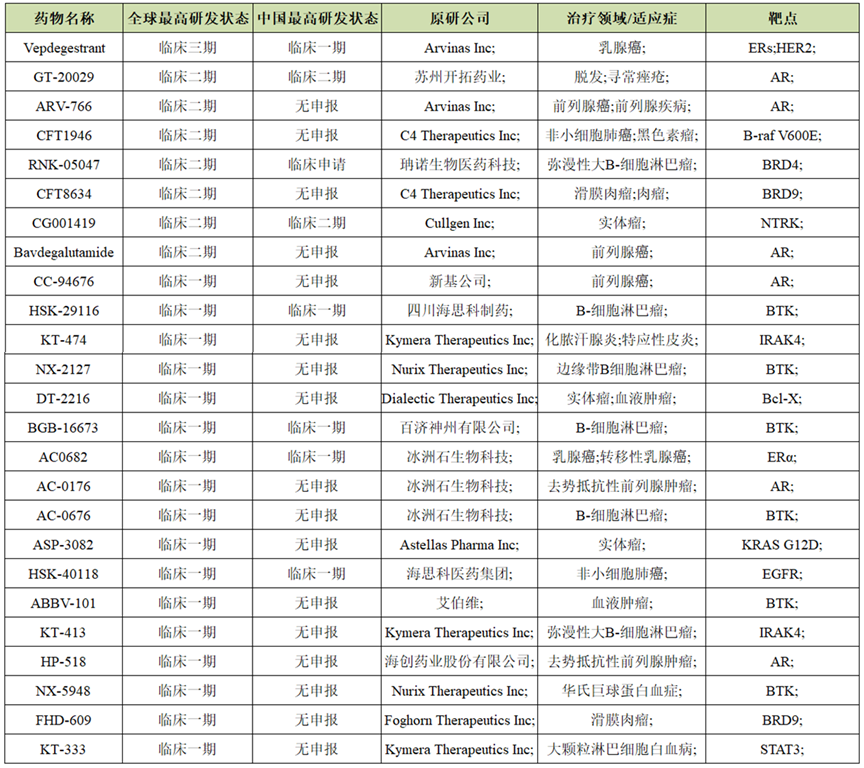
表1,PROTAC技术临床进展
TPD药物和传统小分子抑制剂虽均属于小分子药物范畴,但二者在一些特性上仍具有显著区别。理论上来说,TPD药物在以下十个方面区别于传统的小分子抑抑制剂:
TPD药物不依赖于配体与其靶标的特定作用模式(例如激动、部分激动、拮抗等),只要与靶标结合即可有效地招募泛素连接酶对POI进行降解。这使得开发TPD药物时的配体筛选工作变得更为简单,而不需要像传统小分子药物那样去关注小分子到底是激动还是拮抗。
以雄激素受体抑制剂为例,已上市的恩杂鲁胺等药物通过拮抗AR受体的活性来抑制肿瘤细胞增殖,但在某些突变的肿瘤细胞中(如H875Y、T878A等),靶向AR的小分子药物却由抑制活性变为了部分激动或完全激动活性,而这将促进肿瘤细胞生长。
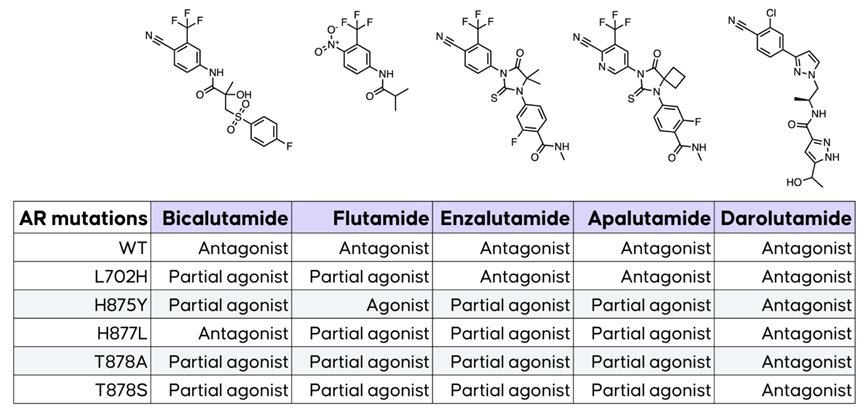
图2,AR抑制剂由于受体突变产生激动活性
而Arvinas公司开发的AR受体降解剂ARV-766则可以很好的克服上述AR抑制剂药物的缺陷,在发生配体结合域突变(T878/H875/L702)的患者中,有42%对药物产生了显著响应,即血液PSA水平降低了50%以上。
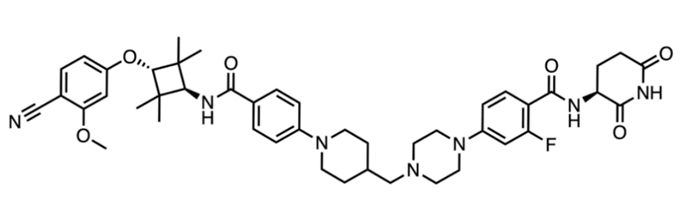
图3,ARV-766
部分小分子抑制剂在抑制靶点活性时会导致细胞表达更多的对应靶标蛋白以适应小分子抑制剂,这将导致小分子抑制剂疗效丧失,MDM2抑制剂;MDM2抑制剂在使用一段时间后,将引细胞内MDM2水平的上升。Kymera Therapeutics 开发的静脉注射的MDM2降解剂KT-253(结构未公开)在小鼠体内则可克服MDM2小分子抑制剂的缺陷,迅速降解MDM2蛋白并导致肿瘤细胞死亡,单剂量的KT-253治疗就可带来持久的肿瘤消退。
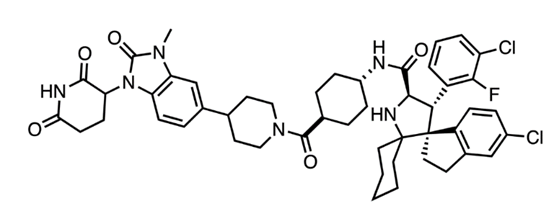
图4,KT-253专利中的代表分子
TPD药物可以完全消除目标蛋白,因此它们还可以影响POI的非催化功能,例如支架功能以及与其他蛋白的PPI作用,例如BRAF蛋白降解剂。BRAF是黑色素瘤中常见的突变癌基因,传统的小分子疗法如维莫非尼通过抑制突变BRAF的激酶活性来抑制突变BRAF所驱动的肿瘤生长。然而,目前已有的BRAF抑制剂却可能BRAF突变体后充当蛋白支架,招募野生型的RAF形成信号复合物,驱动肿瘤细胞生长,导致药物疗效降低,并可能激发耐药突变。
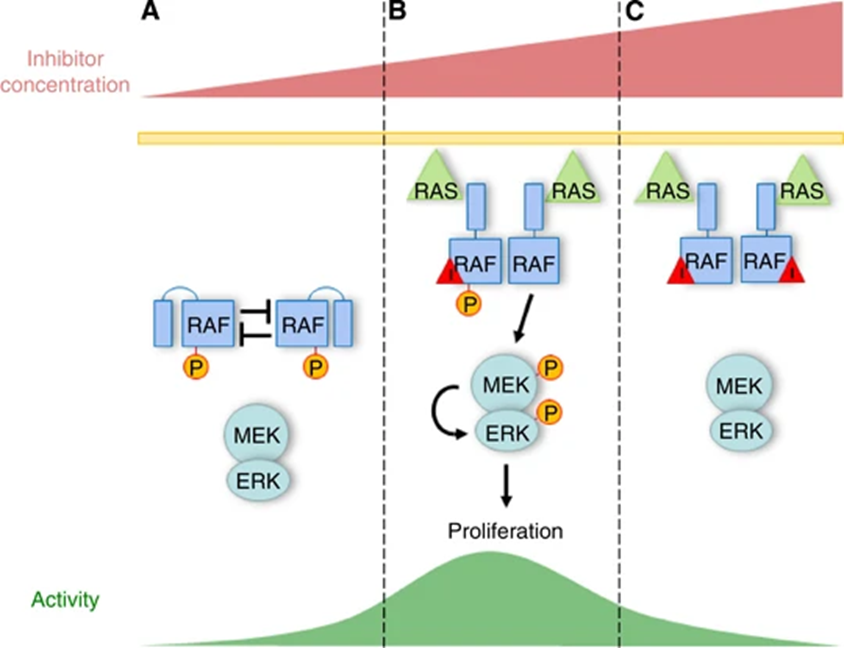
图5,BRAF抑制充当蛋白支架招募野生型RAF
CFT1946是C4 Therapeutics 开发的一种BRAF降解剂,它直接介导BRAF的降解,消除其支架功能,因此不会导致野生型RAF的激活,从而获得比小分子抑制剂更为持久的疗效。
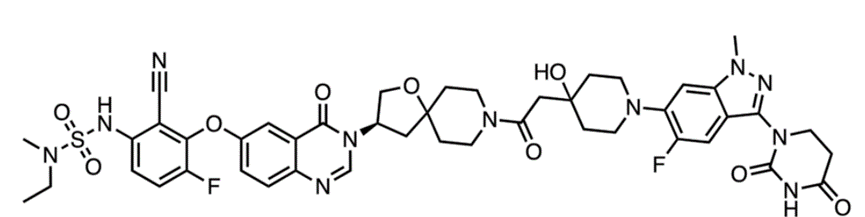
图6,CFT1946分子结构
TPD药物可以催化量对POI进行降解,在所结合的POI降解后TPD药物可再次结合另外的POI并诱导泛素化,因此降解剂和POI之间所需的结合亲和力理论上可以显着低于小分子抑制剂所需的亲和力,此外,POI浓度会随着时间推移而降低,药物疗效则可随时间积累,因此患者可用较低的日剂量来长期给药以产生更持久的疗效,增加了该类药物的安全性。
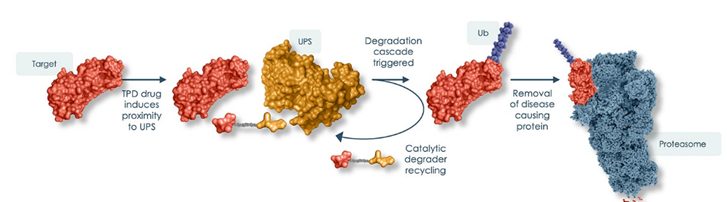
图7,TPD药物可循环利用
GSK公司开发的RIPK2 降解剂在小鼠体内可有效降解RIPK2蛋白,并显示出远超该PROTAC分子的PK数据预示的长效抗肿瘤作用,主要是因为RIPK2重新合成需要接近240小时,此外,将该PROTAC分子包裹在聚合物基质中时,在给药60天后仍能观察到RIPK2蛋白的降解。
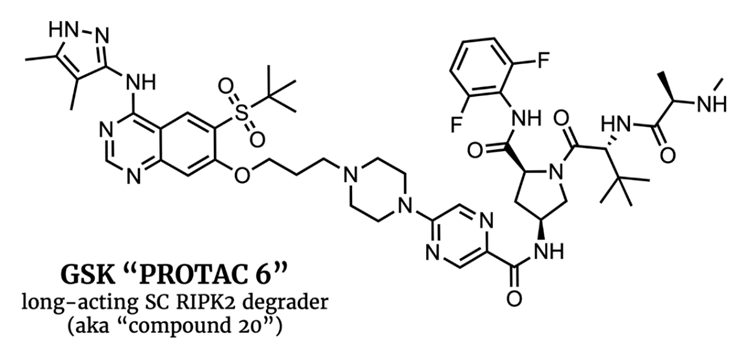
图8,GSK开发的超长效PROTAC
TPD药物只需结合POI即可触发蛋白的泛素化,因此POI配体不一定需要对靶标蛋白产生直接的功能影响,只要能够成功结合即可,因此在筛选POI配体时,抑制剂、拮抗剂或是变构调节剂等均可作为筛选目标。
C4 Therapeutics开发了一款基于变构调节剂的EGFR L858R降解剂,该PROTAC的POI配体仅结合L858R突变的EGFR,而豁免野生型EGFR蛋白,因野生型中不存在对应的变构结合位点。尽管该PROTAC分子量较大,但在小鼠的脑转移模型中仍能以50 mpk PO/BID产生疗效,并表现出优良的选择性。
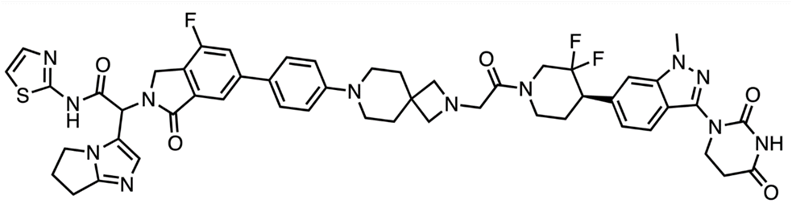
图9,EGFR L858R降解剂的可能结构
E3连接酶在组织中可能具有表达差异性,可为PROTAC分子提供POI配体之外的额外选择性,带来更佳的安全性。例如,E3连接酶在血小板是低表达的,而在肿瘤细胞中是正常或高表达的,基于此,Dialectic Therapeutics的研究者们便开发了组织选择性的Bcl-XL降解剂DT2216,在杀伤肿瘤细胞的同时,可以避免产生维奈克拉等BCL抑制剂的血小板减少副作用。
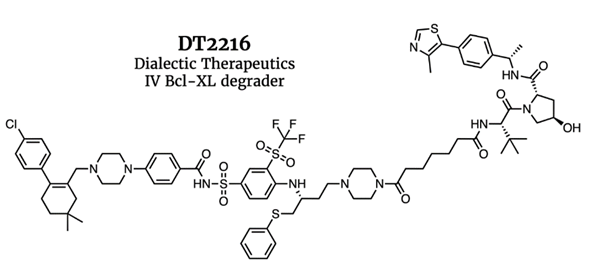
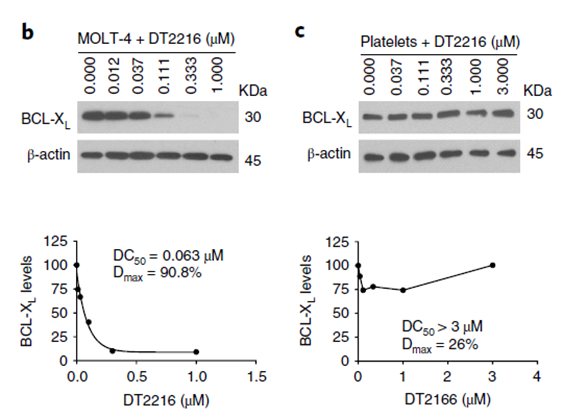
图10,DT2216不降解血小板中的BCL-XL
与传统的小分子抑制剂不同,TPD不需要药物饱和,其可在较低浓度下以催化机制发挥降解功能,并且药效可随着时间的推移而累积,这为治疗需要跨越血脑屏障的疾病(如多发性硬化症、脑转移瘤)提供了可能。例如,Nurix公司的第二代 BTK降解剂NX-5948据报道脑渗透率低于 5%,但其在小胶质细胞中仍具有抗肿瘤活性。
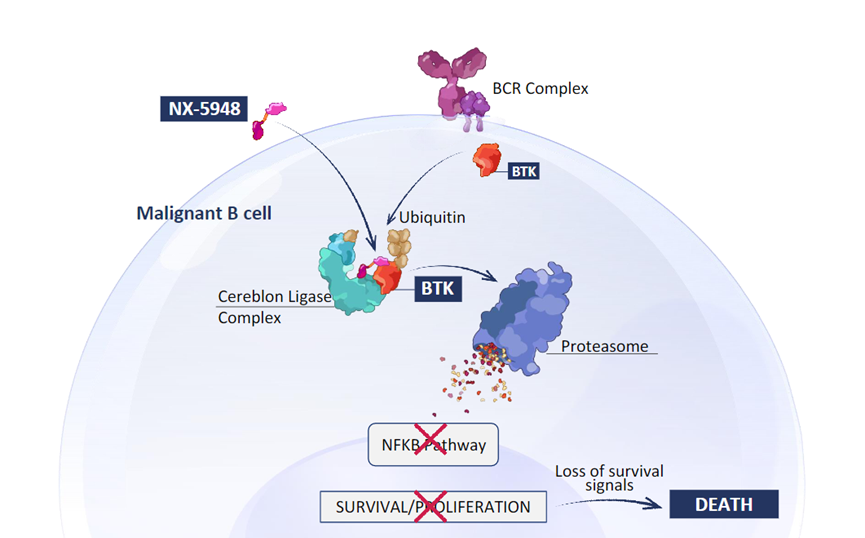
图11,NX-5948作用机制
在黑色素瘤中,突变型和野生型BRAF蛋白结构差异非常小,在使用小分子抑制剂时很有可能导致对野生型BRAF的脱靶抑制。而在形成BRAF蛋白-降解剂-E3连接酶的三元复合物时,突变型BRAF蛋白的复合物形成能力则远远高于野生型BRAF蛋白,这赋予了C4 Therapeutics的BRAF蛋白降解剂CFT1946针对野生型BRAF更高的选择性,在细胞实验中甚至未检测到对野生型BRAF的降解。
CDK4/6在细胞周期的G1/S的转换过程中起着关键的调控作用,在G1期,CDK4/6与细胞周期蛋白D (cyclin D)结合后被激活。西奈山伊坎医学院的Jian Jin在JACS报道了靶向CDK4/6的PROTAC分子MS28,该分子可以诱导泛素连接酶接近Cyclin D1和CDK4/6,并导致目前暂无小分子配体报道的Cyclin D1的优先降解,产生了更强的抗肿瘤增殖作用。
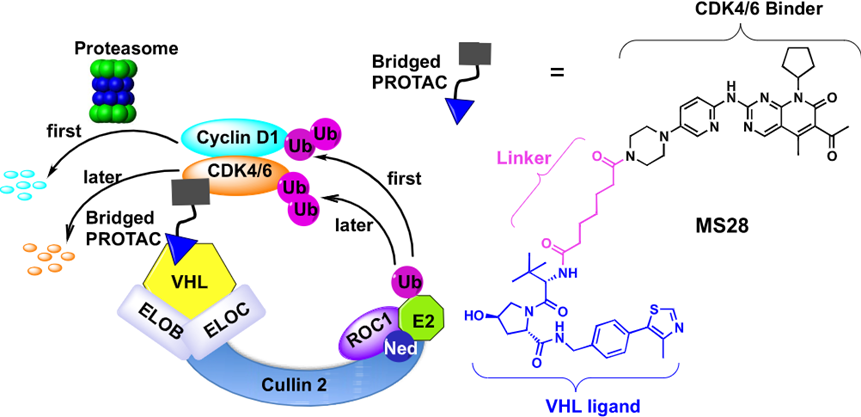
图12,CDK4/6 PROTAC导致了Cyclin D1蛋白的降解
随着临床前和临床研究的深入,TPD药物相对传统小分子抑制剂的差异化优势不断被发现发掘,也吸引了越来越多的研究者投入其中。就PROTAC技术来说,目前尚未有分子获批上市,但进度最快的已推进到临床III期,PROTAC分子的成药也只是时间问题。
TPD药物在成熟靶点上的应用已有充分研究,但目前似乎更多是发挥了锦上添花的作用,展望未来,TPD药物更需要对难成药靶点、难治性疾病雪中送炭,通过开发新连接酶、新POI配体以及脑渗透性的PROTAC等来充分发挥TPD技术的潜能,解决临床未满足需求,造福广大患者。
作者:LYQ
参考
Zhao, L., Zhao, J., Zhong, K. et al. Targeted protein degradation: mechanisms, strategies and application. Sig Transduct Target Ther 7, 113 (2022).
https://data.pharmacodia.com/drug#/main/drugInfo
https://drughunter.com/
Xiong Y, Zhong Y Jin J. et al. Bridged Proteolysis Targeting Chimera (PROTAC) Enables Degradation of Undruggable Targets. J Am Chem Soc. 2022 Dec 14;144(49):22622-22632.
Holderfield, M., Nagel, T. & Stuart, D. Mechanism and consequences of RAF kinase activation by small-molecule inhibitors. Br J Cancer 111, 640–645 (2014).
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China