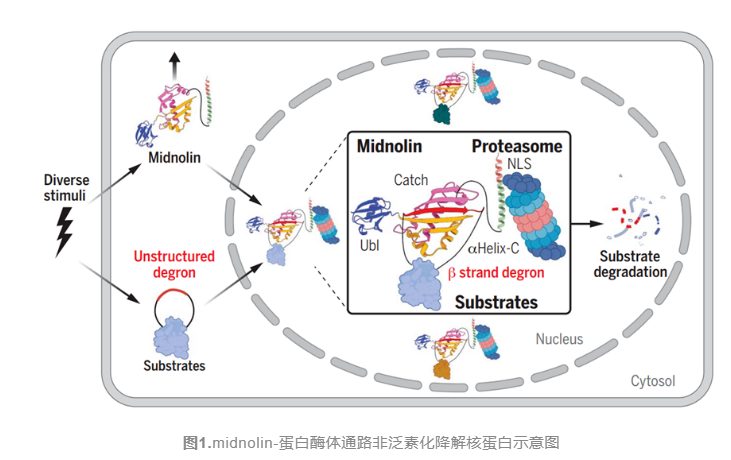
近期,美国哈佛医学院Michael E. Greenberg和Stephen J. Elledge团队发表在Science上的文章中报道了一种可诱导的、可定位在细胞核内的以促进非泛素化的转录调节因子的蛋白酶--midnolin蛋白,研究发现多种刺激诱导了midnolin,midnolin通过一个α螺旋与蛋白酶体结合,利用其Catch结构域与底物中可形成β链的区域结合,并利用泛素样结构域促进底物的破坏。因此,midnolin包含三个区域,midnolin的过表达通过一种不需要泛素化的机制导大量核蛋白靶向蛋白酶体降解(图1)。
在哺乳动物受到多种刺激后,可激活早期基因(IEG),IEG介导生长因子、神经元和免疫刺激的转录反应,编码 Fos、EGR 和 NR4A 家族的转录因子,促进迟发反应基因(LRG)的转表达,介导细胞对刺激作出响应。而LRG具有细胞反应特异性,在对首次刺激的适应性反应中至关重要,IEG mRNA在首次刺激后的几分钟内积累,一旦翻译,它们的蛋白质会迅速降解,从而出现蛋白质瞬时爆发式表达,促使细胞对各种刺激产生适当的反应。尽管IEG的转录机制得到了很好的研究,但IEG蛋白的降解机制仍然是个谜。
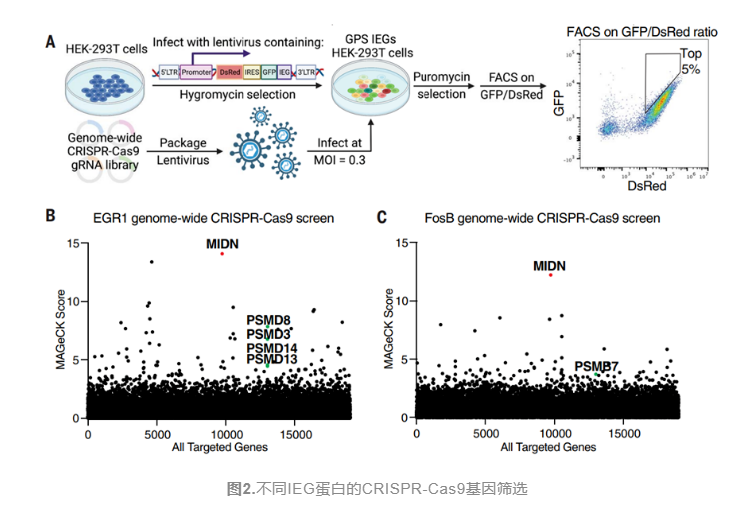
为了表征IEG蛋白的降解机制,研究人员通过全局蛋白质稳定性分析(GPS)系统来测定IEG蛋白质的稳定性,并进行全基因组CRISPR-Cas9筛选,以寻找那些调节IEG蛋白稳定性的基因(图2)。他们发现,midnolin蛋白是哺乳动物中一种未被充分表征的蛋白质,它的过表达促进c-Fos,FosB,EGR1和NR4A1等多种IEG蛋白的蛋白酶体降解,抑制蛋白酶体的活性而不是抑制泛素化酶的活性泛素化酶的活性可抑制IEG蛋白降解,表明IEG蛋白降解依赖于midnolin和蛋白酶体,而不是泛素化降解途径。
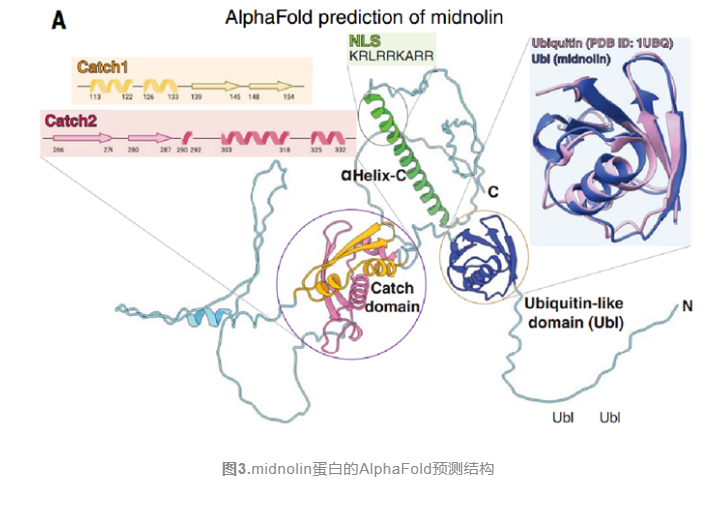
接着作者对midnolin与蛋白酶体和底物的相互作用机制进行了探究,研究人员用AlphaFold预测midnolin蛋白质的结构,预测显示midnolin由三个明确的区域构成(图3),研究发现此外,midnolin不含E3泛素连接酶的特征RING或HECT结构域,或在蛋白酶体合成因子(如Rad23)中发现的泛素结合结构域,相反其N端含有泛素样结构域,C末端含有α螺旋,泛素样结构域Ubl和C末端α螺旋是midnolin与蛋白酶体相互作用所必需的,且C末端螺旋包含核定位序列(NLS),帮助midnolin定位在细胞核内。此外,midnolin包含两个不连续区域,每个区域由两个反平行β链和两到三个α螺旋组成,实验表明该结构域对midnolin与底物相互作用至关重要,作者命名为Catch结构域。midnolin蛋白使用其Catch结构域与底物中的非结构化区域相互作用,这些非结构化区域有可能在结合midnolin时形成β链,从而起到midnolin 蛋白的降解作用。
最后,研究人员表征midnolin与多种底物均能结合并诱导降解的机制,他们使用AlphaFold预测了midnolin与一系列底物的复合物结构,发现IRF4蛋白的非结构化区域在与midnolin Catch结构域结合后形成β链,从而形成五链反平行β片层的三级结构,这种β链捕获机制在约40%的预测中被观察到,并通过实验引入β链缺失得到证实。研究人员发现IEG蛋白底物的β链内富含疏水性氨基酸,一旦被midnolin结合,这些疏水性β链残基将被埋藏在Catch结构域内,从而实现了降解底物选择的一般机制。因此,midnolin包含的三个保守结构域之间协同作用,将大量核蛋白直接靶向蛋白酶体,以进行泛素化非依赖性降解(图4)。
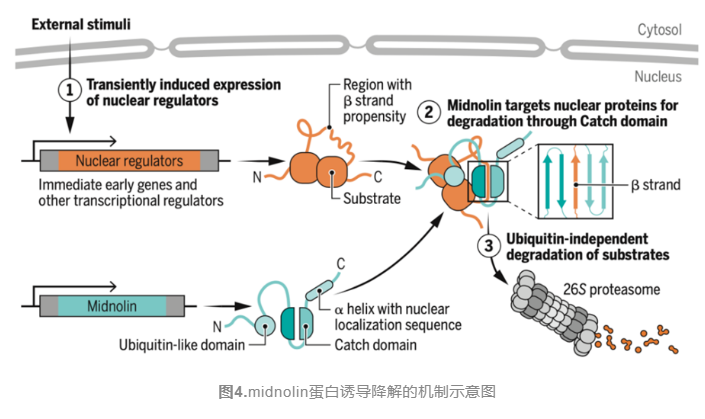
总的来说,Michael E. Greenberg和Stephen J. Elledge团队发现了一种新的、通用的、与泛素化无关的降解蛋白质的机—midnolin-蛋白酶体途径。在底物中,midnolin蛋白识别相对简并的两亲性区域,有可能形成β链,因此,midnolin可能是许多蛋白质的常见结构成分。midnolin-蛋白酶体途径如何通过不同细胞类型的各种线索调控以控制转录程序将是未来探索的重要课题。更重要的是,这条不依赖于泛素的新型蛋白降解系统,非常简洁,未来或许可以基于midnolin-蛋白酶体系统的调节机制,开发新型靶向蛋白降解类药物,用于神经或精神疾病,以及癌症的治疗。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China