3 月 31 日,国家药监局药品审评中心(CDE)网站官网显示,永泰生物申报的 1 类新药爱可仑赛注射液申报上市,用于原发性肝细胞癌根治术后高复发风险的部分人群「免疫特性人群:患者需满足以下标准中的至少两项:无微血管侵犯;术后中性粒细胞和淋巴细胞比值(NLR)<3;术后血小板和淋巴细胞比值(PLR)<110」术后预防复发治疗。
截图来源:CDE 官网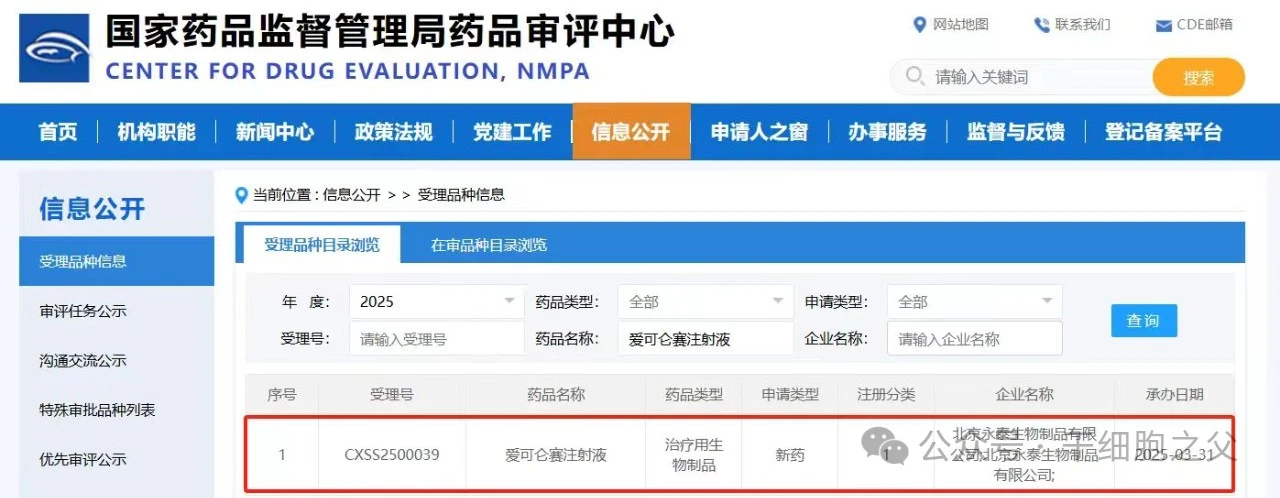
爱可仑赛属CIK细胞(细胞因子诱导的杀伤细胞,又称NK细胞样T淋巴细胞)治疗产品,是由患者自体外周血中的单核细胞经使用专利方法活化、扩增培育而成的混合T淋巴细胞。产品以CD8+杀伤性T细胞(表面标记为CD3分子)为主要活性成分。
其作用机制是通过在体外激活并扩增来源于患者自身具有抗肿瘤活性的T细胞,输注给患者自身,以预防肿瘤的复发。 多个临床研究显示,EAL对肝癌、胃癌、肺癌等多种肿瘤具有功效。
该药是国内首款获准进入 II 期临床试验的细胞免疫治疗产品,于 2015 年提交 IND 申请, 并获得 CDE 受理,2017 年 10 月获得 IND 批件,2018 年 9 月入组第一例 II 期临床试验患者,该试验共纳入 430 例患者。
目前EAL®公开的临床数据并不多,但仍有部分数据由研究者发表于SCI期刊。中国人民解放军总医院张国等人收集的临床应用数据显示,在84名IIIc至IV期胃癌患者中,有42名患者接受六次以上的EAL注射及42名患者进行同期对照,EAL®治疗组的总生存期(OS)为27.0个月,而对照组为13.9个月。EAL免疫治疗降低了42.7%的死亡风险。
2023 年 9 月,该疗法被纳入突破性治疗品种,CDE 同意其可基于 II 期临床试验的中期结果或最终结果提交爱可仑赛用于预防肝癌术后复发的上市申请,前提为 II 期研究结果具有统计学意义。目前其 II 期研究结果尚未披露。2025 年 3 月,该适应症被纳入优先审评。
值得一提的是,肝癌只是EAL®的其中一个适应症,还在加速EAL®扩大适应症的研究工作。多个临床研究显示,EAL®对治疗肝癌外的多种肿瘤具有功效。因此,待EAL®获批上市后,后续计划将其临床适应症扩展至胃癌、肺癌、结直肠癌、脑胶质瘤等疾病。
目前国内尚无获批的用于实体瘤的细胞治疗产品,EAL®有望成为我国第一个获批上市的用于治疗实体瘤的个体化免疫细胞药物,将改变肝癌术后复发无有效治疗药物的现状,同时也将面对巨大的市场需求,上市后,EAL®的市场空间有望迅速打开,填补国内实体瘤细胞免疫治疗领域的空白。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China