2024年4月16日,美国纳斯达克上市公司Cullinan Therapeutics宣布将公司的研发管线扩展至自身免疫性疾病领域,并将公司全称从Cullinan Oncology更名为Cullinan Therapeutics,自免赛道可谓是“众星云集”,在过去的几个月里,CRISPR Therapeutics、TG Therapeutics、Atara Biotherapeutics、Mustang Bio和Caribou Biosciences都宣布进军自身免疫性疾病领域。从药融云数据库获悉,成立于2017年的Cullinan Therapeutics(以下简称Cullinan)总部位于美国马萨诸塞州Cambridge,成立之初公司利用中心辐射式模式(hub-and-spoke)自研或授权引进产品管线,这种模式既可以自己推进研发管线,也可以通过与第三方的交易吸引潜在合作伙伴,提高运营效率、降低运营风险并增加资产的灵活性。(关联阅读:Hub-and-spoke:创新药开发/投资新模式)

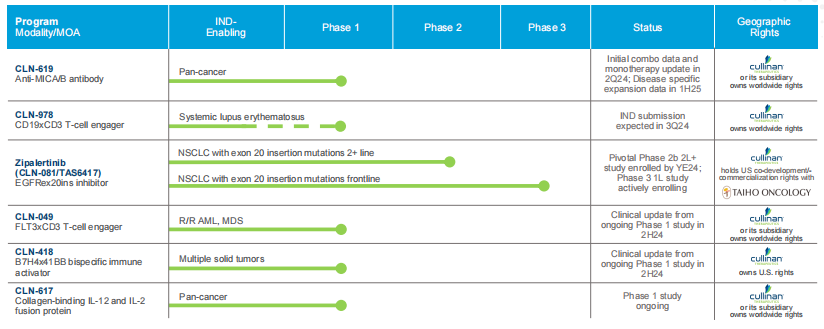
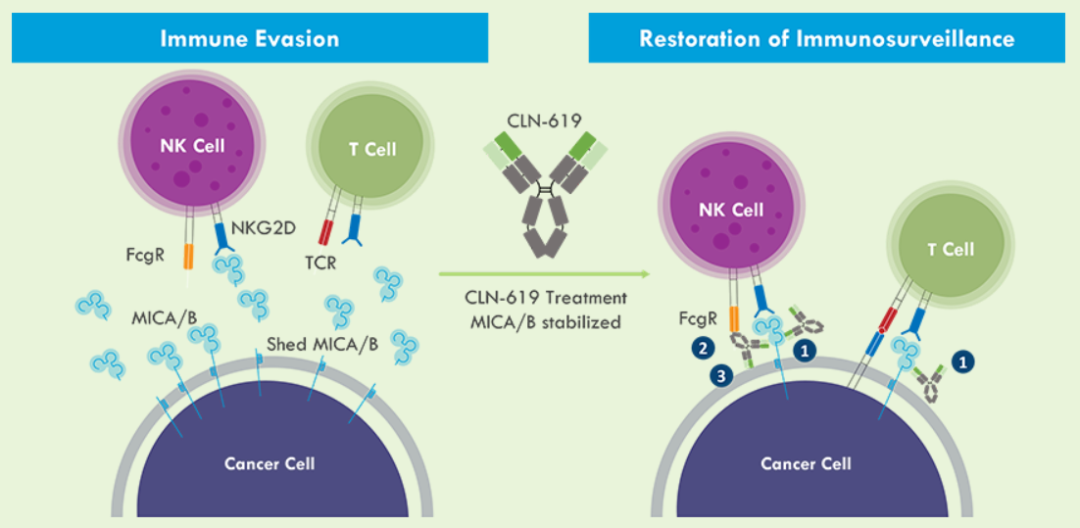
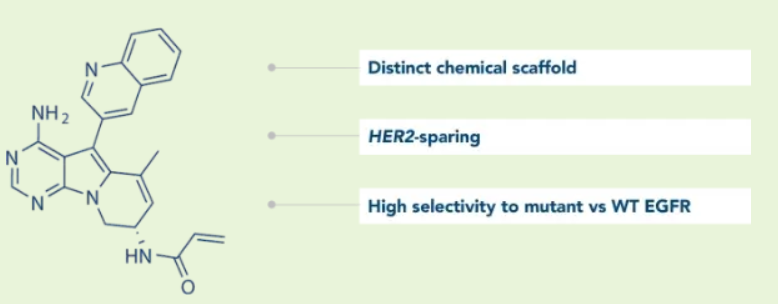
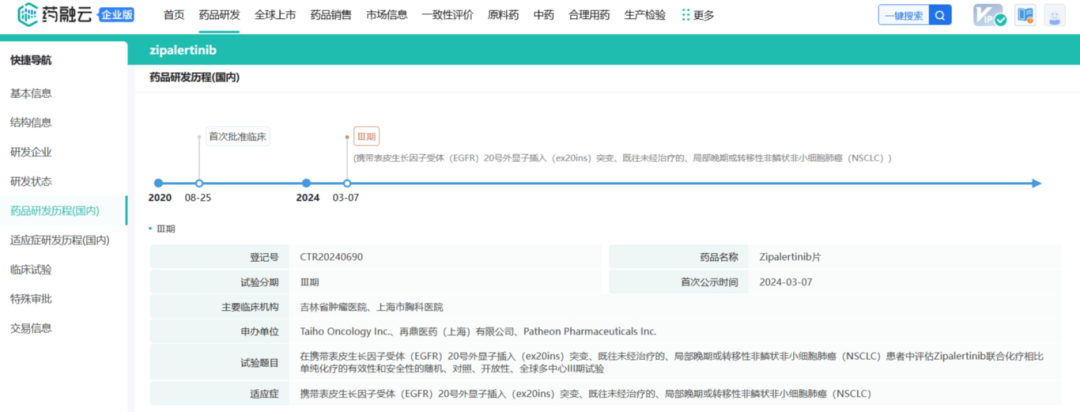
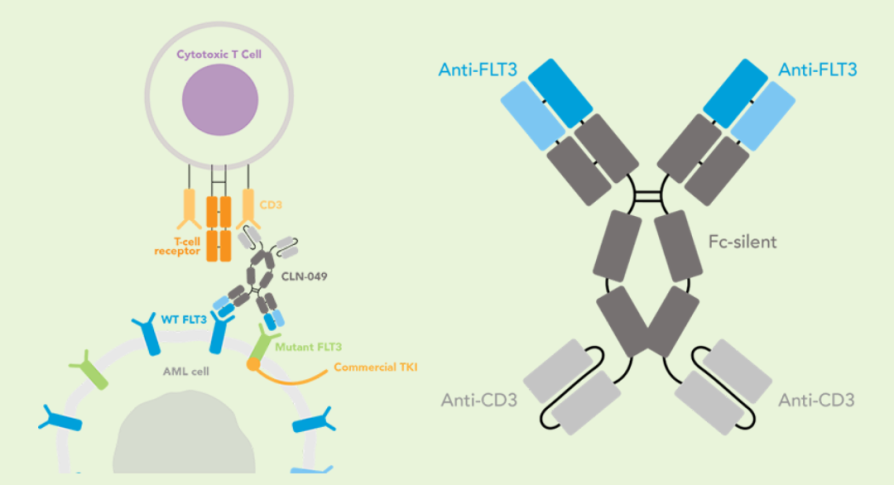
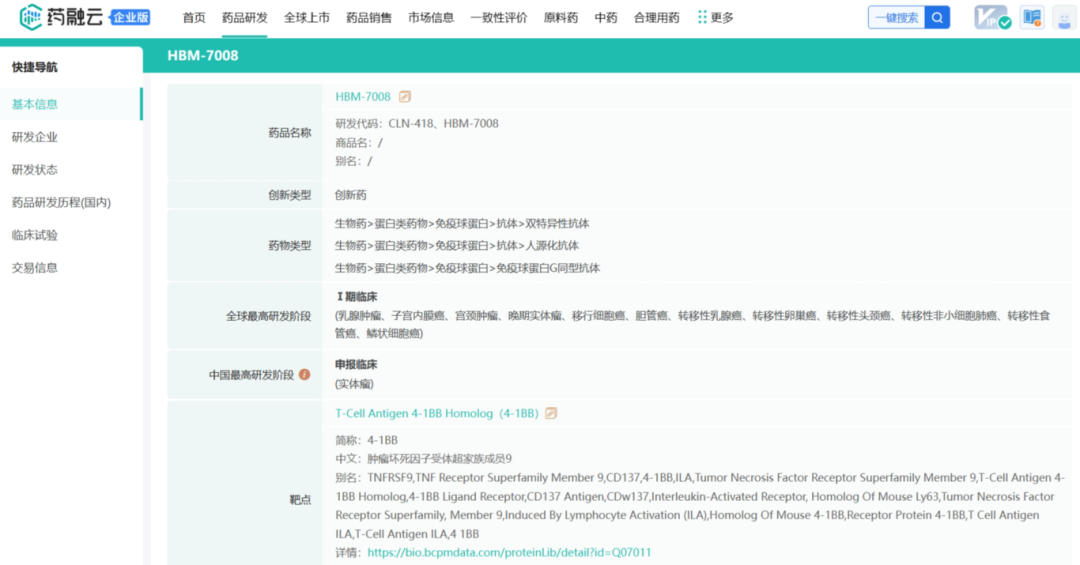
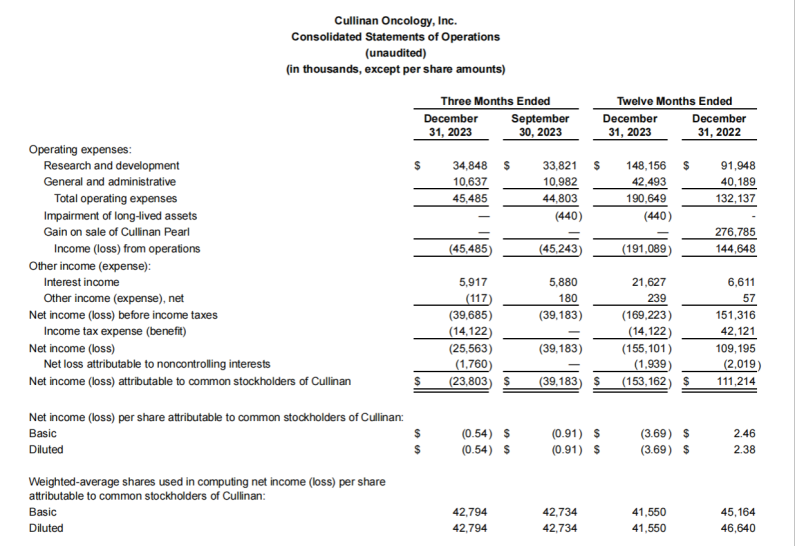
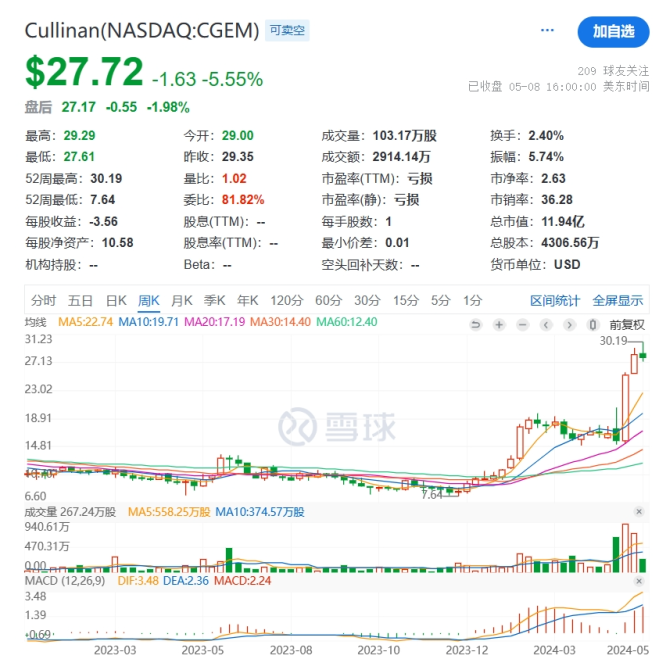
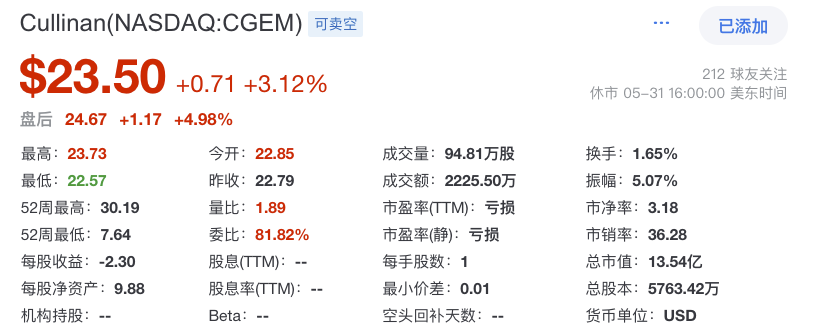
战略调整之前Cullinan是一家专注于开发癌症疗法的生物制药公司,此次战略调整之后,公司建立了多元化的临床研发管线,通过确定高影响力的靶点,然后抑制疾病关键驱动因素的分子或利用免疫系统来消除肿瘤和自身免疫性疾病中的患病细胞。与此同时,Cullinan还公布了双特异性T细胞接合抗体构建体CLN-978在治疗系统性红斑狼疮等自身免疫性疾病方面的潜力,且公司准备近几个月就提交新适应症的IND。 药融云数据库:融资信息 2024年4月,Cullinan还宣布完成了2.8亿美元的融资,以支持公司的战略变革。此次私募融资由新老投资者参与,包括Adage Capital Partners LP、Avidity Partners、Blue Owl Healthcare Opportunities、Boxer Capital、Braidwell LP、BVF Partners LP、Foresite Capital Management、Invus、OrbiMed、Paradigm BioCapital、Rock Springs Capital、RTW Investments、Surveyor Capital(Citadel旗下公司)和Venrock Healthcare Capital Partners。 Cullinan的研发管线主要针对肿瘤学和免疫学领域,各管线都有成为best-in-class或first-in-class的潜力。以下是各管线具体进展情况: CLN-619是一种潜在的first-in-class人源化IgG1单克隆抗体,可与应激诱导配体MICA和MICB结合,人类肿瘤经常表达激活的NKG2D受体的MICA和MICB配体,但是MICA /B的蛋白水解脱落代表了许多人类癌症中重要的免疫逃逸机制。CLN-619通过恢复肿瘤细胞表面的MICA/B表达来恢复NKG2D介导的免疫激活,并通过诱导抗体依赖性细胞毒性(ADCC)和抗体依赖性细胞吞噬作用(ADCP)发挥作用,通过多种免疫介导的机制共同促进抗肿瘤活性。 目前CLN-619正在进行一项临床试验1期研究,在试验中作为单一疗法和与帕博利珠单抗联合使用。2024年4月底Cullinan宣布CLN-619在晚期实体瘤患者中进行的临床试验1期研究数据将于六月初在2024年美国临床肿瘤学会(ASCO)年会上公布,数据包括CLN-619联合检查点抑制剂帕博利珠单抗的剂量递增队列的首次结果,以及晚期实体瘤患者单药治疗剂量递增队列的最新结果。预计2025年上半年取得疾病特异性扩增数据。 2024年3月1日,Cullinan宣布FDA已经批准了CLN-619用于复发/难治性多发性骨髓瘤的IND申请,CLN-619将在复发/难治性多发性骨髓瘤患者中进行临床试验1期研究。 CLN-978是一种半衰期延长的新型CD19xCD3双特异性T细胞接合抗体构建体,其含有两个单链可变片段,一个以非常高的亲和力与恶性细胞上的CD19靶标结合,另一个与T细胞上的CD3结合,虽然CLN-978类似于规范的BITE(双特异性T细胞衔接器),但它也含有与人血清白蛋白(HSA)结合的单域抗体(VHH)。CLN-978与CD19的高亲和力结合使得针对表达非常低水平的CD19的肿瘤细胞的效力增加,HSA结合结构域增加了CLN-978的血清半衰期,并且通过皮下给药,允许更多的患者友好剂量和潜在的降低毒性。 CLN-978也成为一系列B细胞恶性肿瘤患者的高效治疗选择,包括那些由于CD19靶表达减少而在其他CD19导向治疗中复发的患者。目前其正被评估为B-NHL(B细胞非霍奇金淋巴瘤)的新型治疗方法,并在整个B细胞介导的疾病谱中具有潜在的适用性。预计在2024年第三季度提交系统性红斑狼疮(SLE)的IND。CD19是自身免疫性疾病的最佳靶点,在此机制基础上的CLN-978有可能为系统性红斑狼疮等自身免疫性疾病提供一种方便的治疗选择。 在美国,大约16%的非小细胞肺癌(NSCLC)病例携带上皮生长因子受体(EGFR)突变,其中外显子20插入(EGFRex20ins)占这些突变的12%。EGFRex20ins突变患者的预后比EGFR突变更常见的患者预后更差。根据国家癌症中心统计,肺癌位居中国恶性肿瘤发病率及死亡率首位,2015年中国新发肺癌患者中85%是非小细胞肺癌(NSCLC)。在NSCLC患者中,又有35%的患者由EGFR基因突变引起。而亚洲人群的EGFR基因突变率显著高于欧美人种,普遍超过40%,如中国的NSCLC患者EGFR基因突变率就约为40%。目前针对NSCLC中EGFRex20ins突变的更安全、更有效的疗法仍存在大量市场。 Zipalertinib是一种新型的、不可逆的口服EGFR抑制剂,具有广谱EGFR突变活性(包括EGFR 20外显子插入突变),与野生型EGFR相比,对EGFR 20外显子插入突变型的抑制具有高选择性,这表明与目前批准或正在开发的大多数EGFR酪氨酸激酶抑制剂(TKI)相比,zipalertinib可能具有更宽的临床治疗窗口。2022年1月,Cullinan Therapeutics宣布Zipalertinib获得FDA认定的突破性疗法称号。 Cullinan目前正在与Taiho Pharmaceuticals合作开发Zipalertinib。在临床试验1/2a期研究中, Zipalertinib在 大量预处理的患者中显示出良好的疗效,包括接受EGFR酪氨酸激酶抑制剂治疗的患者,具有良好的安全性和耐受性。2023年8月两公司宣布启动了一项全球临床试验3期研究(REZILIENT3 试验),该试验旨在评估Zipalertinib和化疗的联合治疗,作为既往未经治疗的局部晚期或转移性NSCLC成人患者的潜在一线治疗。与此同时,一项关键的临床试验2b期研究(REZILIENT2试验)正在评估Zipalertinib在既往接受过全身治疗后出现进展的EGFRex20ins NSCLC患者,以及先前使用目前批准的EGFRex20ins NSCLC药物治疗后进展的单独患者队列。 2020年,再鼎医药从Cullinan获得在大中华区独家开发和商业化Zipalertinib的权利,当前在国内的研究进行到临床试验3期。 CLN-049是一种靶向CD3和FLT3的T细胞激活双特异性抗体。FLT3是AML(急性髓系白血病)免疫治疗的一个有前途的靶点,因为FLT3在白血病干细胞和AML原始细胞上过表达,而在健康细胞和组织中仅最低限度表达,这可能会提高FLT3靶向治疗药物的治疗指数、反应率和耐久性。在临床前,CLN-049以类似的高亲和力识别突变型和野生型FLT3,无论FLT3突变状态如何,都有可能治疗AML,而靶向FLT3突变形式的酪氨酸激酶抑制剂只能治疗20~30%的AML病例。与其他针对AML开发的双特异性抗体疗法相比,CLN-049具有提高治疗指数的潜力,其效力在很大程度上与FLT3表达水平或突变状态无关,允许根据疗效和安全性进行一致的剂量。 CLN-049目前针对复发/难治性AML和高危骨髓增生异常综合征(MDS)患者的研究进行到临床试验1期。2022年底,Cullinan完成了试验的单次剂量递增部分,正过渡到多次剂量递增部分。此外,CLN-049的给药从静脉注射改为皮下注射,多剂量递增研究的招募仍在继续。 CLN-418是一种针对肿瘤相关抗原B7H4x4-1BB的双特异性抗体,由于其高度依赖以肿瘤相关抗原为介导,与T细胞活化进行交叉链接,因此在T细胞共刺激及抑制肿瘤生长方面的功效显著,同时提高安全性。该管线基于和铂医药创新的HBICE平台开发,是目前全球针对这两个靶点的唯一双特异性抗体。2023年2月与和铂医药签订授权和合作协议,Cullinan获得在美国(包括哥伦比亚特区和波多黎各)开发及商业化CLN-418(和铂医药产品代号为HBM7008)的独家许可权。 药融云数据库:药品信息 B7H4和4-1BB都是备受关注的靶点,并且都经过临床评估,它们独特的生物学和作用机制为将它们组合为双特异性抗体提供了强有力的理由。B7H4是一种有吸引力的肿瘤相关抗原(TAA),在多种肿瘤类型(包括三阴性乳腺癌、卵巢癌和肺癌)上高表达,在正常组织中的表达较低。4-1BB是T细胞和NK细胞结合的关键共刺激分子,虽经过生物学验证,但肝毒性等安全问题仍然存在。在依赖于B7H4表达的肿瘤微环境中条件激活4-1BB提供了一种利用这两个靶标潜力的新方法。CLN-418具有严格的TAA交联依赖性T细胞活化,可潜在地转化为更好的安全性和更有利的治疗窗口。 目前正在进行的临床试验1期研究,这是一项在美国和澳大利亚研究中心进行的开放标签、多中心研究,旨在评估静脉注射CLN-418在晚期实体瘤患者中的安全性、耐受性、药代动力学和抗肿瘤活性。预计2024年下半年提供临床试验1期研究的更新数据。 CLN-617是一种潜在的first-in-class细胞因子疗法,由两种有效且协同的抗肿瘤细胞因子IL-2和IL-12组成。该分子用于瘤内注射,并采用胶原结合和大小增强结构域,旨在将CLN-617分子保留在肿瘤内,从而提高疗效并降低毒性。虽然CLN-617被注射并保留在肿瘤局部,但它指导广泛的免疫反应,不仅有助于根除注射的肿瘤,还可以帮助攻击远处的肿瘤部位。临床前研究还表明,当CLN-617与检查点抑制剂治疗联合使用时,有可能提高疗效。 2023年3月Cullinan宣布CLN-617的IND获得FDA批准。Cullinan启动了一项首次人体、多中心、开放标签的临床试验1期研究,以评估CLN-617单独使用和与帕博利珠单抗联合治疗晚期实体瘤患者的安全性和有效性。2023年12月,Cullinan宣布临床试验1期研究的首位患者进行了给药。 2023年度Cullinan的研发费用为1.482亿美元,上年同期为9190万美元。与上年相比,2023年度研发费用的增加主要是由于与2023年许可CLN-418相关的一次性预付款,由于员工人数增加和业务扩张以支持公司的研发活动而导致的人员成本增加,以及股权补偿成本的增加,部分被临床前成本的降低所抵消。一般和行政费用为4250万美元,上年同期为4020万美元。一般与行政费用的增加主要是由于人事成本的增加、股权薪酬成本的增加,以及支持公司扩大业务的占用率和其他成本的增加,部分被与2022年出售Cullinan Pearl(2022年Cullinan与Taiho Pharmaceutical宣布共同开发和商业化CLN-081的战略合作,根据协议,Taiho Pharmaceutical收购Cullinan的子公司Cullinan Pearl)相关的一次性成本所抵消,该成本在2023年没有再次发生,以及法律和其他专业服务费用的降低。 2023年净亏损(不计非控制性权益)为1.551亿美元,而2022年净收入为1.092亿美元。2023年的净亏损和2022年的净收入包括上述项目,分别被2023年和2022年的利息收入2160万美元和660万美元部分抵消。以及1410万美元的所得税收益,该收益与2022年的拨备返还调整和2023年的联邦研发税收抵免有关,这些税收抵免可结转至2022年,并在2023年记录。截至2023年12月31日,Cullinan的现金和现金等价物为4.683亿美元,加上2024年4月份完成的2.8亿美元融资,预计将维持公司运营到2028年。截至2024年5月8日,公司市值11.94亿美元。 截至2024年5月31日,公司市值13.54亿美元(约合98.054亿人民币)。美股23.50美元。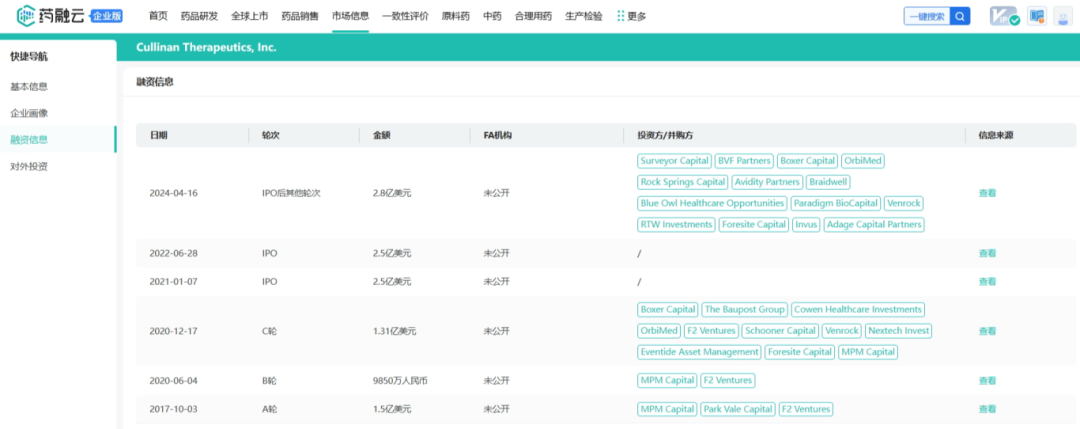
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China