随着医药领域对抗体疗法研究的不断深入,双特异性抗体在临床已经显示出强大的疗效,但是面对日益复杂的疾病,当前获批的疗法似乎已经无法满足。三特异性抗体显示出对多种疾病的潜力和更高的特异性,许多头部企业通过合作收购等纷纷入局该领域。2024年3月6日,吉利德和MerusN.V.宣布达成一项合作协议,两公司利用MerusN.V.专有的Triclonics平台以及吉利德的肿瘤学专业知识来研究和开发靶向新型肿瘤相关抗原(TAA)的三特异性抗体。从药融云数据库获悉,Merus N.V.(以下简称Merus)创立于2003年,总部位于荷兰,是一家临床阶段的肿瘤学公司,拥有开发创新全人源双特异性和三特异性抗体的治疗药物技术平台Multiclonics(包括Biclonics和Triclonics平台)。

Merus的Multiclonics保留了天然人全长免疫球蛋白G(lgG)抗体的品质,包括稳定性、长半衰期和低免疫原性。其中,Biclonics与许多其他双特异性抗体形式不同,不需要接头或修饰来强制轻链和重链的正确配对,也不需要融合蛋白来增加功能;在Biclonics的基础上,Merus进一步构建了Triclonics平台,通过该平台产生的抗体能够同时结合三个靶点,具有启用肿瘤细胞杀伤活性和/或调节免疫系统以促进更强大和特异性的抗肿瘤免疫反应的潜力。
然而吉利德并不是首个看中Merus平台的企业,早在2016年底,Merus就与Incyte达成了一项全球战略合作,两家企业主要利用Merus专有的Biclonics技术平台研究、发现和开发双特异性抗体。2021年1月,Merus和礼来旗下的Loxo oncology宣布了一项研究合作和独家许可协议,两企业利用Merus的Biclonics平台,开发多达三款靶向CD3的双特异性抗体疗法。除此之外,与Merus展开深度合作的还有中国的先声药业、贝达医药,日本的小野制药等。截止2024年6月6日,Merus公司市值约为36亿美元。截止发稿前为35.73亿美元,约合260亿人民币。
现有研发管线主打双抗
Merus当前的研发管线主要是双特异性抗体,管线具体进展情况如下:
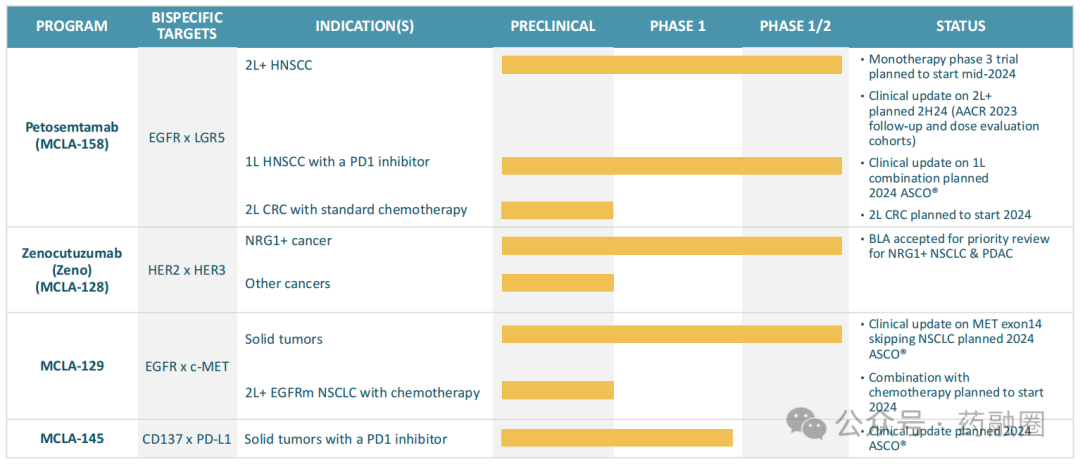
1. Petosemtamab (MCLA-158)
Petosemtamab是一种可结合EGFR(表皮生长因子受体)和LGR5(富含亮氨酸重复序列的G蛋白偶联受体5)的双特异性抗体,与传统的单一靶向药物相比,Petosemtamab能够在肿瘤细胞表面同时结合EGFR与LGR5两种受体,从而阻断它们的功能,因此抑制肿瘤生长和扩散的范围更广,能力更强。目前正在研究用于治疗晚期头颈鳞状细胞癌。EGFR是一种跨膜蛋白,在人体各种组织细胞的生长、增殖和分化等过程中发挥着重要作用,但是其过度活化时,会导致细胞异常增殖,进而形成肿瘤,许多肿瘤的形成都与EGFR的过度活化有关,如胃癌、乳腺癌、头颈癌等。LGR5是一种表达于多种正常细胞和肿瘤细胞膜的膜蛋白,也是癌症治疗的重要靶点,在癌症干细胞中的高表达使得这些细胞具有更强的增殖和转移能力。
Petosemtamab主要有三种作用机制,包括(1)阻断EGFR配体并抑制信号传导;(2)通过LGR5/E3连接酶结合LGR5使癌细胞中的EGFR降解;(3)增强抗体依赖性的细胞介导的细胞毒作用(ADCC)和抗体依赖性的细胞吞噬作用(ADCP)活性,从而促进与免疫细胞的相互作用。
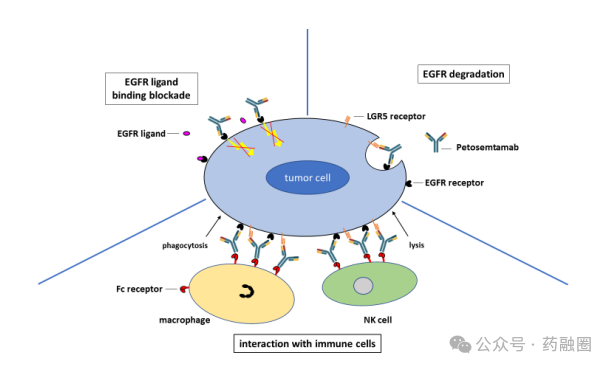
在临床前模型中,Petosemtamab在多个体内模型中表现出优秀的抑制肿瘤消退或生长作用且不会干扰健康干细胞的功能,有效的同时发生不良反应的概率较低,有着令人放心的安全性。2024年5月13日,Merus宣布FDA授予Petosemtamab突破性疗法认定(BTD),用于治疗复发或转移性头颈鳞状细胞癌(HNSCC)患者,其疾病使用铂类化疗和PD-1/PD-L1抗体治疗后出现进展。在此之前,Petosemtamab已获得快速通道资格认定,用于治疗在接受铂类化疗和抗PD-1抗体治疗后疾病进展的复发性或转移性HNSCC患者。Petosemtamab目前正在进行临床试验1/2期开放标签、多中心研究,该研究主要评估petosemtamab单药治疗晚期实体瘤患者,包括既往接受过治疗(复发性或转移性)的HNSCC,计划在2024年下半年提供该队列的最新疗效、耐久性和安全性数据。此外,2024年年中可能会启动一项既往治疗过的HNSCC患者的临床3期研究;目前打算继续评估大约40名接受1100/1500mg剂量水平的petosemtamab单药治疗先前治疗的HNSCC患者,以确认未来潜在临床试验3期研究的合适剂量,预计2024年下半年分享该队列的临床数据;还在评估petosemtamab和帕博利珠单抗联合治疗一线既往未治疗患者中的潜在的临床试验3期研究;并计划在2024年启动单药治疗二线结直肠癌的研究。
2. Zenocutuzumab (Zeno, MCLA-128)
Zenocutuzumab是作用于HER2和HER3的双特异性抗体,是一种潜在的first in class/best in class治疗NRG1+(神经调节蛋白1融合)患者的药物。NRG1蛋白主要与细胞表面的HER3受体结合,然后向细胞发出信号,让其执行某些对其生存和增殖至关重要的行为动作,正常细胞通常会调节NRG1蛋白的生成,以避免其不受控制的生长。但是,NRG1基因框内融合可导致NRG1融合蛋白在细胞表面的过度积累,并在不应该激活的时候激活HER3,HER3又可与HER2结合形成异二聚体,进而激活下游信号通路,这种不受调节的激活可能导致细胞增殖和分化,进而促进肿瘤的发生。Zenocutuzumab主要通过NRG1融合抑制实体瘤中的神经调节蛋白/HER3肿瘤信号通路。
2024年5月6日,Merus宣布FDA已接受Zenocutuzumab用于NRG1+非小细胞肺癌(NSCLC)和NRG1+胰腺导管腺癌(PDAC)患者的生物制品许可申请(BLA)。此前,FDA已授予Zeno突破性疗法称号(BTD),用于治疗既往全身治疗进展或没有令人满意的替代治疗选择的晚期不可切除或转移性NRG1+PDAC患者和既往全身治疗进展的晚期不可切除或转移性NRG1+ NSCLC患者。
Merus首席医疗官Andrew Joe博士表示:FDA接受Merus的第一个BLA代表了公司的的一项重要成就,也是NRG1+癌症患者的重要潜在治疗机会,NRG1+癌症是一种预后不良且需求未得到满足的疾病。Zenocutuzumab有可能成为NRG1+肺癌和胰腺癌患者的第一个也是唯一一个靶向治疗,并可能比目前可用的疗法提供实质性的改善。
3. MCLA-129
MCLA-129是一种靶向EGFR(表皮生长因子受体)和c-MET(肝细胞生长因子受体)的双特异性抗体,可同时阻断EGFR和c-Met的信号传导,抑制肿瘤的生长和存活,且可经增强的抗体依赖的细胞介导的细胞毒性作用(ADCC)进一步提高对肿瘤细胞的杀伤潜能。
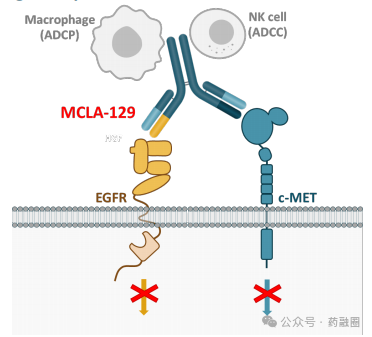
MCLA-129正处于一项临床试验1/2期开放标签研究,该研究评估MCLA-129单药治疗肝细胞生长因子受体(c-MET)外显子14跳跃突变(MET ex14)非小细胞肺癌(NSCLC)患者,2024年6月3日,Merus在美国临床肿瘤学会(ASCO)上公布的初步结果显示,22例患者接受了治疗,14例患者(64%)正在继续治疗,MCLA-129在具有METex14跳跃突变的局部晚期/转移性NSCLC患者中显示出良好的单药疗效,无论是否接受过MET TKI治疗;该队列还证实了MCLA-129单药治疗的可控安全性,对于具有METex14跳跃突变的NSCLC患者,需要进一步的临床研究。预计2024年开始MCLA-129联合化疗治疗2L+ EGFRm NSCLC计划。
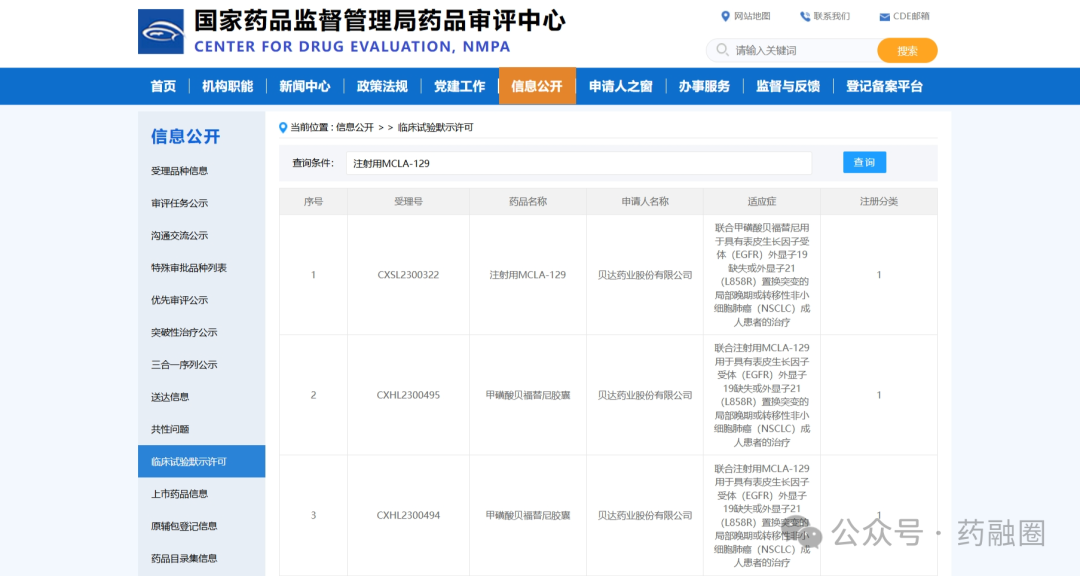
图源:国家药品监督管理局药品审评中心
2019年1月,Merus与贝达医药达成战略合作,根据协议条款,贝达医药负责MCLA-129在中国的临床开发和潜在商业化,而Merus则保留全部中国以外的权利。临床前研究结果显示,MCLA-129和甲磺酸贝福替尼联用组在人体肺癌模型小鼠上,相较单药组表现出更加显著的抑瘤效果,安全可耐受,联合用药优势明显。2023年7月,贝达医药宣布收到国家药品监督管理局签发的《药物临床试验批准通知书》,公司申报的注射用MCLA-129和甲磺酸贝福替尼胶囊联合用药的临床试验申请已获国家药品监督管理局批准。
4. MCLA-145
MCLA-145是一种靶向PD-L1和CD137的全人源双特异性IgG1抗体,在临床前模型中显示出抗肿瘤活性,治疗后肿瘤中CD8+ T细胞富集,CD8+ T细胞是适应性免疫系统的关键组成部分,能够识别和清除病毒、细菌和肿瘤等外源性抗原。目前正在进行MCLA-145作为单药治疗和与帕博利珠单抗联合治疗实体瘤的临床试验1期研究。
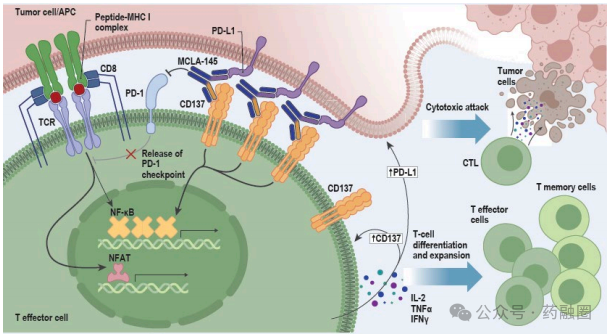
在最近的报告中显示,MCLA-145作为单药治疗和与帕博利珠单抗联合治疗在40 mg Q3W(RDE)下显示出可控的安全性;作为单药治疗和与帕博利珠单抗联合治疗PD-L1初治和治疗的患者显示出临床活性;药效学终点和早期临床观察表明,40 mg Q3W 的活性有所改善治疗;观察到临床活性改善,CD8+ T细胞持续增殖,给药频率降低。
财务状况
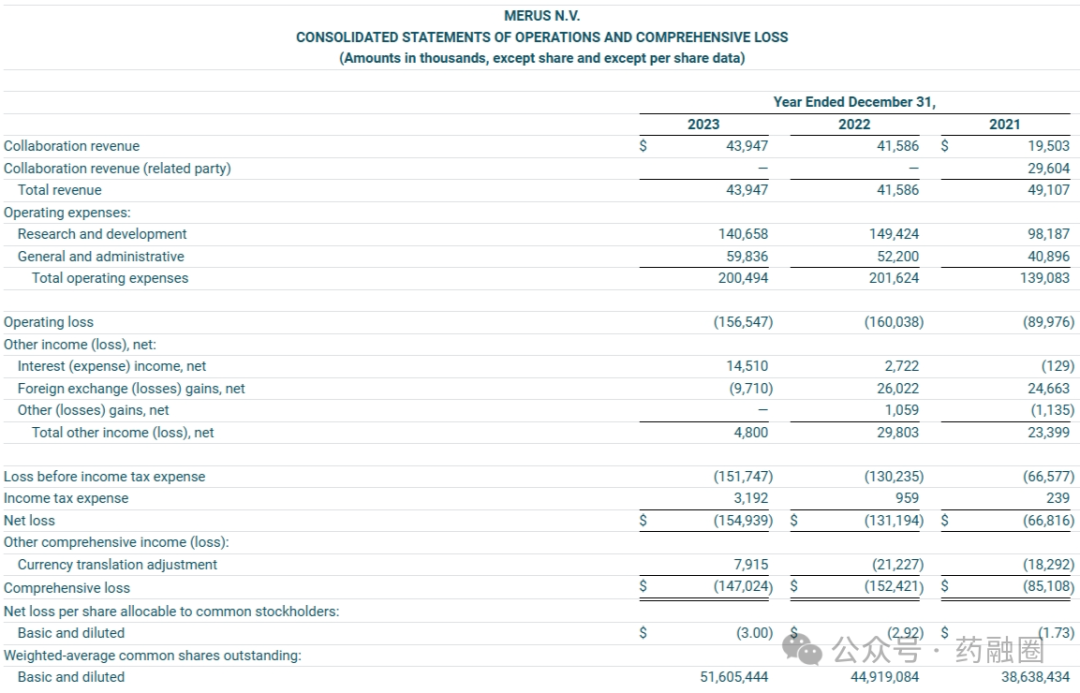
2023年度Merus的合作收入约为4400万美元,与上年同期相比增加了240万美元,主要是由于Incyte收入增加了260万美元,礼来收入增加了100万美元,但被其他收入减少120万美元所抵消。研发费用约为1.4亿美元,与上年同期相比减少了880万美元,主要是由于外部临床服务和药物制造成本的下降,包括履行与项目相关的合作协议义务的成本1880万美元和合作伙伴费用70万美元,部分被人事相关费用的增加所抵消。一般和行政费用约为6000万美元,与上年同期相比增加了760万美元,主要是由于咨询费用增加了310万美元,人事相关费用(包括因员工人数增加而产生的210 万美元的股份薪酬)、知识产权和许可费用增加了100万美元,设施和折旧费用为90万美元,法律费用为80万美元,差旅费为50万美元,部分被财务和人力资源费用减少90万美元所抵消。
2024年第一季度协作收入790万美元,与上年同期相比减少了560万美元,主要是由于成本报销收入减少;研发费用3860万美元,与上年同期相比增加了370万美元,主要是由于与项目相关的临床和制造成本增加;一般和行政费用为1600万美元,与上年同期相比增加了70万美元,主要是由于人事相关成本的增加被设施和咨询成本的减少部分抵消。
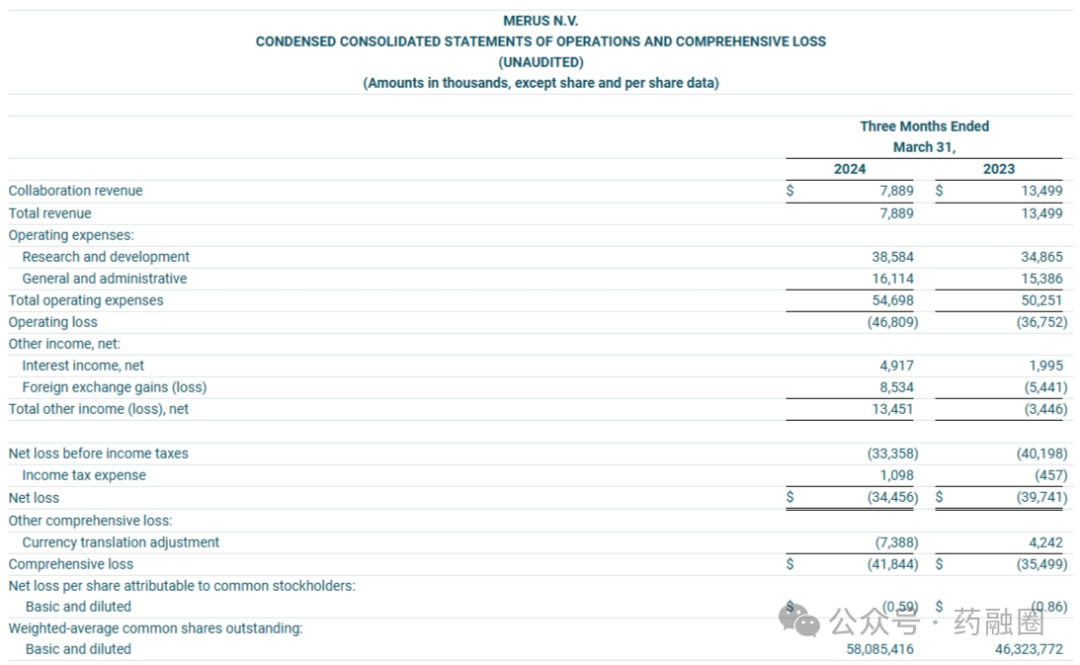
截至第一季度末,Merus的现金、现金等价物和有价证券为3.987亿美元,根据公司目前的运营计划,现有的现金、现金等价物和有价证券预计将为Merus到2027年的运营提供资金。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China