尝试用你的右手去握同伴的左手,结果怎样,是不是怎么着都感觉不对?你的右手掌与他/她的左手掌不能舒适地握合,这是因为手是具有非重叠镜像的手性物体。而“手性”一词正源自于此。所有的物体均有一个镜像,但只有当物体与其镜像不重叠时才被称为手性。
手性现象广泛存在于自然界,特别是在地球上的生命中,因而一直备受关注。分子作为微小的三维物体,也经常具有手性,这一观察最早可追溯到1848年路易斯·巴斯德的研究。手性分子与其对映体被称为R-构型和S-构型。在人们认识手性药物之前,欧洲一些医生曾将未经分离的消旋体药物用于孕妇,但这导致了严重的先天畸形婴儿,这一事件被称为“反应停”。后续研究揭示了R-构型具有镇静作用,而S-构型对胚胎有强烈的致畸作用。因此,自60年代以来,药物的研发都要经过严格的生物活性和毒性测试,以避免其中的另一种手性分子对人体造成危害。
在化学合成中,这两种手性分子的比例是相等的,因此对制药公司来说,每生产一公斤药物,都必须费力将另一半分离出来。如果无法找到这些分离出的分子的有效用途,它们就只能成为废物。 如今,科学家们通过一种称为“不对称合成”的方法来解决这一问题。不对称合成的化学控制手性主要有四个途径:手性辅基参与、使用手性试剂(当量使用)、构建手性环境(如手性溶剂)和利用手性催化剂。 在这些方法中,利用手性催化剂来实现不对称合成是最具挑战性的。由于其在反应中还具有手性放大的效应,因此该方法也是合成手性化合物最高效的途径之一。这一方法广泛应用于制药、香精和甜味剂等化学领域,极大地提高了工业生产效率。不对称催化相关研究多次获得诺贝尔化学奖,其重要性不言而喻。发展新的催化剂体系和高效的控制模式,以推动新的高效不对称催化体系的发展,是未来不对称催化的重要发展趋势。

近日,西湖大学王兆彬团队在《美国化学会志》发表了题为《Cr-Catalyzed Asymmetric Cross Aza-Pinacol Couplings for β‑Amino Alcohol Synthesis》的研究论文。他们通过自由基极性交叉策略,发展了一类铬催化醛和亚胺不对称还原偶联反应,实现了高附加值手性β‑氨基醇的模块化合成。该成果为合成含有氨基醇类骨架的药物分子以及手性配体提供了新的合成途径。
自由基与不对称催化的“渊源” 自由基,又称为游离基,指分子在外部条件下(如光热等),共价键均裂产生带有不成对电子的原子或基团。自由基具有两个主要特点:高反应性和磁性。与传统的极性/离子型反应以及过渡金属催化反应相比,自由基反应对活性官能团如羟基和氨基等更具容忍性,此外其高活性可实现复杂分子结构的高效构建。 尽管自由基反应方法丰富,但仍面临多个挑战,尤其是自由基反应的手性控制及新反应性探索等(例如,如何实现自由基对羰基的不对称加成)。 极性反应作为化学转化的基本方式,可用于有效合成目标分子,并且随着手性辅基等手性源的引入,已经能够实现手性分子的高效构建。相比之下,自由基不对称反应仍处于快速发展阶段,反应的手性控制模式还具有广泛的发展空间。近年来,将自由基极性交叉(radical-polar-crossover , RPCO)反应融合到上述两种反应中,已成为一种高效的合成手段,克服了自由基和传统极性化学的局限性。 西湖大学王兆彬团队一直致力于自由基极性交叉策略的反应研究,并取得了一系列成果(Angew. Chem. Int. Ed.2022, 61, e202117114; Nat. Commun.2022, 13, 5036; ACS Catal.2022, 12, 11152; ACS Catal.2023, 13, 3170; Angew. Chem. Int. Ed.2023, 62, e202305987)。在此基础上,他们设想是否能够利用这一策略,高效合成具有高附加值的手性分子? 打开手性β-氨基醇合成的“新大门” 手性β-氨基醇骨架不仅广泛存在于药物、农药和天然产物中,还作为手性配体应用于不对称催化。尽管有机化学家们一直在致力于发展手性β-氨基醇的合成方法,包括α-氨基烯醇化合物和醛的aldol加成、α-烷氧基烯醇化合物与亚胺的Mannich反应、α-氨基酮或α-羟基胺的氢化反应、环氧或环氮化合物的开环反应以及烯烃的羟胺化反应等,然而这些方法通常局限于特定底物或多步合成的反应前体,合成成本较高,从而限制了它们在有机合成中的广泛应用。因此,亟需开发新的催化合成策略,以从简单的起始物出发高效合成手性β-氨基醇类化合物。 醛和亚胺作为广泛且廉价的起始物,可用于模块化合成手性β-氨基醇,但实现化学和立体选择性仍然是主要挑战。在反应体系中,醛和亚胺作为亲电试剂容易发生还原和亲核加成反应,竞争生成1,2-二醇或1,2-二胺等副产物。此外,实现β-氨基醇相邻手性中心的构建也是该反应的难点。 近年来,该领域已取得一些进展,如林国强课题组利用SmI2作为还原剂,实现了手性亚磺酰胺和醛的不对称还原偶联反应;Knowles课题组利用手性磷酸和光的协同催化,通过PCET策略(proton-coupled electron transfer)实现了分子内酮类化合物和腙的还原偶联;黄培强课题组报道了一类手性Lewis酸催化和光协同催化醛和硝酮的还原偶联反应。这些反应都涉及类似的中间体,即通过选择性还原羰基化合物,然后生成的ketyl自由基与亚胺类衍生物发生加成反应。尽管如此,实现立体选择性催化醛和亚胺的分子间交叉偶联反应仍然面临重大挑战。
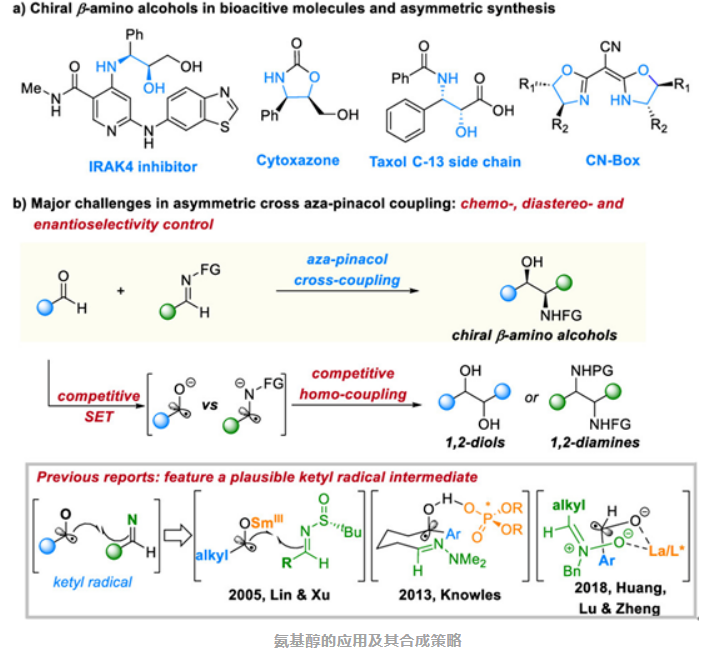
王兆彬团队的科学发现成功开辟了合成这些重要分子的全新途径。该团队利用α-胺基自由基极性交叉策略,实现了铬催化醛和亚胺的不对称还原偶联反应,能够高效得到具有相邻手性中心的β-氨基醇类化合物。
这一突破性方法的关键在于使用了手性铬催化剂,这种催化剂在多个关键步骤中发挥了作用。首先,它实现了亚胺的化学选择性单电子还原,并利用强吸电子的保护基来调控亚胺的还原电势,使得亚胺优先于醛被还原,产生α-胺基自由基。其次,铬催化剂能够迅速截获自由基,抑制了自由基加成到亚胺上的反应,从而防止了1,2-二胺的生成。最后,生成的烷基铬中间体更倾向于对醛发生不对称加成,而不是亚胺,这是由于铬离子的高氧亲和力所致。
前景广阔,大有可为
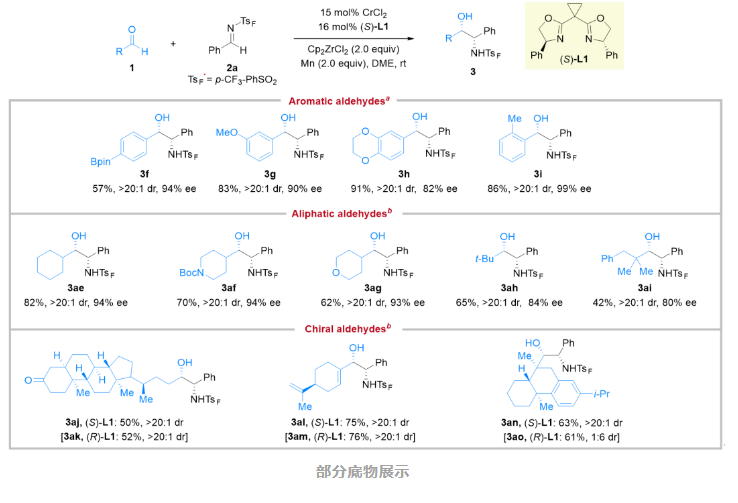
该反应具有良好的底物适应性和官能团兼容性。结果表明,各种芳香醛、一级、二级、三级烷基醛以及芳香亚胺的反应均顺利进行,产率介于中等到良好之间,立体选择性较高,得到了一系列手性β-氨基醇类化合物。该反应对于多种官能团(包括氟、氯、三氟甲基、硼酸酯、噻吩、呋喃、吲哚、吡啶)具有良好的兼容性。对于天然产物和药物衍生的手性醛,该反应也能以良好的产率和立体选择性得到相应的目标产物。
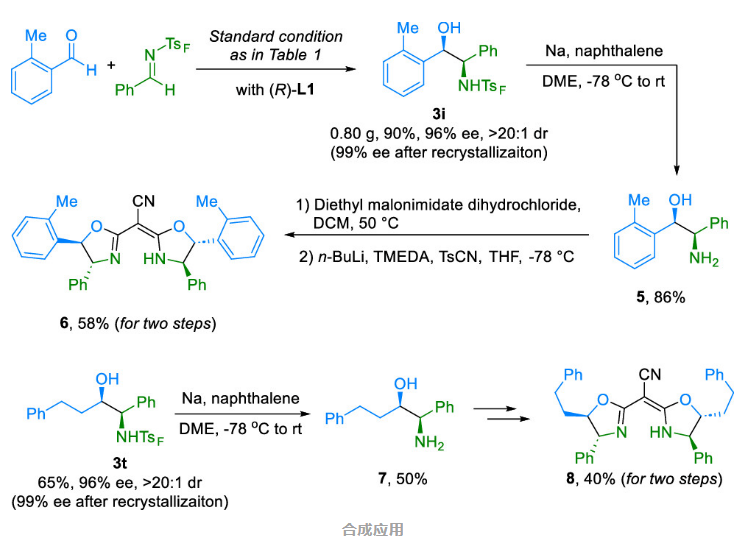
为展示该策略在合成中的应用潜力,作者进行了大规模的实验,通过简单的结晶和去保护基反应,可获得99%ee值的手性β-氨基醇产物,这是以前难以合成的。通过后续转化,可以制得修饰的氰基噁唑啉类配体,展示了该策略在合成手性氨基醇和新型氮配体方面的潜在应用价值。
通过一系列机理研究,如还原电势测定、自由基捕获实验以及非线性效应研究,并结合已有文献报道,作者提出了可能的催化循环。
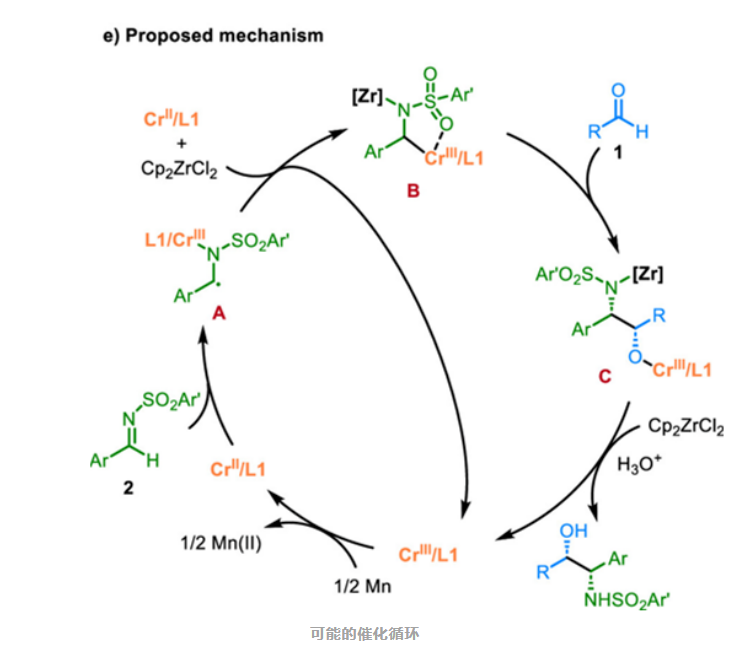
总之,西湖大学王兆彬团队开发了一种铬催化醛和亚胺不对称交叉偶联反应,该反应成功应用于手性β-氨基醇的高效合成。与以往的反应路径不同,该方法利用α-胺基自由基的极性交叉策略,可以高效地调控反应的化学和立体选择性。通过从简单易得的起始物出发,可以模块化地合成高附加值的手性β-氨基醇,为合成氨基醇骨架的药物分子以及手性配体提供了新的合成途径。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China