新药非坦途,英国老牌核酸药物公司SilenceTherapeutics最近发生重大战略调整。
2025年2月底,Silence宣布暂不启动公司内部核心项目Zerlasiran(SLN360)的3期临床研究,直到为这一项目找到新的合作伙伴。
Zerlasiran此前是Silence进展最快的项目,这是一种针对脂蛋白(a)[Lp(a)]的siRNA疗法,设计为皮下注射制剂,通过靶向降解LPA基因转录的mRNA以减少Lp(a)的产生,从而达到治疗与高水平Lp(a)相关的心血管疾病的目的。2024年11月18日,Silence在美国心脏协会(AHA)年会上公布了Zerlasiran最新的2期临床数据:从基线至第36周,Zerlasiran治疗组(每16周300毫克、每24周300毫克或每24周450毫克)经安慰剂校正后使患者Lp(a)浓度在对应时间段内平均降幅达到了80%以上。
不过资本市场对这一结果似乎并不买账,数据披露当日Silence股价跌去13.23%,次日又暴跌36.75%。

目前市场上还没有专门针对Lp(a)的降脂疗法获批,但是Zerlasiran已经有几款核酸药物竞争对手处于临床后期阶段,例如安进的siRNA疗法Olpasiran、诺华/Ionis的ASO疗法Pelacarsen、礼来/Dicerna(被诺和诺德收购)的siRNA疗法Lepodisiran。摩熵医药数据pharma.bcpmdata.com(原药融云数据)显示:国内布局本靶点的小核酸药企有:恒瑞医药、赫吉亚、炫景、靖因、等等。除此之外,还有小分子企业布局。
此次Silence战略调整就在该公司终止合作的两个月之后。双方此前的合作始于2021年3月,合作旨在利用Silence专有的mRNAi GOLD™平台共同开发针对三个未披露靶点的siRNA药物。不过该合作在2024年12月终止。
虽然Silence在2024年第四季度收到了监管机构对于Zerlasiran的3期临床试验设计的积极反馈,并推进了Zerlasiran的3期临床试验准备工作,但现在Silence或许很难再去推进3期临床研究,毕竟这是非常烧钱的,况且Silence还面临着几家大厂的竞争。
最近Silence在为Zerlasiran积极寻找合作方。这一策略调整也让该公司现金流情况得以缓解,预计足以支撑到2027年。
Silence在最近几年也遭遇过其他合作方的“退货”。
2019年7月,Silence与Mallinckrodt达成合作,针对在补体介导的疾病中沉默补体级联的靶点,开发并商业化RNAi药物。在该合作中,Silence获得了2000万美元预付款,以及500万美元的股权投资,Mallinckrodt获得了靶向C3的临床前项目SLN501的全球独家许可,以及另外两个临床前未披露靶点补体项目的未来选择权,Mallinckrodt已在2020年7月行使了选择权。
不过在2023年3月,Silence重新获得了两个未披露靶点补体项目的全球独家权利。与此同时该公司还从Mallinckrodt挖走了首席科学官Steven Romano博士,担任Silence的首席医学官兼研发主管,最初他在两家公司签署合作协议之时于2019年7月作为非执行董事加入Silence。Romano博士此前曾在辉瑞工作了16年,在礼来工作了4年。
一年后的2024年3月,Mallinckrodt通知Silence,在1期临床试验完成后,将不会继续进一步开发靶向C3的项目SLN501。双方合作就此终止。
Steven Romano博士现在是Silence的执行副总裁兼首席研发官。
根据最新年报披露,Silence目前公开的主要合作伙伴貌似只有阿斯利康。
2020年3月,Silence与阿斯利康达成了一项合作协议,以发现、开发和商业化用于治疗心血管、肾脏、代谢和呼吸系统疾病的siRNA疗法。两家公司将合作实现siRNA分子向肝脏、心脏、肺和其他组织的递送。该合作最初涵盖五个靶点,阿斯利康可以选择将合作扩展到另外五个靶点。
根据该协议,阿斯利康向Silence支付了6000万美元预付款并向Silence进行2000万美元的股权投资。对于每个靶点,Silence有资格获得高达4亿美元的里程碑,以及分层版税。
2023年和2024年,Silence分别从此次合作中获得了1000万美元的选择权费用和1000万美元的里程碑付款。
Silence Therapeutics与阿斯利康最早的公开合作记录可以追溯到2007年,当时双方在呼吸系统疾病领域建立了合作关系,2010年,双方的合作被扩展到了包括肿瘤学在内的多个领域。
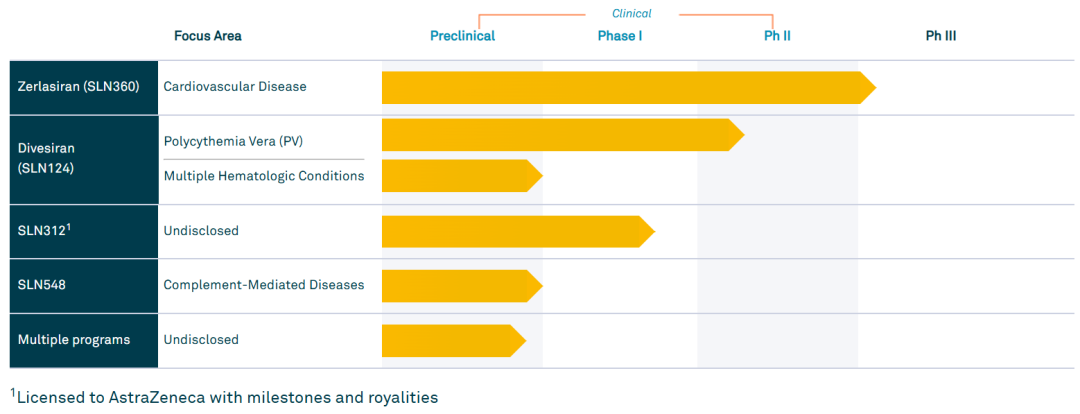
暂停心血管项目Zerlasiran之后,Silence将优先投资于罕见病项目Divesiran(SLN124),这是一种靶向TMPRSS6的siRNA疗法,被设计为皮下注射,用于治疗真性红细胞增多症(PV),有潜力成为PV领域first-in-class的siRNA疗法。PV是一种罕见的骨髓增生性肿瘤,其特征是血细胞和血小板过多,常导致HCT(红细胞压积)升高。HCT升高超过45%与心血管或血栓事件的死亡率升高4倍相关。该病影响美国约15万人,全球约350万人。目前的标准治疗方案包括重复进行放血疗法以降低HCT和/或使用细胞减少剂来减少红细胞的产生。目前还没有专门针对红细胞和HCT的获批疗法。
TMPRSS6基因是铁调素的负调控因子,铁调素是控制体内铁稳态的主要激素。通过在PV患者中沉默TMPRSS6基因,Divesiran旨在增加肝细胞中铁调素的产生和释放,从而限制铁进入骨髓,进而减少红细胞的过度产生。
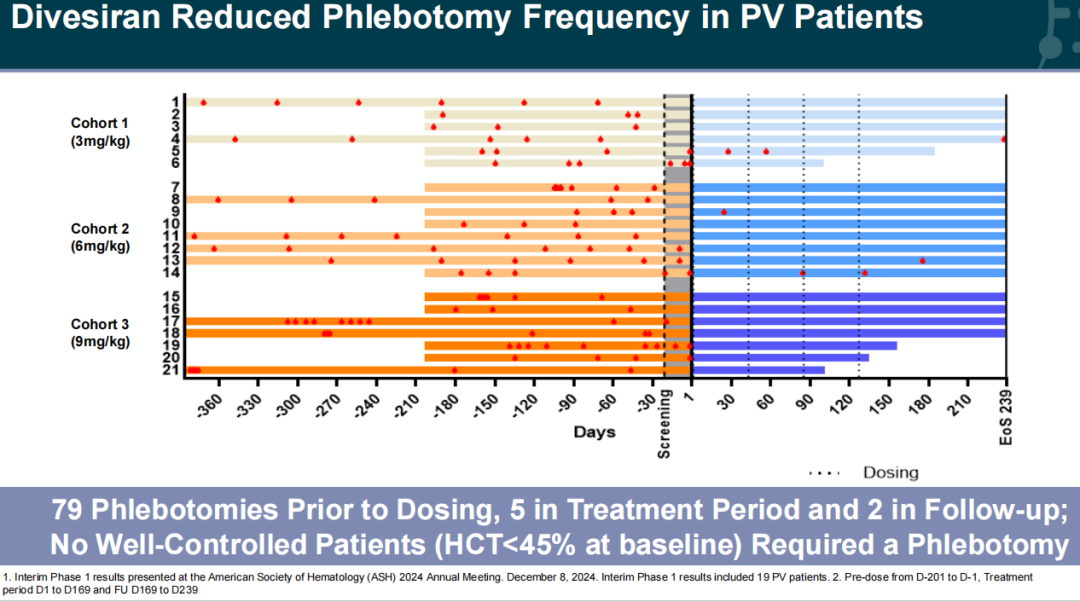
2024年12月,Silence在美国血液学会(ASH)年会上公布了Divesiran治疗PV患者的1/2期临床试验的1期阳性中期结果。中期结果显示,在一系列PV患者中,低频率的Divesiran治疗显著减少了静脉放血术的需求,同时降低了HCT水平。此外,迄今为止,该药物耐受性良好,没有剂量限制毒性。与此同时,Silence还宣布Divesiran的2期临床试验部分已完成首例患者给药,预计将在2025年年底完成患者招募。
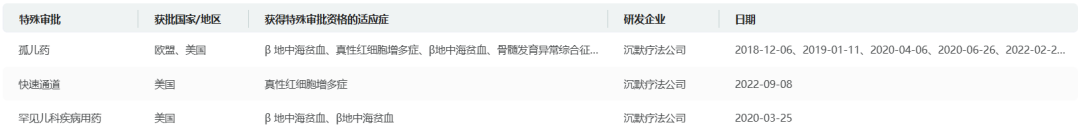
摩熵医药数据显示,FDA已授予Divesiran治疗PV的快速通道和孤儿药资格认定。欧盟也在2024年12月授予该药治疗PV的孤儿药资格认定。
图源:
药融云数据,www.pharnexcloud.com;改名后为摩熵医药数据
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China