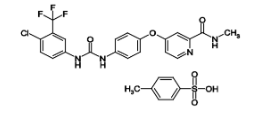
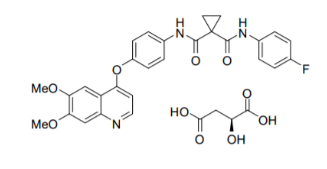
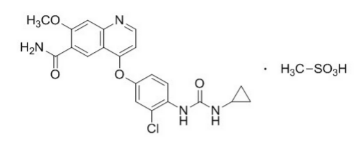
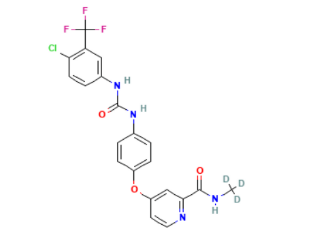
雷莫芦单抗(Ramucirumab)
雷莫芦单抗是一种VEGFR2抑制剂,首次获批于2014年,补充新适应症于2022年获得FDA批准,用于既往接受过索拉非尼治疗,AFP≥400 ng/mL的肝细胞癌治疗。雷莫芦单抗是一种VEGFR抑制剂,在一项代号为REACH-2的临床试验中,292名Child-Pugh分级为A级、巴塞罗那分期分别为C期及B期不可切除或介入治疗的患者加入了试验,受试者按2:1分组,分别接受本品治疗或最佳支持性护理,mOS分别为8.5个月 vs 7.3个月,mPFS分别为2.8个月 vs 1.6个月,ORR分别为4.6% vs 1.1%。
综合上述,获批肝细胞癌适应症的药物几乎都是VEGFR抑制剂或带有抑制VEGFR的多靶点抑制剂,VEGFR抑制剂性质上是抑制血管生长,理论上对多种肿瘤有效,从FDA批准的多个产品来看,疗效确有明显的提升,但并没有从量变发展为质变。
二、免疫检查点抑制剂
帕博利珠单抗(商品名:Keytruda)
帕博利珠单抗于2014年获批上市,2018年获FDA加速批准用于索拉非尼治疗后进展的肝细胞癌治疗。在一项代号为KEYNOTE-224的临床试验中,104名经索拉非尼治疗后进展的HCC患者(Child-Pugh分类为A级)加入了试验,经过单臂、开放性治疗,ORR为17%,持续缓解时间超过12个月的患者比例为56%。
纳武单抗(Opdivo)+依匹木单抗(商品名:Yervoy)
纳武单抗于2015年获批上市,2020年获FDA加速批准用于,与依匹木单抗联用,治疗索拉非尼治疗后进展的肝细胞癌。在一项代号为CHECKMATE-040的临床试验中,49名HCC亚组(均为索拉非尼不耐受或治疗后进展的HCC,Child-Pugh分类为A级),经过本品+依匹木单抗联合治疗,ORR为33%,持续缓解时间超过24个月的患者比例为31%。
度伐利尤单抗(商品名:Imfinzi)+tremelimumab(商品名:Imjudo)
2021年6月,信迪利单抗获NMPA批准,与贝伐珠单抗联用,一线治疗不可切除或转移性的、既往未经历过系统性治疗的肝细胞癌。在一项代号为ORIENT32的临床试验中,571名既往经历过系统性治疗、Child-Pugh≤7分、巴塞罗那分期分别为C期及B期不可切除或介入治疗的患者加入了试验,所有受试者按2:1分组,并分别接受本品+贝伐珠单抗或索拉非尼治疗,结果显示两组患者的mPFS分别为4.6个月 vs 2.8个月,mOS分别为NR vs 10.4个月,ORR分别为19.1% vs 3.8%。
卡瑞丽珠单抗(Camrelizumab)
2020年3月,卡瑞丽珠单抗获NMPA批准,用于既往接受过索拉非尼治疗和/或含奥沙利铂系统化疗的晚期肝细胞癌治疗。在一项代号为SHR-1210-II/III-HCC的研究中,220名Child-Pugh肝功能评级为A级或较好的B级、不适合手术或局部治疗、并且经过至少一线系统性治疗后失败或不耐受的转移性HCC患者参与了试验,主要终点为独立影像评估委员会(IRC)的ORR和6个月生存率。经过本品不同两周一次或三周一次的治疗,两周一次组或三周一次组ORR分别为14% vs 17%,mPFS分别为2.3个月 vs 2.1个月,mOS分别为14.2个月 vs 12.6个月,6个月生存率分别为79.2% vs 73.3%。
替雷利珠单抗(Tislelizumab)
2021年6月,NMPA批准替雷利珠单抗用于既往接受过治疗、且不可切除的肝细胞癌治疗。在一项国际多中心的2期研究中,249名不可切除的HCC患者,其中138名既往接受过一种全身性治疗、111名既往接受过至少两种,主要终点为独立影像评估委员会(IRC)的ORR。经过本品治疗,ORR为13.3%,mPFS和mOS分别为2.7个月和13.2个月。
阿替利珠单抗(商品名:Tecentriq)
阿替利珠单抗于2021年获得NMPA批准,联合贝伐珠单抗治疗既往未接受过全身系统性治疗的不可切除肝细胞癌。在一项代号为IMbrave150的临床研究中,501例符合入组条件的患者(Child-Pugh A级)以2:1分组分别接受本品+贝伐珠单抗或索拉非尼治疗,mOS分别为NR vs 13.2个月,6个月存活率分别为84.8% vs 72.2%,mPFS分别为6.8个月 vs 4.3个月,ORR分别为27.3% vs 17.9%。
免疫检查点抑制剂是上帝赐给肝癌患者的一大礼物,为肝癌的治疗带来了巨大的进步。或许曾经有人质疑我国的PD-1赛道过于拥挤,但对于肝癌患者而言是多多益善。由于PD-1/L1并非像小分子抑制剂一样,是针对某个适应症或某个靶点高通量筛选出来的,而更像是鸟枪法在打“适应症"。由于PD-1/L1广泛的疗效,或许PD-1/L1的设计者他也不知道他的产品会对哪些肿瘤有效,对哪些肿瘤无效,只能通过大量临床试验把疗效数据砸出来。因此,不同的PD-1/L1可能获批的适应症不同,在不同适应症上的疗效也会有巨大的差异,不是FDA批准的产品就是最好的,只有多个产品的数据对比,才能得到某个适应症领域患者获益最大的产品。
三、处于临床研究阶段的肝癌新药
肝癌信号通路极其复杂,新药研发失败率较高,获批产品临床获益也不不明显,除了免疫治疗,目前处于临床末期阶段的肝癌药物较少,包括Everolimus(mTOR抑制剂、三期)、阿昔替尼(2期)等,当然还有很多处于研发早期阶段的新机制药物。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China