精准医疗在肿瘤领域的地位如今不可小觑。
癌症精准医疗的一个开创性例子,是在晚期肺癌患者中开发针对EGFR的小分子抑制剂。接受EGFR抑制剂治疗的EGFR突变患者的缓解率在65%范围内,而未经选择的肺部患者的缓解率约为10%。早年Erlotinib (Tarceva®)是在美国被批准作为以EGFR突变为特征的NSCLC患者的一线治疗药物,此外,ALK、BCR-ABL、BRAF、ROS1、RET和TRK抑制剂等也是使用精准医学方法开发的批准药物。
今天要介绍的这家公司——Kura Oncology主攻精准医疗领域,专注于研发用于治疗实体瘤和血液癌症的精准药物。

Kura成立于2014年,成立一年后,即2015年成功在纳斯达克上市。截至2024年2月28日,Kura股价21.38美元/股,市值约16.28亿美元;5月10日,约15.78亿美元。发展10年来,该公司在10轮融资中共筹集到了10亿美元资金。
2007年,Kura的核心初创团队成立,其中包括Troy Wilson博士和美国科学院院士Kevan M. Shokat教授,成立新药公司Intellikine。在随后的四年内,Intellikine将3种候选药物带至临床,用于治疗小淋巴细胞性淋巴瘤的小分子药物Duvelisib(度维利塞)于2018年经FDA批准上市,国内权益由石药集团持有。
2012年,在出售Intellikine后(2011年被武田制药/Takeda收购),Shokat基于加州大学旧金山分校(UCSF)的实验室所做的一些研究,提出创立新公司的想法,联合刘异博士、仁达平博士顶级华人科学家以研发共价抑制剂小分子药物以期靶向致癌蛋白KRAS G12C,创立了Araxes Pharma。
“Araxes Pharma”这一名字是由Shokat提议命名的,它源于阿拉克斯河(Araxes)。Araxes经土耳其、亚美尼亚、阿塞拜疆和伊朗的河流,流经小高加索山脉南侧后,与库拉河(Kura)汇合,然后注入里海。此外,Shokat还被“Araxes”所吸引,因为它翻译为“A Ras”或简称“Ras”,RAS分子途径正是他在UCSF研究的重点。
而他们并没有止步于Araxes,不久后,他们创立了Wellspring Biosciences(Araxes Pharma的子公司)——“Wellspring”即创新的“源头”。
2014年8月,Wilson和Shokat、刘异博士及任平达博士一同创立了Kura Oncology。此次他们将目光转向Araxes的下游库拉河(Kura),并将新公司命名为Kura Oncology。(刘博后创立公司为Kumquat)
基于Araxes和Wellspring的此前创业经验,以及在Wilson及其核心团队的推进下,Kura乘上了快速发展的列车,推出了两条全资拥有的小分子药物研发管线,且三个在研产品全部进入临床开发。

ZIFTOMENIB
Kura的第一个候选产品Ziftomenib是一种口服的选择性menin抑制剂,用于抑制menin与KMT2A/MLL蛋白复合体之间的相互作用,以治疗携带特定基因突变的AML患者。
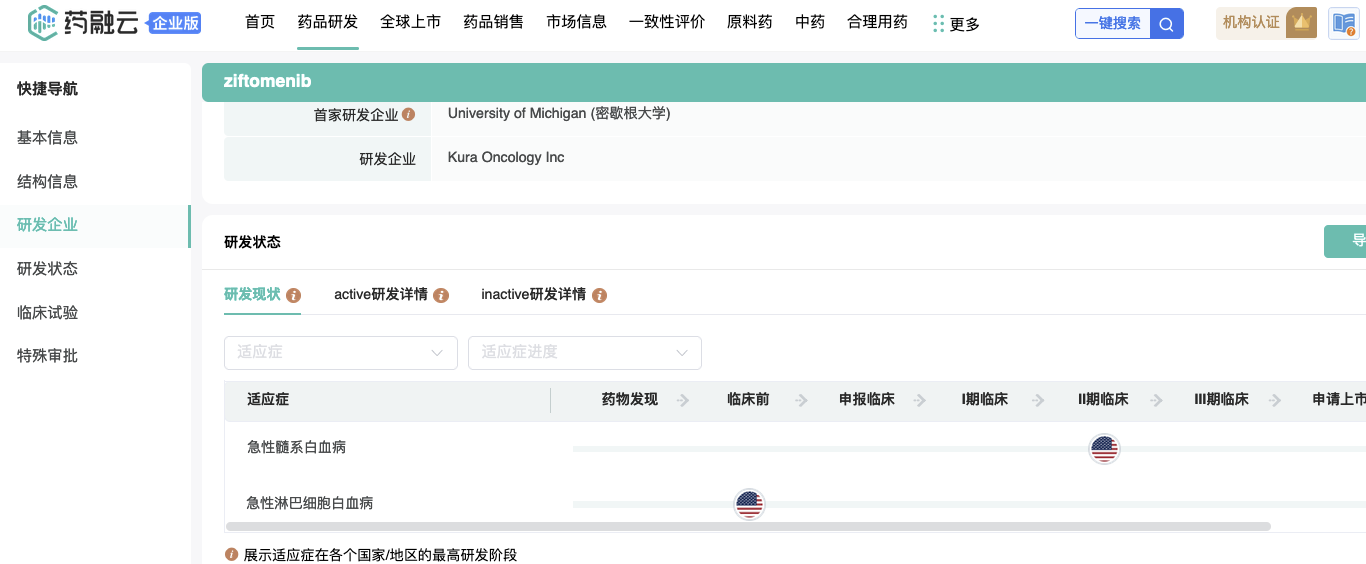
在临床前模型中,ziftomenib抑制了KMT2A/MLL蛋白复合体,并表现出强大的抗白血病活性。
2019年7月,Kura从美国食品和药物管理局(FDA)获得了Ziftomenib治疗急性髓系白血病(AML)的孤儿药指定。并于2019年9月启动了Ziftomenib治疗复发性或难治性AML的全球Menin-KMT2A 1/2期临床试验,称之为Kura Oncology Menin-KMT2A试验,或KOMET-001。
在KOMET-001试验的1A期剂量递增部分,在30名复发性或难治性AML患者中,Ziftomenib显示出广泛的治疗窗口和令人鼓舞的单一治疗活性。共有53名患者在试验的1B期剂量验证和剂量扩展部分接受治疗,该试验由两个随机扩展队列组成,每个队列由核磷蛋白1-或NPM1-突变体和KMT2A-重排AML患者组成。在KOMET-001试验的1B期部分,Ziftomenib在600 mg时显示出最佳的临床效益,该剂量被指定为推荐的2期剂量(RP2D)。
2023年6月11日,在德国法兰克福举行的2023年欧洲血液学协会年度大会(EHA)的最新口头会议上,Kura公布了KOMET-001的最新临床数据,包括1B期的数据,包括重度预处理和共突变的复发或难治性NPM1突变AML患者的持久活性。
截至2023年4月12日的数据截止日期,20名接受600 mg RP2D治疗的NPM1突变AML患者中有7名(35%)达到完全缓解(Cr),计数完全恢复。第八名患者在接受Ziftomenib治疗后出现部分计数恢复的Cr,随后在造血细胞移植(HCT)后出现完全计数恢复的Cr,并在EHA报告之日仍在研究中。
此外,一名接受200 mg治疗的NPM1突变型AML患者在数据截止时继续接受36个周期的Ziftomenib治疗。在接受Ziftomenib治疗的NPM1突变和其他关键共突变患者中观察到持久缓解。值得注意的是,33%(2/6)的FLT3共突变患者、50%(4/8)的异柠檬酸脱氢酶或IDH共突变患者以及50%(2/4)的FLT3和IDH共突变患者在服用600 mg剂量的齐夫托梅尼时获得了Cr。在接受600 mg剂量治疗的NPM1突变AML患者中,Ziftomenib的总体缓解率(ORR)为45%。在研究的1A/B期部分,所有接受200 mg或600 mg治疗的NPM1突变患者的中位缓解持续时间(DOR)为8.2个月(95%CI:1.0至NE),中位随访时间为8.8个月。这类患者在干细胞移植时的中位DOR为5.6个月(95%CI:1.0至NE)。
作为正在进行的分析的一部分,在三名接受Ziftomenib治疗的患者中检测到耐药突变MEN1-M3271:在这三名患者中的两名患者中,该突变是在患者先前使用Menin抑制剂后进展的研究开始时检测到的,在第三名患者中,该突变是在Ziftomenib治疗四个周期后检测到的,尽管存在突变,患者在整个第7周期均处于病情稳定状态。这些数据显示,仅有3%(1/29)的患者在接受Ziftomenib治疗后发生了MEN1突变,这表明即使长期接受Ziftomenib单药治疗,耐药突变的发生率也很低。晶体结构证实的一项关键的新生化发现表明,Ziftomenib保留了对MEN1-T349M突变的结合亲和力,在最近的另一项MENIN抑制剂试验中,在三分之二获得MENIN耐药突变的患者中检测到了该突变。Ziftomenib的连续每日给药耐受性良好,报告的不良事件特征与潜在疾病的特征一致。分化综合征(DS)的目标效应是可控的,15%的患者出现1级或2级事件,5%的患者出现3级事件。
2024年1月30日,Kura公布了KOMET-007研究中首批20名患者的初步数据。首批20名患者在2023年7月至2023年11月期间入选KOMET-007,包括5名新诊断的不良风险NPM1突变或KMT2A重排AML患者和15名复发或难治性NPM1突变或KMT2A重排AML患者。根据欧洲白血病网络(European LeukemiaNet),如果患者年龄超过60岁和/或患有治疗相关的急性髓细胞白血病(AML)和/或细胞遗传学不良风险,则被视为“不良风险”。
连续每日服用200 mg的Ziftomenib耐受性良好,安全性与基础疾病和骨干疗法的特征一致。未报告任何级别的分化综合征事件,也未观察到剂量限制性毒性、QTc延长、药物相互作用或附加骨髓抑制的证据。
第二项ziftomenib联合研究,称之为KOMET-008,旨在评估ziftomenib联合Gilteritinib治疗复发或难治性NPM1突变型AML患者,以及ziftomenib联合氟达拉滨、阿糖胞苷、粒细胞集落刺激因子或G-CSF、伊达比星或FLAG-IDA、低剂量阿糖胞苷或LDAC治疗复发或难治性NPM1突变型或KMT2A重排患者。在2024年2月26日,Kura宣布给第一个病人服用了KOMET-008。

Kura计划评估在接受HCT的NPM1突变或KMT2A重排AML患者中使用Ziftomenib作为维持治疗。HCT是唯一可能治愈AML的治疗方法,但HCT后长期失败的最常见原因是疾病复发。该公司正在支持一项由研究者发起的研究,并计划启动一项由公司发起的研究,评估Ziftomenib在HCT后作为维持治疗给药时改善结果的能力。预计在2024年第一季度启动移植后维护计划。
2023年12月8日,Kura宣布与白血病和淋巴瘤协会(LLS)开展临床合作,以评估ziftomenib联合化疗治疗儿童复发性或难治性KMT2A重排、NUP98重排或NPM1突变急性白血病的疗效。根据合作协议的条款,LLS将担任Ziftomenib在北美急性白血病儿童患者中的一期研究的协调赞助商,荷兰乌得勒支的马克西马公主儿科肿瘤中心将担任该研究在欧洲的协调赞助商,Kura将为LLS和马克西马公主中心的研究提供Ziftomenib。
关于AML
急性髓细胞性白血病(Acute myeloid leukemia,AML)是成人最常见的急性白血病,其中,KMT2A(KMT2A -r)重排和NPM1(NPM1 -m)突变是AML中常见的蛋白变化。研究数据显示,约5%—10%的AML患者存在KMT2A重排1,而约30%的AML患者存在NPM1突变2。
TIPIFARNIB
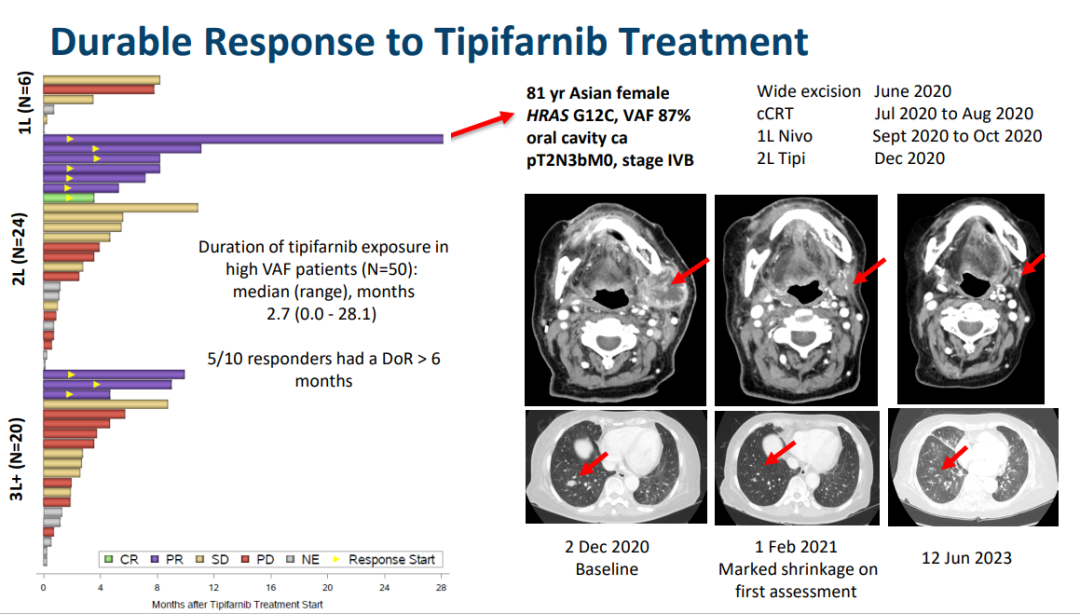
Kura的第二个候选产品Tipifarnib是一种强效、选择性和口服生物可利用的法尼基转移酶抑制剂(FTI),此前已在5000多名癌症患者中进行了研究,并在某些患者中表现出引人注目和持久的抗癌活性,且副作用可控。2021年2月,替匹法尼被FDA授予突破性治疗指定,用于治疗复发性或转移性HRAS突变头颈部鳞状细胞癌(HNSCC)患者,这些患者在接受以铂为基础的化疗或高VAF后出现疾病进展,且变异等位基因频率≥20%。
2021年7月,Kura宣布与诺华(Novartis)进行临床合作,以评估tipifarnib和Alpelisib(一种PI3激酶α抑制剂)在HNSCC患者中的联合应用,这些患者的肿瘤具有HRAS过度表达和/或PIK3CA突变和/或扩增。在2021年第四季度,Kura开始了一项1/2期开放标签、生物标志物定义的队列研究,称之为Kurrent-HN试验,以评估联合用药的安全性和耐受性,确定联合用药的推荐剂量和方案,并评估联合用药治疗此类患者的早期抗肿瘤活性。
根据该公司与诺华公司的合作协议条款,Kura赞助Kurrent-HN试验并供应Tipifarnib,诺华公司供应Alpelisib。2021年12月,Kura宣布对Kurrent-HN的PIK3CA队列中的第一名患者进行剂量给药。
2022年10月,首次报道了联合应用Tipifarnib和Alpelisib治疗PIK3CA突变的扁桃体鳞状细胞癌患者的持久临床反应。Kura将继续对剂量递增研究中的患者进行评估,为联合用药的最佳生物活性剂量(OBAD)的选择提供信息,预计将于2024年底确定。一旦确定了OBAD,该公司将继续评估该活性是否支持联合用药在头颈鳞癌中的发展和商业化。
关于HNSCC
头颈鳞状细胞癌(HNSCC)是全球第七大常见癌症,根据全球癌症观察中心(Global Cancer Observatory)发布的数据,HNSCC每年约有89万新增病例和45万死亡病例,占据了约4.5%约癌症诊断和死亡病例数。其中,约有4%—8%的HNSCC患者存在HRAS基因突变。
KO-2806
KO-2806是一种有效的下一代FTI,旨在改善早期FTI候选药物的效力、药代动力学和理化特性,并通过联合疗法满足晚期实体瘤患者的治疗需求。
2023年1月,该公司宣布FDA批准其研究新药(IND)申请KO-2806,用于治疗晚期实体瘤。并在2023年发布了多份临床前数据,Kura相信这些数据支持FTI(如KO-2806)与靶向治疗相结合的发展。
2023年4月,Kura在美国癌症研究协会年会上展示了临床前数据,强调了FTIs与两类不同的靶向治疗相结合的潜在用途。两篇文章中的第一篇揭示了替匹法尼与标准治疗抗血管生成酪氨酸激酶抑制剂(TKI)、细胞和患者来源的异种移植物中的阿西替尼(PDX)、透明细胞肾细胞癌模型(CCRCC)之间的强大协同作用。第二篇报道展示了通过在Adagrasib或Sotorasib中加入tipifarnib,KRAS抑制剂耐药的非小细胞肺癌(NSCLC)的多个模型的消退。
2023年9月28日,Kura在第五届RAS靶向药物开发峰会的口头会议上介绍了临床前数据,支持开发KO-2806联合KrasG12C抑制剂,以驱动KrasG12C突变NSCLC的肿瘤消退和持久反应。KrasG12C抑制剂先前已显示激活受体酪氨酸激酶信号传导,导致ERK-RSK和/或mTOR-S6通路再激活。
其临床前数据显示,用KO-2806和Adagrasib联合治疗KrasG12C突变型NSCLC的临床前模型,可加深多个节点的信号抑制,包括丝裂原活化蛋白激酶和mTOR通路,同时降低细胞增殖。在源自NSCLC肿瘤的细胞衍生的异种移植物或CDX和PDX模型中,KO-2806与Adagrasib的组合诱导了肿瘤消退。此外,CDX和PDX模型显示,与单药治疗的Adagrasib相比,抗肿瘤反应的持续时间和深度增强。
2023年10月13日,Kura在AACR-NCI-EORTC国际会议上提交了临床前数据,支持开发KO-2806的靶向治疗,包括TKIs、KrasG12C抑制剂和KrasG12D抑制剂。
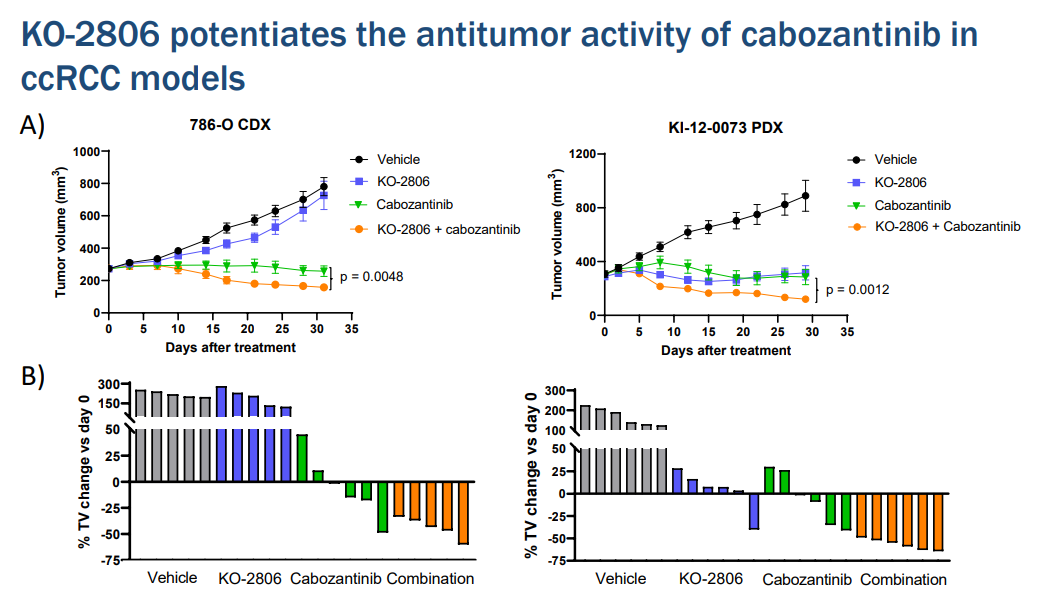
Kura正在评估KO-2806的安全性、耐受性、药代动力学、药效学和初步抗肿瘤活性,作为一种单一疗法,并在一项1期首次人体研究中与其他靶向疗法联合使用,称之为FIT-001试验。
2023年10月19日,该公司宣布在FIT-001试验的单药治疗部分给第一位患者给药。预计到2024年中期,首批接受KO-2806联合卡博替尼治疗慢性肾细胞癌的患者。2023年11月2日,宣布与Mirati Therapeutics,Inc.(简称Mirati)进行临床合作,以评估KO-2806和Adagrasib在肿瘤具有KrasG12C突变的NSCLC患者中的组合。根据协议条款,Mirati将为FIT-001试验的NSCLC组合队列提供Adagrasib,Kura赞助该试验。预计在2024年中期启动KrasG12c突变的NSCLC队列。
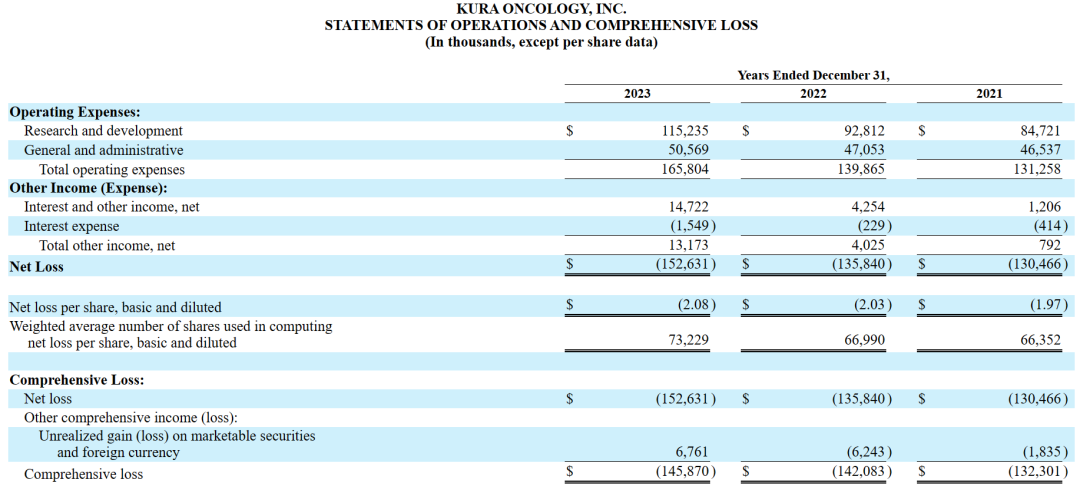
2022财年和2023财年的研发费用和一般行政支出情况如下(以千为单位):
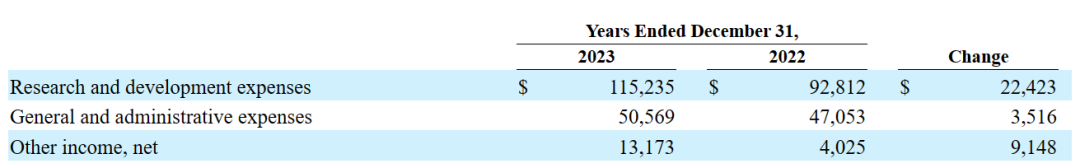
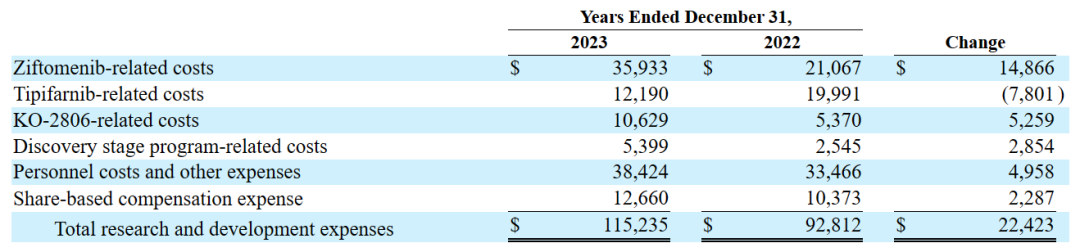
研发费用:与2022财年相比,在2023财年,该公司与Ziftomenib相关的研发费用增加,主要是由于与注册指导的Ziftomenib临床试验和启动Ziftomenib联合试验相关的成本增加;Tipifarnib相关的研发费用有所减少,主要是由于Tipifarnib注册指导试验的结束;与KO-2806相关的研发费用增加,主要是由于一期临床试验相关的成本增加;发现阶段项目相关的研发费用增加,主要是由于该公司临床前阶段候选产品的研究活动增加。随着Kura继续为Ziftomenib和FTI项目进行临床开发活动,预计研发费用将在未来增加。
一般及行政开支:与2022年相比,截至2023年12月31日止年度的一般及行政开支增加,主要是由于专业费用及人员成本增加所致。Kura预计其一般及行政开支将于未来期间增加,以支持计划增加的研发活动。
其他收入净额:与2022年相比,截至2023年12月31日止年度的其他收入净额增加主要是由于利息收入增加。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China