2024年3月26日,Syndax Pharmaceuticals宣布美国FDA接受其在研管线Revumenib递交的NDA并授予优先审评资格,用于治疗携带KMT2A重排(KMT2Ar)的复发/难治性急性白血病患者。如果进展顺利的话,Revumenib有望于2024年在美国获批。从药融云数据库获悉,Syndax Pharmaceuticals(以下简称Syndax)成立于2005年,是一家临床阶段的生物制药公司,致力于开发创新的癌症疗法管线。
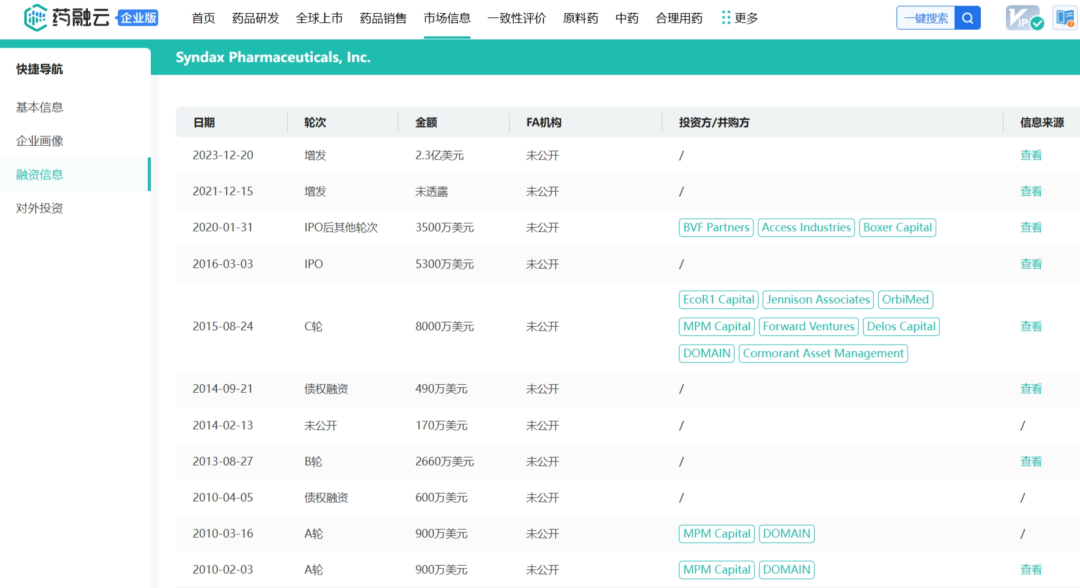
药融云数据库:融资信息
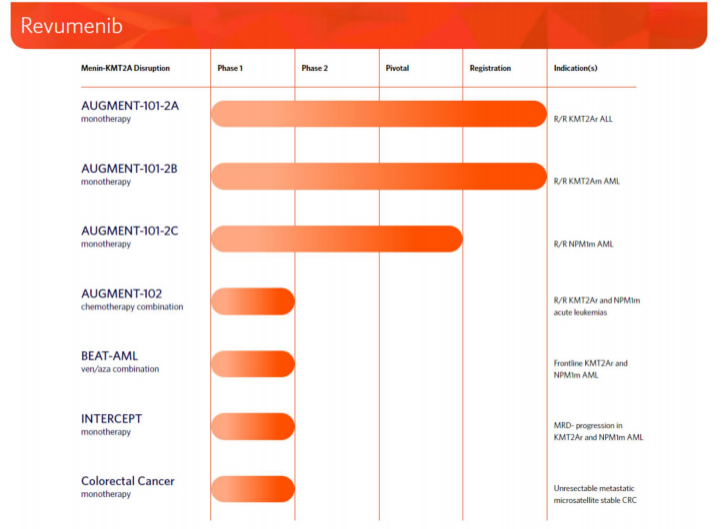
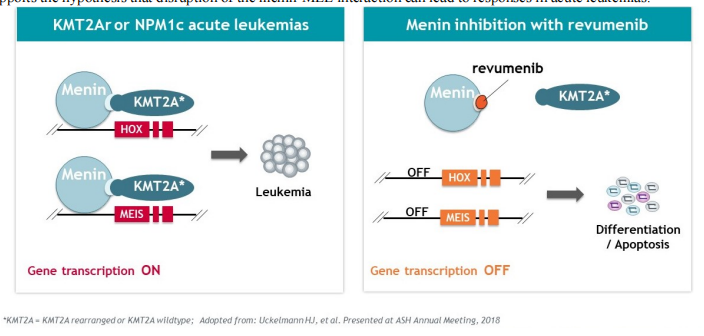
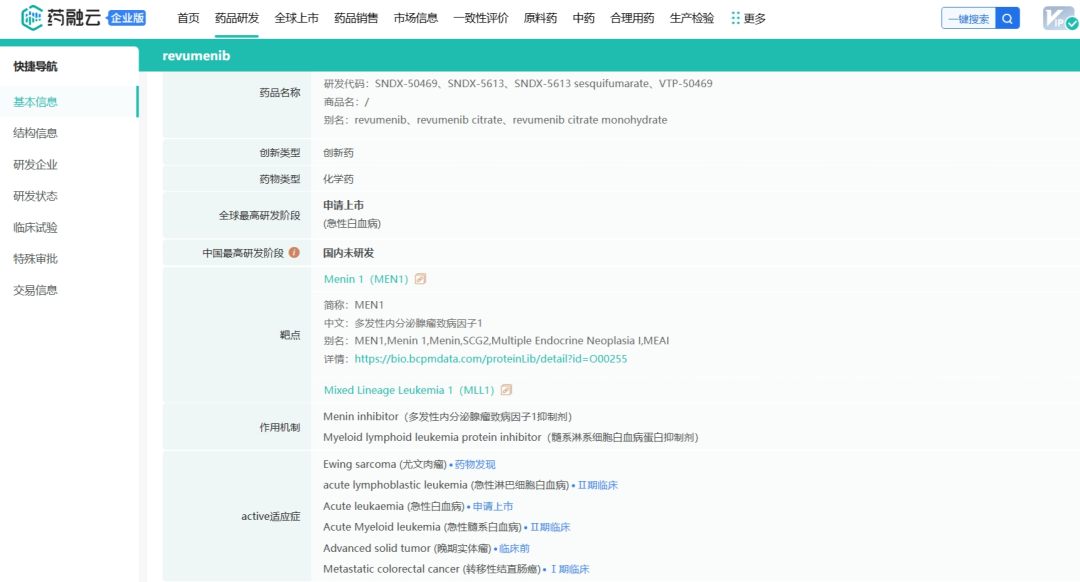
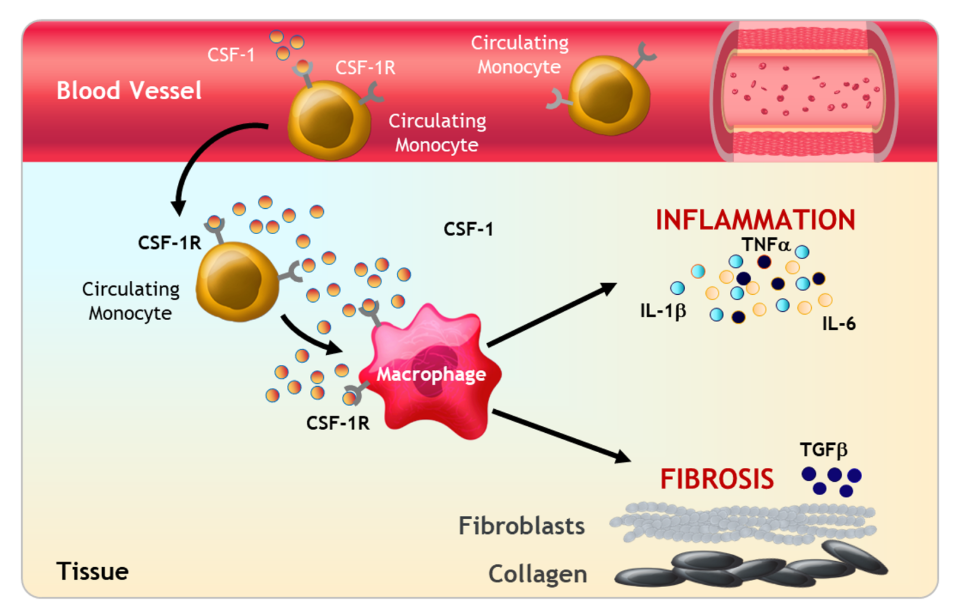
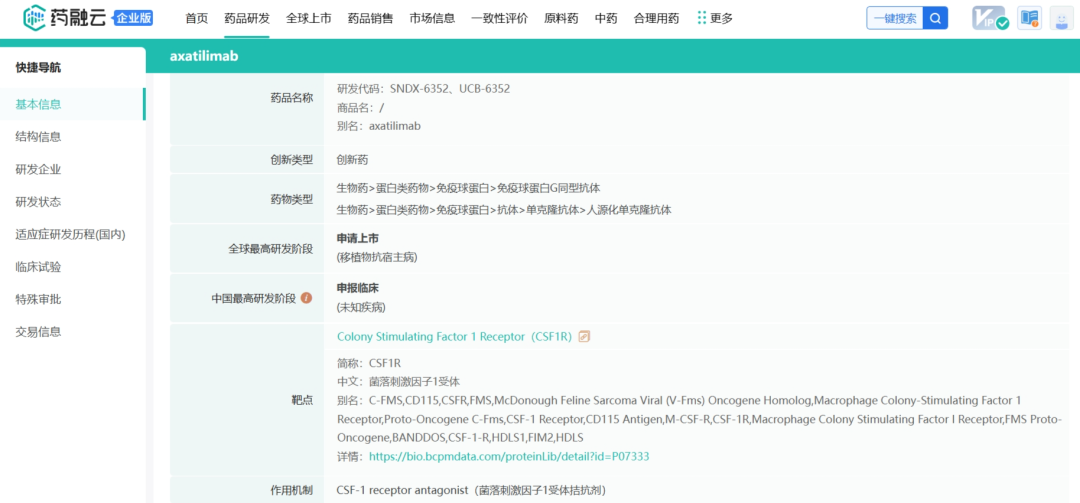
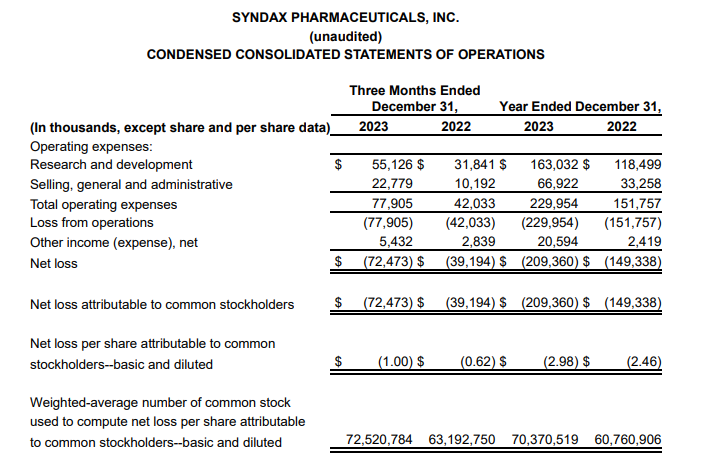
2023年底,Syndax宣布完成此前宣布的12432431股普通股的承销公开发行,其中包括行使全部承销商购买1621621股额外股票的选择权。在扣除承销折扣和佣金以及预计发行费用之前,Syndax从此次发行中获得的总收益约为2.3亿美元。此次增发无疑又为公司的融资和业务合作提供了更多机会,公司目前合作伙伴有Incyte、Vitae Pharmaceuticals(艾伯维的子公司)、UCB和拜耳。截止2024年5月23日,Syndax总市值17.09亿美元(124亿人民币)。截止2024年6月13日,收盘,每股17.40美元。 公司市值 Syndax目前与合作伙伴进行公司管线的研发,主要包括以下三条研发管线,各管线具体进展情况如下: Revumenib(SNDX-5613)是一种新型口服Menin-KMT2A抑制剂。KMT2A重排的白血病发生在婴儿、儿童和成人患者中,NPM1突变是急性髓系白血病中最常见的基因改变,KMT2A重排和NPM1突变合计占急性髓系白血病(AML)病例的40%。在KMT2A重排或NPM1突变的急性白血病中,menin蛋白与KMT2A的相互作用对于驱动白血病促进基因的表达至关重要。临床前研究表明,靶向menin和KMT2A之间的相互作用可能是治疗携带这些突变的癌症的有效策略。目前正在开发Revumenib用于治疗KMT2Ar(KMT2A重排,也称为混合谱系白血病重排或MLLR)急性白血病(包括急性淋巴细胞白血病和急性髓系白血病),以及NPM1突变(NPM1m)急性髓系白血病(AML)。 Revumenib目前正在多项临床试验中进行评估,包括用于治疗复发/难治性(R/R)急性白血病的关键性AUGMENT-101试验,各项临床试验具体进展情况如下:(1)AUGMENT-101-2A是Revumenib单药治疗复发/难治性KMT2A基因重排急性淋巴细胞白血病(ALL)的试验,这是一项临床试验1/2期开放标签、剂量递增和剂量扩展队列研究。(2)AUGMENT-101-2B是Revumenib单药治疗复发/难治性KMT2A基因突变急性髓系白血病的试验。(3)AUGMENT-101-2C是Revumenib单药治疗复发/难治性NPM1m(核磷蛋白1突变)的急性髓系白血病的试验。2024年3月,公司宣布完成针对R/RNPM1mAML患者的AUGMENT-101关键试验队列的入组,顶线数据预计将于2024年第四季度公布,并可能支持2025年上半年Revumenib在R/R NPM1m AML中的sNDA(补充新药申请)。 在2023年年底,Syndax Pharmaceuticals分享了AUGMENT-101试验关键部分的顶线数据,并且提前停止了这项临床试验,却使公司的股价下跌9%。2024年3月,公司宣布FDA已批准Revumenib的新药上市申请(NDA)优先审评,NDA正在根据FDA的实时肿瘤学审查计划(RTOR)进行审查,并已将PDUFA的目标行动日期定为2024年9月26日。 Axatilimab(SNDX-6352)是一种靶向CSF-1R(集落刺激因子-1受体)的单克隆抗体,与CSF-1R具有高亲和力结合,并阻断两种已知的CSF-1R配体CSF-1和IL-34的结合。CSF-1R是一种被认为可以控制单核细胞和巨噬细胞存活和功能的细胞表面蛋白。在临床前模型中,通过CSF-1受体抑制信号传导已被证明可以减少疾病介导巨噬细胞及其单核细胞前体的数量,这已被证明在慢性移植物抗宿主病(cGVHD)和特发性肺纤维化(IPF)等疾病的纤维化疾病过程中起关键作用。Axatilimab是根据Syndax和UCB于2016年签订的UCB全球独家许可开发的,2021年9月,Syndax和Incyte就Axatilimab签订了全球独家联合开发和联合商业化许可协议。 药融云数据库:药品信息 图源:国家药品监督管理局 Syndax 2023年度的研发费用从上年同期的1.185亿美元增加至1.630亿美元,研发费用的同比增长主要是由于员工相关费用和专业费用的增加以及临床和制造费用的增加;一般、销售和管理费用从上年同期的3330万美元增加到6690万美元,该项的同比增长主要是由于员工相关费用和专业费用的增加以及Revumenib和Axatilimab商业化活动的增加;年度归属于普通股股东的净亏损为2.09亿美元,或每股2.98美元。 截止2024年3月31日,Syndax尚未产生任何产品收入,因为其创造收入和盈利的能力取决于获得候选产品的上市批准并成功商业化的能力。2024年第一季度研发费用从上年同期的3410万美元增至5650万美元,研发费用的增加主要是由于临床开发和制造成本增加、员工相关费用和专业费用增加以及本期确认的开发里程碑费用;一般、销售和管理费用从上年同期的1200万美元增至2300万美元,该项的增加主要是由于员工相关费用和专业费用的增加,以及Revumenib和Axatilimab的商业化活动增加。该季度报告的归属于普通股股东的净亏损为7240万美元,或每股0.85 美元。 截至2024年3月31日,Syndax 拥有5.22亿美元的现金、现金等价物,预计可以支持公司的研究、临床开发和商业运作到2026年。对于第二季度,Syndax预计研发费用为5000~5500万美元,总运营费用为8000~8500万美元。对于2024年全年,Syndax预计研发费用为2.4~2.6亿美元,总运营费用为3.55~3.75亿美元,其中包括预计4300万美元的非现金股票补偿费用。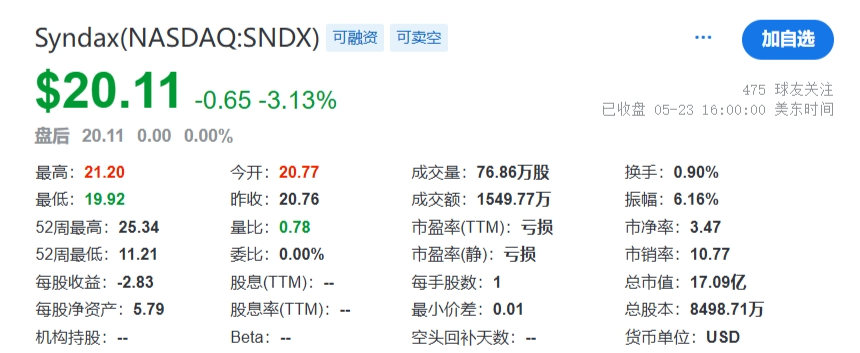


Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China