
近日,卫材(Eisai)和渤健(Biogen)公司宣布,卫材已经完成向美国FDA滚动递交其在研抗β淀粉样蛋白(Aβ)抗体lecanemab(BAN2401)的生物制品许可申请(BLA),用于治疗由于阿尔茨海默病(AD)导致的轻度认知障碍(MCI),以及大脑中具有淀粉样蛋白病理的轻度AD患者。卫材使用加速批准途径递交了这一BLA,并且寻求获得优先审评资格。
5月7日,药监局官网显示,GSK拉米夫定多替拉韦片的新适应症上市申请获批准,推测适应症为:治疗已实现病毒学抑制的HIV感染成人。
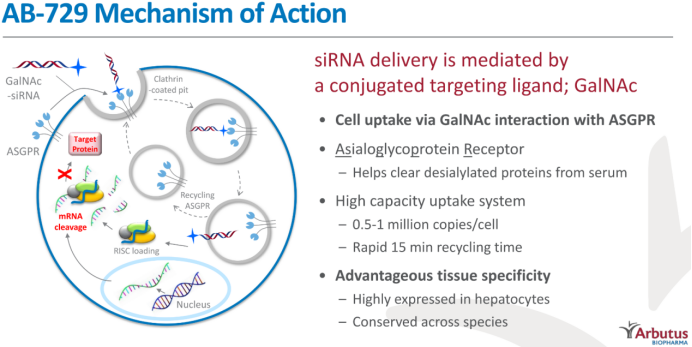
5月10日,CDE官网显示,齐鲁制药/Arbutus公司AB-729注射液临床试验申请获国家药监局正式受理,用于治疗或预防乙型肝炎(HBV)。AB-729是Arbutus领先的RNA干扰(RNAi)治疗药物。去年12月13日,齐鲁制药和Arbutus就AB-729在中国大陆、香港、澳门和台湾的开发和商业化达成独家许可协议和战略合作伙伴关系。
5月10日,石家庄以岭药业宣布,收到由尼日利亚国家食品药品管理局核准签发的药品注册证书,批准该公司连花清瘟胶囊在尼日利亚国家食品药品管理局注册。
5月10日,CDE官网显示,辉瑞的Ponsegromab注射液临床试验申请获受理。这是国内首款申报临床的GDF15单抗,可用于治疗癌性恶病质、实体瘤、厌食症、心力衰竭等。
近日,iSono Health(iSono)宣布美国FDA批准该公司的ATUSA全乳房超声波成像系统。新闻稿指出,这是首款可佩戴的自动化乳房超声波成像系统,具有独特的可佩戴配件,配套软件可进行自动图像采集和分析,用于乳腺癌的诊断。
近日,拜耳(Bayer)宣布,美国FDA已授予口服雄激素受体抑制剂(ARi)darolutamide的补充新药申请(sNDA)优先审评资格 ,联合多西他赛(docetaxel)治疗转移性激素敏感性前列腺癌(mHSPC)患者。这一申请将使用FDA下属肿瘤卓越中心的Orbis试点项目进行审评。
近日,Turning Point Therapeutics公司宣布,美国FDA已授予其主打候选药物repotrectinib突破性疗法认定,用于治疗ROS1阳性转移性非小细胞肺癌(NSCLC)患者,他们曾接受过一种ROS1抑制剂的治疗,并且没有接受过含铂化疗的治疗。这是repotrectinib获得的第三项突破性疗法认定。
近日,创响生物宣布,美国FDA许可了其候选药物IMG-007(一种靶向OX40的单克隆抗体药物)的新药研究申请(IND),进入I期临床开发。IMG-007是创响与和黄医药合作开发的项目。

5月10日,辉瑞公司(Pfizer)和Biohaven Pharmaceutical(以下简称“Biohaven”)宣布,两家公司已经达成协议,辉瑞将以总计约116亿美元收购Biohaven。该公司靶向CGRP的偏头痛疗法Nurtec ODT已经在美国获批用于成人偏头痛的急性治疗和预防性治疗。根据协议条款,辉瑞将收购Biohaven的降钙素基因相关肽(CGRP)项目,包括:rimegepant(美国商品名:Nurtec ODT;欧盟商品名:Vydura);zavegepant——拟用于偏头痛的急性鼻内喷雾治疗,并正在开发作为口服软胶囊用于慢性偏头痛的预防;以及5个靶向CGRP的临床前项目。
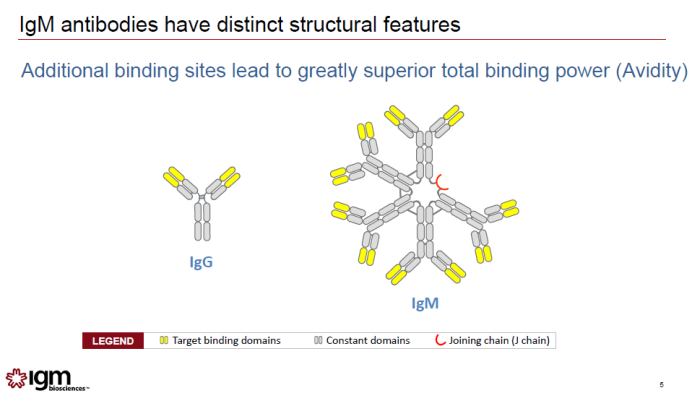
近日,IGM Biosciences宣布与赛诺菲达成的全球性研发合作正式启动。将利用IGM Biosciences公司独有的IgM抗体技术平台,开发针对三个肿瘤学靶点和三个免疫学/炎症靶点的激动剂。赛诺菲将向IGM支付1.5亿美元的前期付款。IgM是身体中生产的一种抗体类型,与通常的IgG抗体不同的是,它们具有10个可以与抗原结合的位点,这一特征可以提高它们与靶点的亲和力。IgM抗体的高亲和力让它们可以与难于结合或者在细胞表面表达量低的靶点强力结合,而且,它们具有与细胞表面的多个靶点同时结合的能力。这一合作旨在开发一种新的潜在治疗模式,利用IgM的多价特性构建更好激活细胞表面受体的激动剂。在1.5亿美元前期付款之外,IGM有资格获得潜在超过60亿美元的开发、监管和商业化里程碑付款。
5月5日,阿斯利康宣布,达格列净(dapagliflozin,商品名:Farxiga)的III期临床试验(DELIVER)达到主要研究终点,在降低心血管(CV)死亡或心力衰竭(HF)恶化方面实现了具有统计学和临床意义的改善。加上此前DAPA-HF的临床结果,证明无论射血分数(EF)如何,达格列净均可有效治疗心衰。达格列净是一款口服钠-葡萄糖协同转运蛋白2(SGLT2)抑制剂,目前已在美国获批4项适应症,分别为:1)2型糖尿病;2)降低2型糖尿病或其他心血管死亡风险患者的心衰住院风险;3)降低HFrEF患者的心血管原因死亡或心衰恶化风险;4)慢性肾病。
5月9日,强生宣布,旗下杨森终止与Bavarian Nordic公司的合作和许可协议。该协议的主要内容是:利用Bavarian Nordic公司的MVA-BN技术,开发针对乙型肝炎病毒和人类乳头瘤病毒的潜在疫苗。目前,强生尚未使用该技术开发乙肝疫苗。此前,根据该交易的条款,杨森支付了900万美元,另外还有超过1.6亿美元的 biobucks可供争夺。杨森负责开发成本,而Bavarian Nordic负责制造成本。
5月3日,翰森制药集团宣布,全资附属公司翰森(上海)健康及江苏豪森药业(统称为被许可人)与NiKang Therapeutics Inc.订立独家许可协议。根据许可协议,被许可人获得NiKang Therapeutics的独家许可,以于中国(包括香港、澳门及台湾)开发及商业化NKT2152用于肿瘤的治疗。被许可人将负责NKT2152于中国的开发、注册审批及商业化,并将支付1500万美元首付款及最多2.03亿美元的开发、注册及基于销售的商业化里程碑潜在付款,以及基于净销售额的分级特许权使用费。NKT2152是一种抑制HIF-2α的小分子,目前正开展I/II期剂量递增及扩展试验(NCT05119335)。该试验旨在评估对晚期透明细胞肾细胞癌(ccRCC)患者的安全性、耐受性、药代动力学、药效学及临床活性。
5月4日,美诺华(603538)发布公告称,公司与济民可信投资签订了《战略合作暨股权转让框架协议》,拟将持有的燎原药业84.57%股权转让给济民可信投资,交易对价为5.37亿元,全部以现金支付。同时,双方基于各自产业优势与需求,达成(针对创新药CDOM业务等)战略合作意向。根据协议,济民可信应将美诺华作为自身以及关联公司的创新药技术研发或/和定制生产服务(“创新药项目”)CDMO领域的重要合作伙伴,并在未来五年内不定期向美诺华提供的CDMO项目(包括但不限于创新药项目)进行评估,并保障美诺华优先评估、优先谈判和在同类条件下优先签约。美诺华应保障济民可信项目(包括但不限于创新药项目)在自身研发、生产基地的优先评估、优先排产和优先交付。
本文摘自---生物经纬
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China