从2013年首次宣布CRISPR-CAS9系统可以应用于哺乳动物开始,CRISPR技术因其高效率、易操作和低成本,正在基因编辑领域掀起一场新的革命。
一、最新研究进展:
1、Nature Biotechnology:升级版基因编辑系统,效率翻倍,助力CAR-T疗法的高效制造
8月25日,加州大学旧金山分校研究团队的一项研究成果以题目“High-yield genome engineering in primary cells using a hybrid ssDNA repair template and small-molecule cocktails.”发表于《自然》杂志的子刊《自然-生物技术》上,该研究发现了一种低毒性、高效、并且无需借助病毒的CAR-T细胞制造方法,科研人员开发了一种新型基因编辑方法,该方法以单链DNA(ssDNA)作为同源定向修复模板,其中包含了毒性较低的Cas9目标序列。相对于dsDNA的Cas9目标序列,其敲入效率和产量平均提高了约2-3倍。

8月27日,中国科学院上海营养与健康研究所王泽峰团队在Nucleic Acids Research上,发表长文ProgrammableRNAbaseeditingwithasinglegRNA-freeenzyme。该研究报道了一种单一组分的新型可编程RNA单碱基编辑系统REWIRE(RNAeditingwithindividualRNA-bindingenzyme),可在人体细胞中实现高达60%-80%的A-to-I或C-to-U编辑。该系统利用一种人源PUF蛋白来靶向识别RNA序列。PUF蛋白包含一个RNA结合域,称Pumilio同源域或PUF域。RNA结合域通常由八套36个氨基酸的重复序列组成。每个重复序列上有三个氨基酸残基在和RNA的结合中具有重要作用。通过对可编程PUF结构域的设计和对其长度的优化,该系统可实现对8-10nt的目标序列精准定位高效编辑靶标的同时降低脱靶效应。
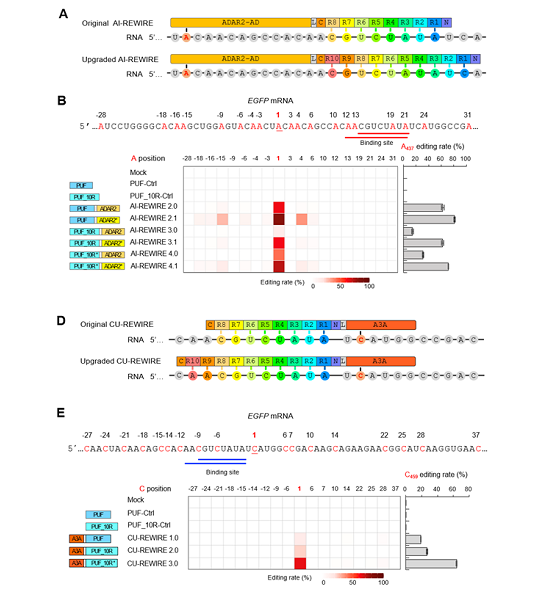
REWIRE系统及其优化策略
REWIRE提供了一种无需借助gRNA的单一人源蛋白组分RNA单碱基平台,其精确定位、低脱靶效应的特点为生命科学领域的研究带来更多可能。研究将REWIRE与已有的基于CRISPER/Cas的REPAIR编辑策略进行综合评比,指出REWIRE在脱靶率相当时的编辑效率具有明显优势,因而未来的应用前景更加广阔。目前,该研究团队在探索后续转化研究的可能,以期为一些目前临床需求迫切且尚无应对策略的遗传性疾病提供新的治疗思路。
4、Science:我国科学家开辟哺乳动物染色体编辑新领域首次全球实现哺乳动物完整染色体可编程连接
8月26日,国际学术期刊《科学》(Science)在线发表了中国科学院动物研究所、北京干细胞与再生医学研究院研究员李伟与周琪团队合作完成的研究论文(A sustainable mouse karyotype created by programmed chromosome fusion)。
该研究在全球首次实现了哺乳动物完整染色体的可编程连接,并创建出具有全新核型(染色体组型)的小鼠。

该论文报道了Craspase(CRISPR偶联的蛋白酶新系统,CRISPR associated Caspase)是一个gRNA引导靶向,并且受到靶向RNA激活的蛋白酶,该蛋白酶受到激活之后可以对天然的蛋白底物进行切割并诱导细胞死亡。在精准医疗新时代背景下,该工具有望引领出全新的精准医疗思路。
6、Nature:CRISPR-Cas9基因编辑系统R-loop形成和活化的结构基础
Cas9 是一种 CRISPR 相关的核酸内切酶,能够进行 RNA 引导的位点特异性 DNA 切割。Cas9 的可编程活性已被广泛用于基因组编辑,但其靶 DNA 结合和脱靶辨别的精准机制仍未完全了解。8月24日,来自瑞士苏黎世大学的Martin Jinek实验室在Nature发表题为R-loop formation and conformationalactivation mechanisms of Cas9的论文。

该研究解析了一系列酿脓链球菌Cas9 的冷冻电镜结构,捕获了靶 DNA 杂交的定向过程。在R环形成的早期阶段,Cas9 REC2 和 REC3 结构域形成一个带正电荷的裂隙以容纳目标DNA双链的远端。经过种子区的靶向杂交过程引发了REC2 和 REC3 结构域的重排和HNH核酸酶结构域的重定位,以呈现无催化能力的检查点构象。这些结果为Cas9的靶向DNA 依赖性激活建立了一个结构框架,揭示了其构象检查点机制,并可能促进新的Cas9突变体的开发,以及具有增强特异性和活性的向导RNA的设计。
7、Signal Transduction and Targeted Therapy:平渊团队开发双重特异性CRISPR/Cas纳米系统,用于肝脏疾病防治
8月12日,浙江大学药学院平渊课题组在Signal Transduction and Targeted Therapy期刊发表了题为:A dual-specific CRISPR-Cas nanosystem for precision therapeutic editing of liver disorders 的论文。该团队构建了一种双重肝脏特异性Cas介导的DNA或RNA编辑系统,为炎症性肝脏疾病的精准治疗提供了全新策略。


该研究表明,在细菌和古菌(统称为原核生物)中,与真核生物NLR类似的先天免疫系统也很普遍,这些NLR样基因共有4个家族,是两个高度保守的噬菌体蛋白的特异性传感器。与目标结合时,这些NLRs激活不同的效应域,切割双链DNA,诱导细菌死亡,以防止噬菌体的传播。这项研究发现了细菌和古菌能够通过直接检测入侵病毒的关键蛋白并导致“自杀”,从而平息病毒在微生物群落中的传播,这也是首次在原核生物钟发现这种机制,该研究发现了涵盖了细菌、古菌和真核生物这三域的所有生命都在使用的病原体特异性识别模式。
9、Nature Biotechnology:基因编辑新突破:脑智卓越中心开发出特异性更高、安全性更好的高保真版Cas13系统
8月11日,辉大基因首席科学顾问杨辉研究员带领的课题在《Nature Biotechnology》发表题为“High-fidelity Cas13 variants for targeted RNA degradation with minimal collateral effects”的文章。该研究综合利用蛋白质改造工程、流式细胞术、体外切割实验、全转录组测序、转基因小鼠、在体基因治疗安全性验证等技术手段,对Cas13(包括Cas13d和Cas13X)进行蛋白工程化改造、筛选及验证,开发出了具有高效编辑活性但极低旁切活性的高保真Cas13蛋白变体,对基于RNA编辑的基础科学研究、基因治疗策略研发以及后续的临床转化具有重要意义。
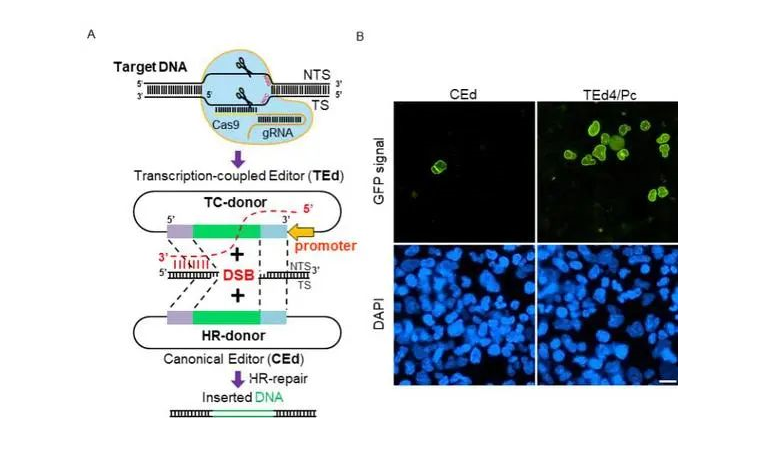
图A, 转录耦合编辑器TEd与CEd传统编辑方法差别。图B, 使用TEd系统的细胞中可以观察到有较CEd更多的环绕核膜的GFP荧光信号出现(LMNA-GFP整合),表明TEd系统可以更高效地在目标位点插入GFP标签。

12、Nucleic Acids Research:天津工生所在维生素工业菌种基因编辑方面取得进展
中国科学院天津工业生物技术研究所研究员张大伟团队在苜蓿中华根瘤菌基因编辑方面取得进展,相关研究成果以“A versatile Cas12k-based genetic engineering toolkit (C12KGET) for metabolic engineering in genetic manipulation-deprived strains”于8月3日发表在Nucleic Acids Research。他们构建了一个不依赖同源重组的基因编辑工具(C12KGET,versatile Cas12k-based genetic engineering toolkit ) ,可以在苜蓿中华根瘤菌中实现基因组多基因编辑及大片段高效插入。10kb的大片段插入效率最高达100%。通过改造维生素B12的途径基因,维生素B12的产量得到明显提高。另外,Cas12k蛋白具有非活性的核酸酶结构域,可以直接用来对基因进行转录调控,效率可达92%。该工具也可用在大肠杆菌和希瓦氏菌属中,为其他内源同源重组效率低的物种提供借鉴。研究工作得到国家重点研发计划、国家自然科学基金和天津市合成生物技术创新能力提升行动的支持。
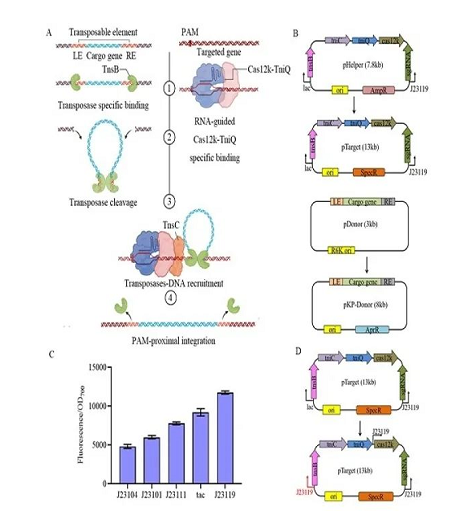
高效基因整合示意图
13、PNAS:刘志勇/陆发隆合作采用基因编辑技术揭示小鼠耳蜗调控听觉毛细胞发育新机制
8月5日,中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)、神经科学国家重点实验室、上海脑科学与类脑研究中心刘志勇研究组与中科院遗传与发育生物学研究所陆发隆研究组合作在PNAS在线发表了文章Three distinct Atoh1 enhancers cooperate for sound receptor hair cell development,(三个不同的Atoh1增强子协同调控声音受体毛细胞发育)。

该研究解析了新生小鼠耳蜗毛细胞的全基因组开放染色质图谱,发现和验证了两个之前未知的Atoh1增强子。研究利用CRISPR/Cas9技术敲除单个或同时敲除多个Atoh1增强子,揭示了Atoh1的三个增强子以剂量依赖性协同调控毛细胞发育。该工作为Atoh1表达的精准表观遗传学调控机制提供了更深入的理论依据,并为耳蜗毛细胞再生提供了新的潜在靶点。
二、产业方面进展:
1、8月23日,Verve Therapeutics宣布,临床前实验研究支持将公司的第二款候选基因疗法VERVE-201推入临床开发阶段。VERVE-201是一款单碱基编辑基因疗法,通过对肝脏中胆固醇和甘油三酯代谢的关键调节因子ANGPTL3基因进行基因编辑,永久性关闭ANGPTL3的表达,以达到降脂目的。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China