新药开发难于上青天!
“基于结构的药物设计、创立早期与日本公司合作免疫抑制剂、首先上市了抗病毒药物、现在专注于罕见疾病”这样的描述可能很容易让人想到制药界的现象级黑马福泰制药。本篇内容我们主要挖掘了一家乍一看与福泰制药有许多相似之处的公司,这家公司同样诞生于1980年代,经历了几次转型,现在是一家管线精简,领域较为专注的制药公司。
BioCryst Pharmaceuticals是一家全球性的生物技术公司,致力于改善补体介导疾病和其他罕见疾病患者的生活。BioCryst利用其在结构引导药物设计方面的专业知识,开发first-in-class或best-in-class的口服小分子和蛋白质疗法,以靶向难以治疗的疾病。BioCryst已经将ORLADEYO®(berotralstat)商业化,这是首款口服的、每日一次的血浆激肽释放酶抑制剂,用于治疗遗传性血管性水肿(HAE)。
截图自药融云数据库
BioCryst是一家拥有悠久历史的生物技术公司,在药物发现、开发和商业化方面拥有30多年的经验。其发展历程充满了起起落落、学习与洞察、失败与成功。
1986年,BioCryst成立于美国阿拉巴马州伯明翰市,由当地商人William Spencer三世、阿拉巴马大学伯明翰分校生物化学晶体学教授兼大分子晶体学中心主任Charles Bugg博士和John Montgomery博士共同创立。1988年,Yarlagadda S. Babu博士加入BioCryst成为其第一位员工,目前他依然担任公司的首席发现官(CDO)。1994年,BioCryst公司在纳斯达克上市(NASDAQ:BCRX),同一年,联合创始人Charles Bugg博士被任命为BioCryst的董事长兼首席执行官,直到2007年退休。
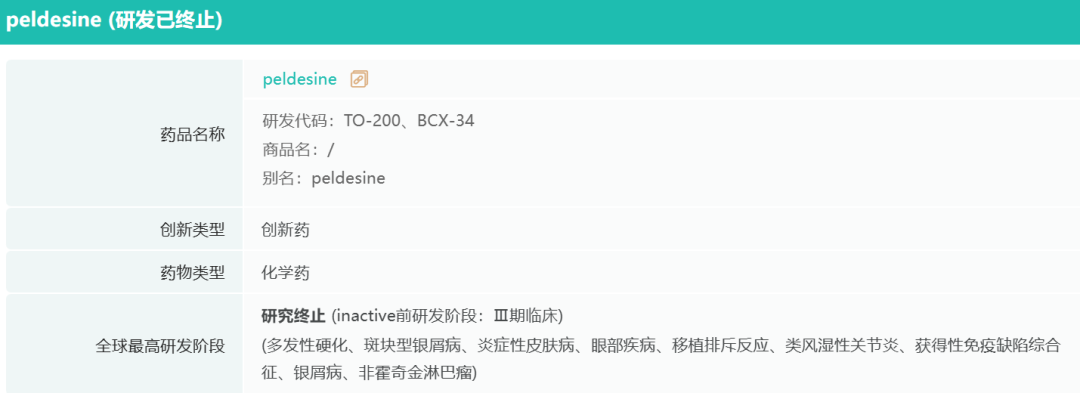
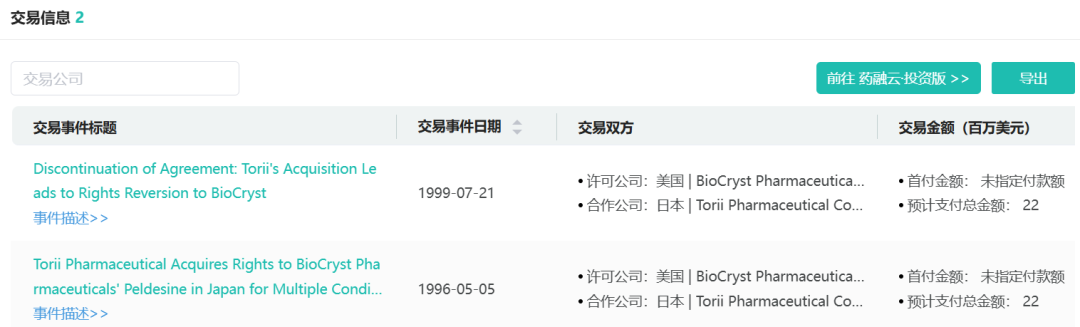
1997年,BioCryst与日本鸟居制药(Torii Pharmaceutical)建立合作,共同开发一种用于治疗类风湿性关节炎、T细胞癌和特应性皮炎的PNP抑制剂BCX-34。然而鸟居制药在1998年被日本烟草收购,该协议随之解除,BioCryst重获权益。药融云数据www.pharnexcloud.com显示,BCX-34(Peldesine)的研究已终止。
截图自药融云数据库
1998年,BioCryst和强生公司达成了一项全球合作,专注于开发流感药物。据了解,该项目研究团队由Babu博士领导,研发代号为BCX-1812。然而口服BCX-1812无法充分进入血液,难以达到治疗效果,3年后(2001),强生公司终止合作。BioCryst也在2002年暂停了研究工作。但随后爆发的甲型(H5N1)禽流感病毒改变了BCX-1812的命运。2005年,BioCryst获得美国FDA批准,重启BCX-1812的人体研究,这一次BCX-1812被改为静脉注射制剂,疗效得到了大幅提升。2006年,BioCryst在北卡罗来纳州的三角地区建立了第一家工厂,该工厂专注于支持临床开发和监管工作。据了解,美国卫生及公众服务部与BioCryst签订了价值2.348亿美元合同,以促进BCX-1812的开发。BCX-1812便是日后重要的抗流感病毒药物帕拉米韦,一种病毒神经氨酸酶抑制剂。2009年,美国FDA在H1N1流感大流行期间首次颁发了帕拉米韦的紧急使用授权。
在美国以外,BioCryst与韩国绿十字公司(2006)和日本盐野义制药(2007)分别建立了合作,共同开发帕拉米韦注射液。2010年1月,盐野义制药在日本获得了帕拉米韦的批准,用于治疗单纯季节性流感的成人、儿童和婴儿,以及那些有流感相关并发症的高危患者,标志着BioCryst发现的药物首次获得监管批准,该药物以RAPIACTA®为商品名在日本上市销售。当年8月,绿十字公司在韩国获得了帕拉米韦的批准,用于治疗A型和B型流感病毒,包括H1N1大流行和禽流感,商品名为PERAMIFLU。2014年,BioCryst的RAPIVAB®(帕拉米韦注射液)首次获得FDA完全批准,3年后,儿科适应症获批。
2013年开始,BioCryst调整管线战略,专注于其遗传性血管性水肿(HAE)和抗病毒项目,HAE核心项目分子BCX7353于当年9月被发现,也就是后来的ORLADEYO®(berotralstat)。2019年,BioCryst与日本鸟居制药再度“牵手”,签订了在日本商业化berotralstat的许可协议。随后BioCryst又与多家公司建立了合作伙伴关系,以推动该药在美国以外的地区商业化,包括Neopharm Group,NewBridge Pharmaceuticals,Pint Pharma,Swixx BioPharma和Er-Kim Pharmaceuticals。ORLADEYO®(berotralstat)于2020年12月获得FDA批准,当月便启动销售,此后已在全球多个市场推出。
2021年,BioCryst启动了其口服因子D抑制剂BCX9930在补体介导疾病中的关键试验。2022年,BioCryst改进了其产品线战略,专注于补体介导的疾病,宣布推出下一代口服因子D抑制剂BCX10013。
目前,BioCryst的总部已迁至美国北卡罗来纳州达勒姆,欧洲总部位于爱尔兰都柏林,卓越探索中心扎根于公司的创始之地——阿拉巴马州伯明翰,并在世界各地设有许多其他区域办事处。首席执行官Jon Stonehouse于2007年从默克公司加入BioCryst,首席医学官William P. Sheridan博士于2008年从安进公司加入BioCryst。
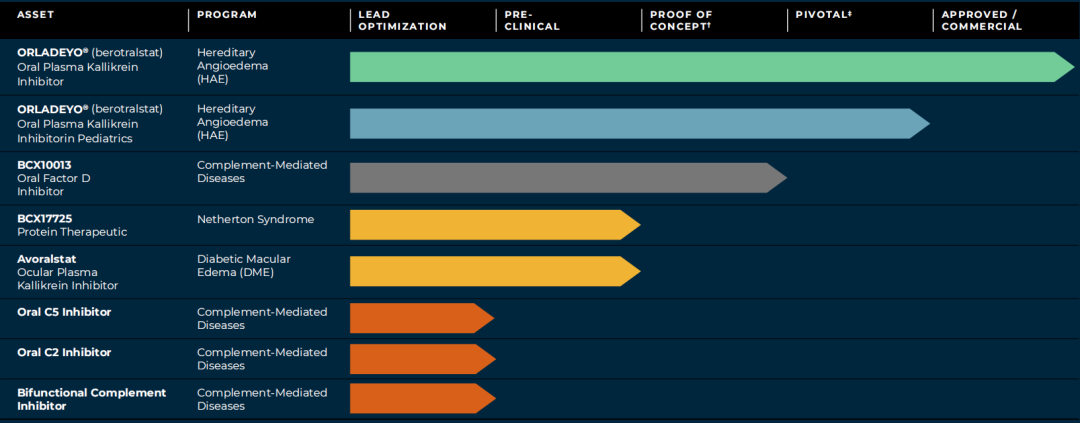
BioCryst目前的研发管线主要围绕补体介导的疾病和其他罕见病,适应症领域横跨过敏/免疫学、皮肤科、肾病学、神经病学、血液学以及眼科。
ORLADEYO®(berotralstat)是BioCryst发现和开发的一种血浆激肽释放酶抑制剂,每日一次口服,用于预防成人和12岁及以上儿童患者遗传性血管性水肿(HAE)的发作。该药是第一个也是唯一一个针对遗传性血管性水肿的靶向口服预防性疗法,还是首款预防HAE发作的口服非甾体药物,于2020年12月获得FDA批准上市,目前已在全球多个市场推出。
遗传性血管性水肿(HAE)是一种可能危及生命的罕见疾病,患病率在1/33000到1/67000之间。该病由一种称为C1酯酶抑制剂(C1-INH)的蛋白质的遗传缺陷引起。C1-INH在防止缓激肽形成系统过度活跃和介导HAE肿胀方面起着重要作用。HAE症状包括不同部位反复水肿,包括手、脚、面部、生殖器和气道。气道肿胀特别危险,可导致窒息死亡。此外,患者常出现由肠壁肿胀引起的严重腹痛、恶心和呕吐。如不及时治疗,HAE患者通常每个月都会有多次发作,每次发作的肿胀可持续2到4天。
2023年1月,ORLADEYO®(berotralstat)用于治疗2-12岁儿童遗传性血管性水肿(HAE)的关键研究APeX-P正式启动,并在2024年5月6日完成患者入组。BioCryst预计该试验的数据将支持在2025年在美国递交一份sNDA申请,使ORLADEYO®标签扩展至2岁以上儿童HAE患者,届时该药将成为首个儿童HAE的口服预防性药物。BioCryst针对儿童患者专门开发了ORLADEYO®的小儿颗粒剂型。

同时,BioCryst正在研究其他针对补体系统的经典途径、凝集素途径、终末途径和替代途径的口服药物和蛋白质疗法。
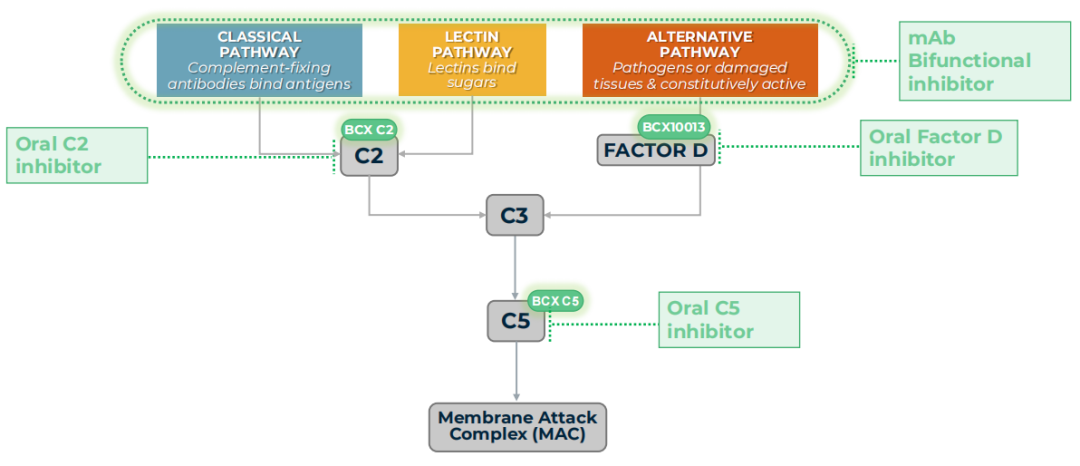
BCX10013是BioCryst在研的每日一次的口服补体因子D抑制剂,可靶向补体系统的替代途径。因子D是补体替代途径中必不可少的酶,因此因子D是解决补体介导疾病的一个潜力靶点。
2023年8月,BioCryst宣布启动BCX10013针对阵发性夜间血红蛋白尿(PNH)患者的剂量范围试验。2023年11月3日,BioCryst在研发日活动上展示了160 mg队列健康志愿者试验的数据,该数据强调了在该剂量水平下达到的替代途径抑制的强度和持续时间,支持每日一次给药的临床剂量。
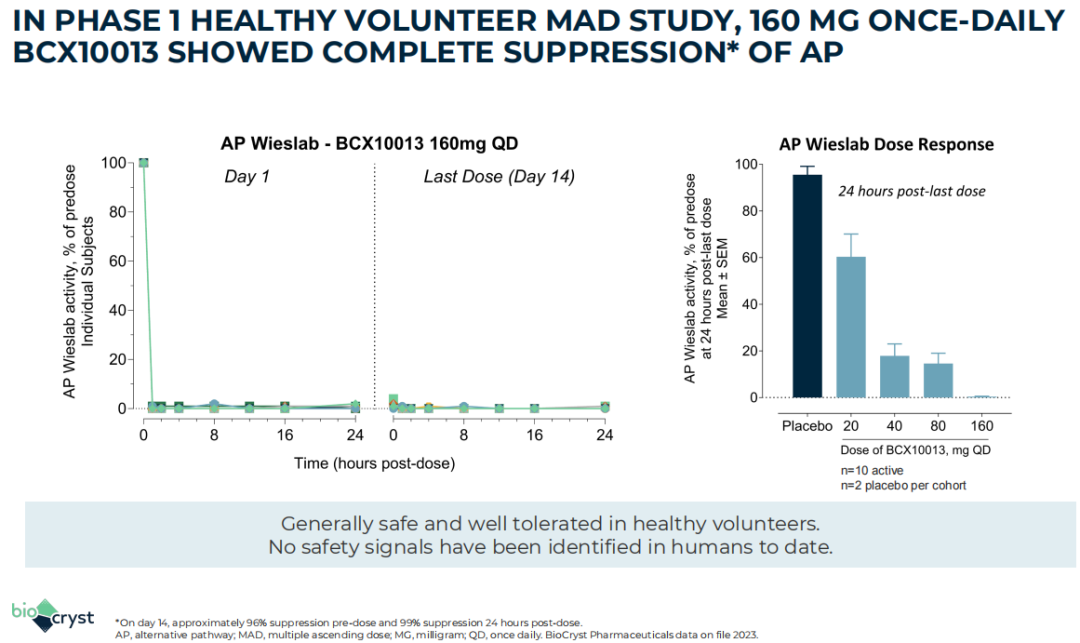
2024年1月,BioCryst宣布BCX10013正在进行的概念验证临床试验若取得best-in-class数据,公司计划向合作伙伴授权BCX10013的后期开发和商业化权益,据披露,目前该试验仍在进行中,公司预计将在今年晚些时候对外合作或停止该项目。
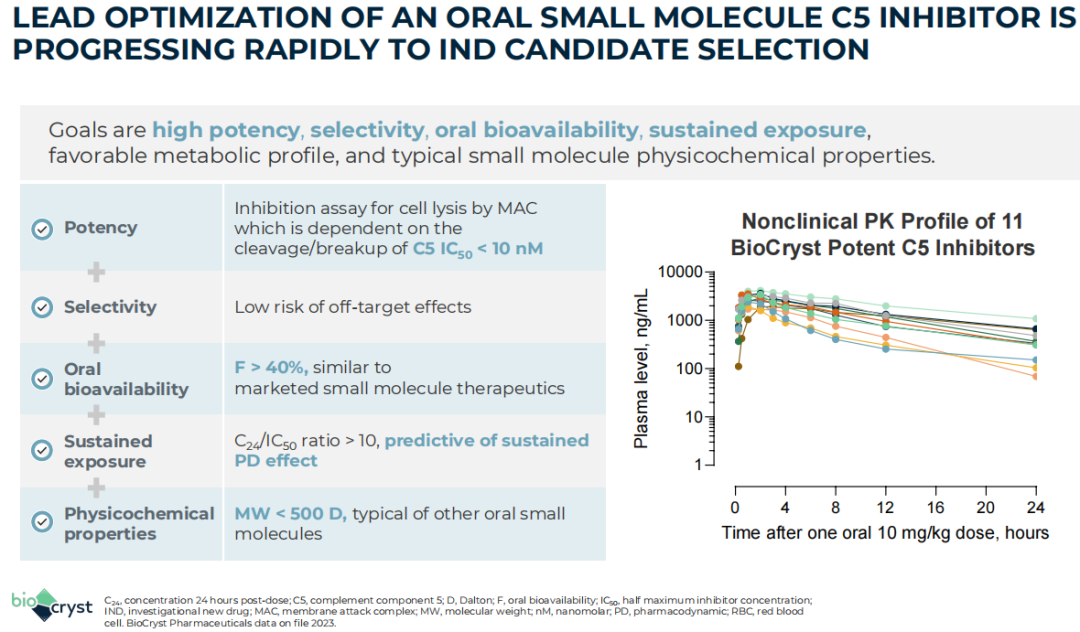
2023年11月3日研发日活动上,BioCryst宣布正在开发一种口服补体C5抑制剂,与目前批准的注射和输注型抗C5疗法相比(如依库珠单抗和Ravulizumab),这可能是首款口服靶向疗法。该公司表示,该药有望使全身性重症肌无力(gMG)患者转变治疗模式,并在疾病早期就开始治疗。gMG是一种慢性自身免疫性神经肌肉疾病,临床表现为全身骨骼肌收缩无力,在运动后恶化。
同日官宣的还有一款双功能补体抑制剂抗C2单克隆抗体,它也可以抑制补体系统的替代途径。该研究性候选药物有可能成为补体系统的经典、凝集素和替代途径的first-in-class联合抑制剂,以治疗复杂的补体介导肾脏疾病,如免疫球蛋白A肾病(IgAN)和狼疮性肾炎,这些疾病受多种补体途径的影响。

另外,该公司还宣布正在开发一种经典途径和凝集素途径补体抑制剂,用于治疗自身免疫性溶血性贫血,包括冷凝集素病(CAD)和温抗体型自身免疫性溶血性贫血(wAIHA)。目前治疗CAD和wAIHA等疾病的药物也是注射和输注剂型,BioCryst开发了一种口服补体C2抑制剂有望转变患者治疗模式。从作用机制上看,抑制C2可以通过阻断经典途径和凝集素途径来减少自身免疫性溶血性贫血的红细胞破坏(溶血)。

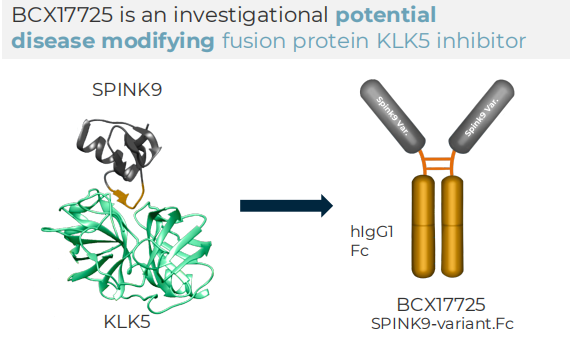
BioCryst开发的BCX17725是一种选择性融合蛋白KLK5抑制剂,旨在为内瑟顿综合征患者提供潜在best-in-class的疾病修饰治疗。内瑟顿综合征(Netherton syndrome, NS)是一种罕见的,终身的遗传性疾病,常出现在新生儿或婴儿期。该病是由KLK5的天然抑制剂(SPINK5)基因功能丧失突变引起,KLK5是一种负责调节皮肤脱落的丝氨酸蛋白酶。患者皮肤表现为红色、鳞状和发炎,易发生反复的免疫反应。内瑟顿综合征可能危及生命,特别是在婴儿期,患者容易脱水和反复感染。目前尚无药物获批治疗该病。该公司预计在2024年底将BCX17725推向临床,目标在2026年提供针对内瑟顿综合征的概念验证结果。
Avoralstat是BioCryst开发的一种血浆激肽释放酶抑制剂,先前其口服制剂被研究用于治疗遗传性血管性水肿(HAE)并开展了3期试验,根据药融云数据www.pharnexcloud.com提供线索,该药针对HAE开展的3期研究并未取得积极结果。
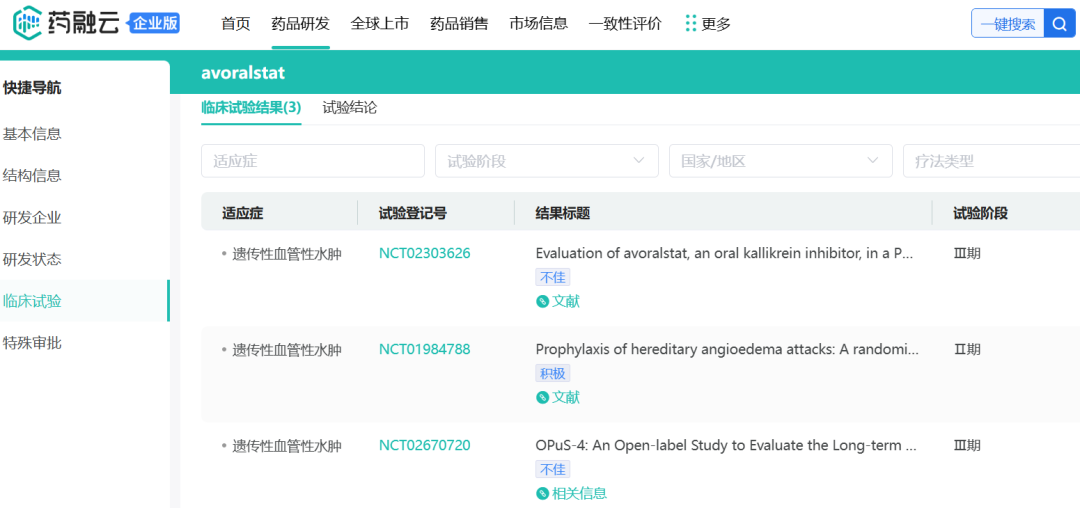
截图自药融云数据库
不过此前的研究显示,Avoralstat具有高效力和低溶解度,该公司认为这两个特征对于治疗糖尿病黄斑水肿(DME)的同时降低患者眼部给药频率十分重要。
2023年11月3日,BioCryst宣布与Clearside Biomedical签订了许可协议,使用Clearside的SCS Microinjector®注射技术,通过脉络膜上腔间隙将Avoralstat递送到眼底,治疗糖尿病黄斑水肿(DME)患者。DME是糖尿病患者视力丧失的最常见原因,尽管有每月注射的抗血管内皮生长因子(VEGF)疗法,但至少有三分之一的患者持续患有DME。
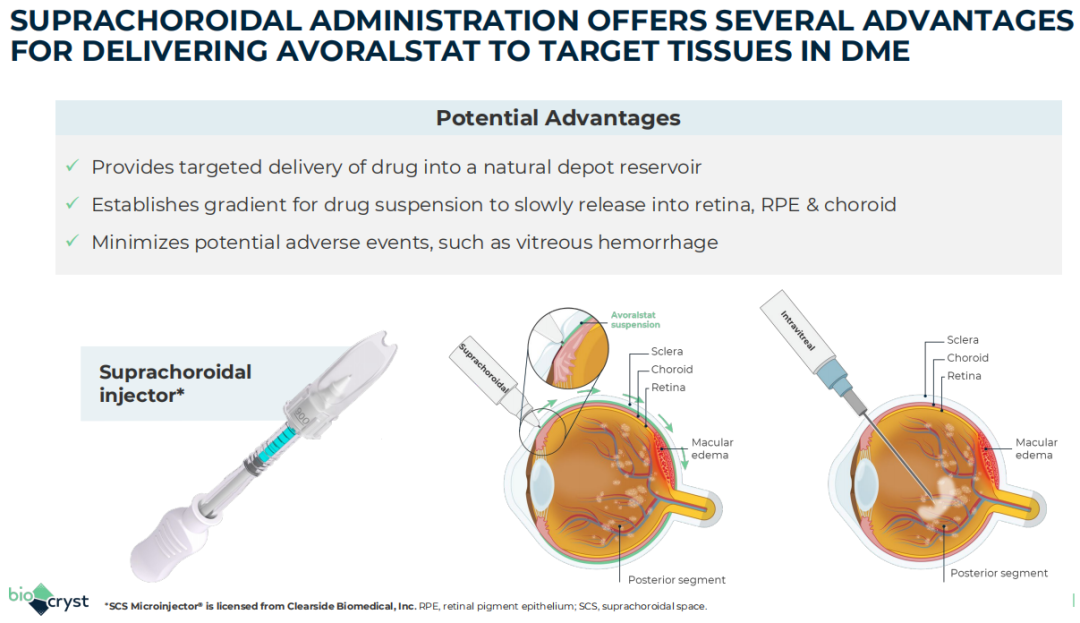
根据许可协议,Clearside Biomedical获得500万美元的预付许可费,并有资格获得高达3000万美元的临床和监管里程碑付款,以及三次批准后的里程碑付款,基于销售的里程碑付款总计4750万美元。BioCryst计划在2025年推进该药针对DME患者的临床试验。公司预计Avoralstat有望成为DME领先的2线治疗方法。
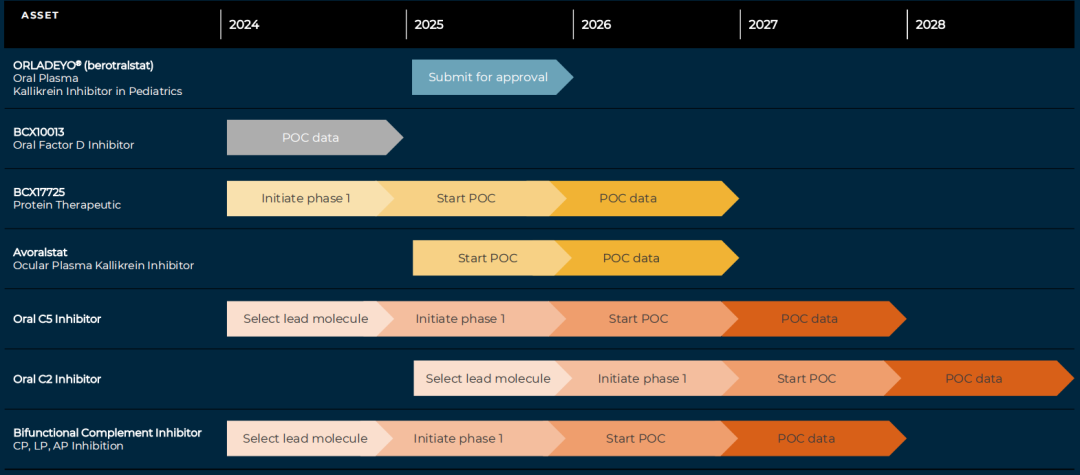
BioCryst计划在未来5年内提供6个分子的概念验证数据,下图为BioCryst研发管线预期里程碑:
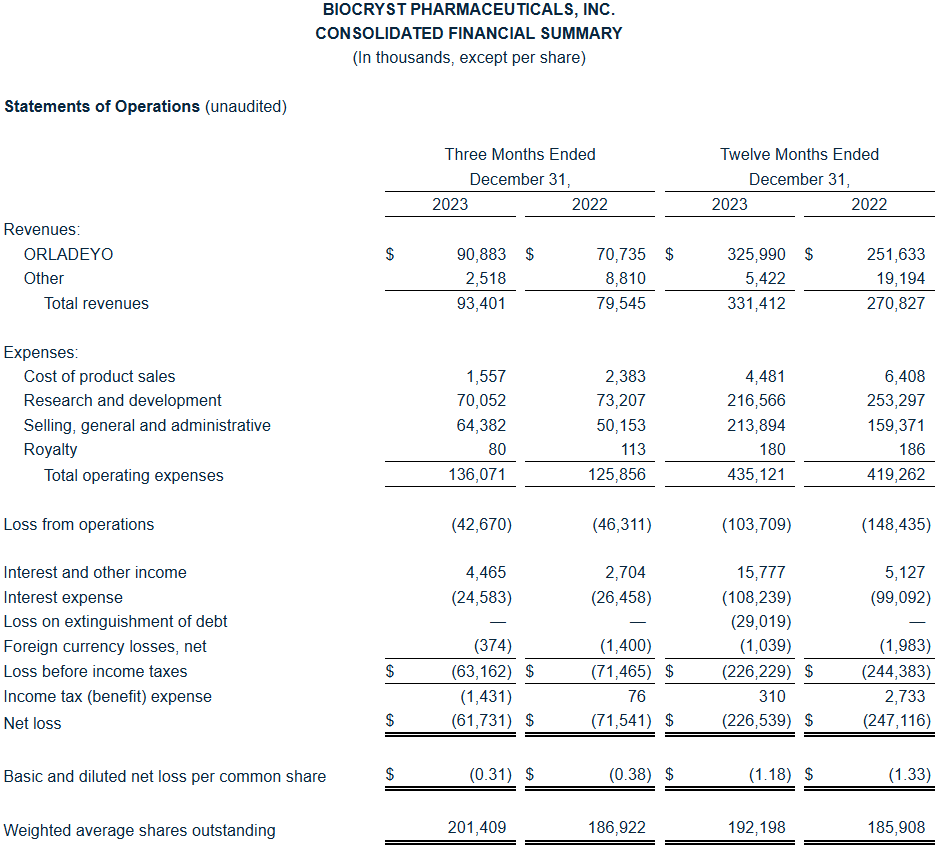
2023全年,BioCryst公司总收入为3.314亿美元(约合24亿人民币),其中ORLADEYO®(berotralstat)净收入达3.26亿美元,同比增长30%;全年R&D费用为2.166亿美元,同比减少14%,主要是由于BCX9930和BCX9250研发终止;全年的SG&A费用增至2.139亿美元,同比增长34%,主要是由于增加投资扩大和加强美国商业团队,以及扩大国际业务。全年利息支出为1.082亿美元,而2022年全年为9910万美元;其他费用主要包括偿还定期贷款的债务清偿损失2900万美元,以及100万美元的净外汇损失。2023年全年净亏损为2.265亿美元,或每股1.18美元,而2022年全年净亏损为2.471亿美元,或每股1.33美元。
2023全年BioCryst研发开支分布:
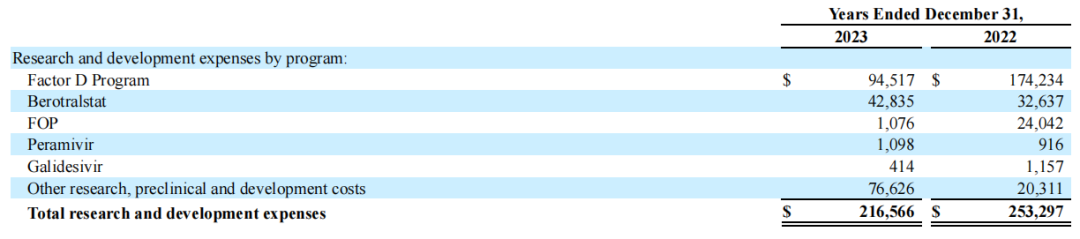
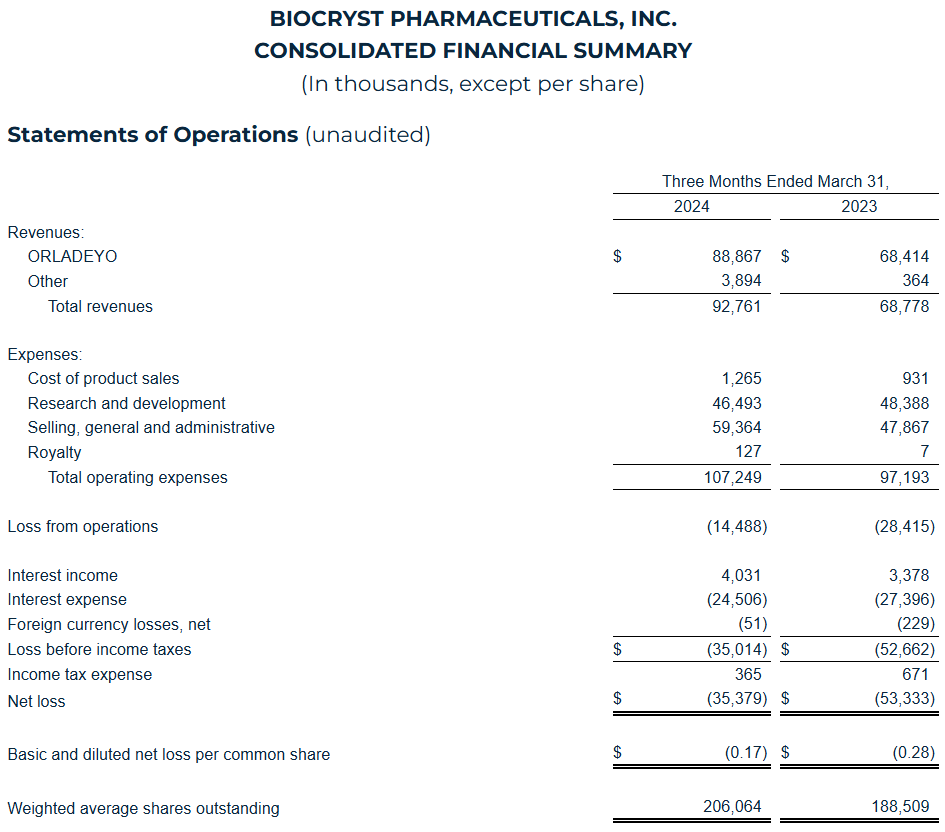
2024年第一季度,BioCryst公司总收入为9280万美元,同比增长34.9%,其中ORLADEYO®(berotralstat)净收入为8890万美元,同比增长30%;第一季度R&D费用为4650万美元,同比减少3.9%,主要是由于公司计划将BCX10013项目对外授权或者终止后期开发导致的支出减少,以及终止BCX9930项目;SG&A费用增至5940万美元,同比增长24%。第一季度利息支出为2450万美元,同比减少10.6%。2024年第一季度净亏损为3540万美元,或每股0.17美元,而2023年第一季度的净亏损为5330万美元,或每股0.28美元。
2024年Q1BioCryst研发开支分布:
截至2024年3月31日,现金、现金等价物、限制性现金和投资总额为3.384亿美元,去年同期为4.031亿美元,公司预计到2024年底,现金总额将超过3亿美元。
由于第一季度ORLADEYO®(berotralstat)在美国的销售表现优于预期,BioCryst预测该产品2024全年全球净收入在3.9亿美元至4亿美元之间,预计公司2024年全年运营费用将在3.65亿美元至3.75亿美元之间,与2023年全年运营费用持平。基于此,BioCryst有信心在2024年实现全年营业利润(不包括非现金股票薪酬),2025年下半年季度每股收益(EPS)接近为正,现金流为正(不包括非现金股票薪酬),并在2026年全年实现每股收益盈利,现金流为正。
BioCryst预期2029年ORLADEYO®(berotralstat)在美国的业绩将达到8亿美元,该药的全球销售峰值有望达到10亿美元。
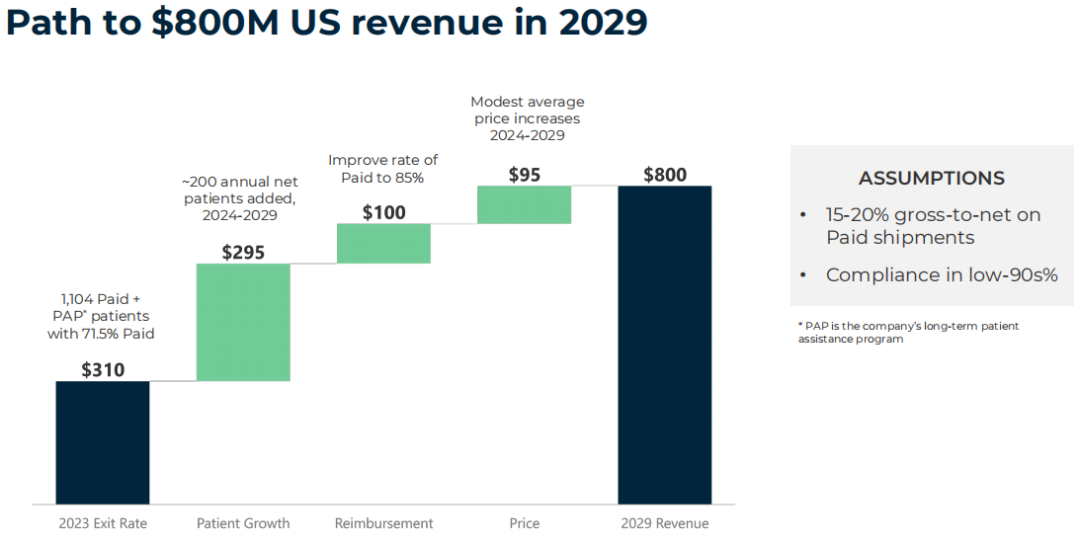
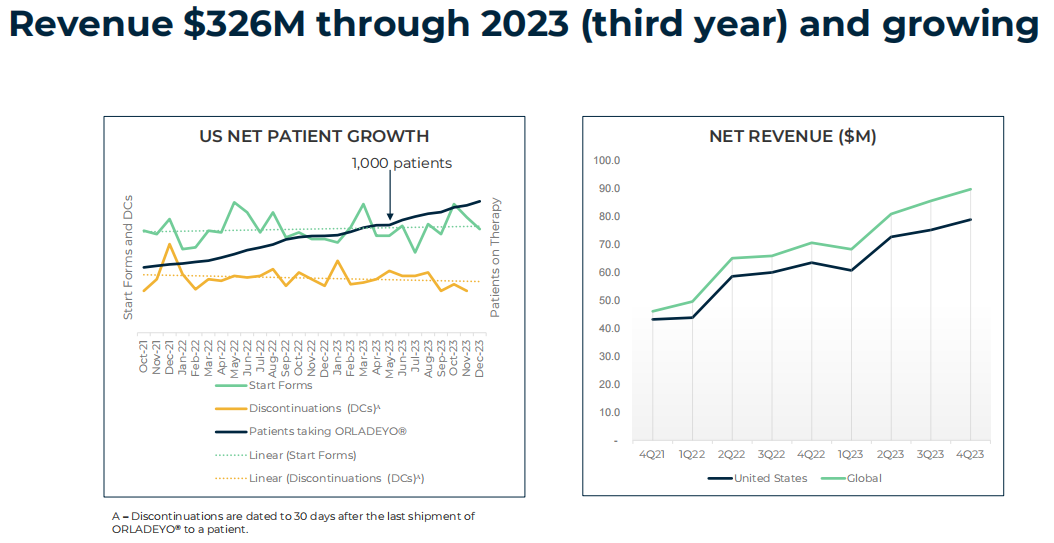
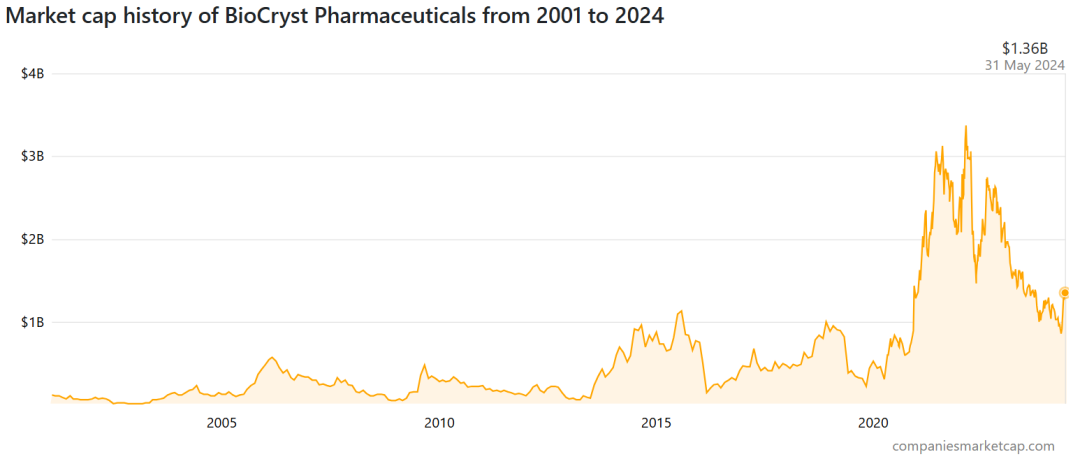
截至2024年5月底,BioCryst总市值为13.6亿美元。发稿前为12.75亿美元(约合92亿),每股6.18美元。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China