药融圈获悉:Ocular Therapeutix(纳斯达克股票代码:OCUL)是一家专注于视网膜疾病的生物制药公司,通过其专有的生物可降解水凝胶技术平台ELUTYX,为视网膜疾病患者提供长效治疗方案,包括湿性AMD(年龄相关性黄斑变性)、NPDR(非增殖性糖尿病视网膜病变)、DME(糖尿病黄斑水肿)、增殖性糖尿病视网膜病变(PDR)、视网膜静脉阻塞(RVO),以及青光眼等其他眼科适应症。
Ocular拥有全球顶尖的视网膜专家团队,特别是首席科学官Jeffrey Heier博士曾担任多项具有里程碑意义的临床试验项目的全国或国际首席研究者之一,包括Pegcetacoplan用于晚期干性AMD的3期临床试验、阿柏西普和雷珠单抗用于新生血管性AMD的3期试验,以及地塞米松植入物用于视网膜静脉阻塞的3期临床试验。
Ocular专有的ELUTYX技术是一种生物可降解的水凝胶基质,用于封装药物以提供持续和局部的药物递送。与传统植入物不同,基于ELUTYX技术的水凝胶不具备刚性、无外壳,具有高度的生物兼容性且不含防腐剂。该水凝胶形成一种网状结构,能够捕获药物颗粒,在使用期间,水凝胶基质与水反应形成水合物,随后药物颗粒开始释放,并从水凝胶中向外扩散至周围局部组织。完成药物递送后,水凝胶会生物降解并从体内清除,不会留下有害的副产物。同时,ELUTYX也不会造成酸性微环境。
水相环境的温度和pH值是调节ELUTYX聚合物生物再吸收的因素。由于人体体温和人眼房水环境的pH值处于一个恒定的范围内,而且房水或玻璃体液中的水分足以使该聚合物基质吸水饱和,使得水解过程具有可预测且可重复的降解速率,实现持续数天、数周或数月的缓释效果,并且这种多功能水凝胶平台可用于递送各类小分子和大分子药物,体现出ELUTYX作为一个药物递送系统的安全、灵活、高效性。

基于ELUTYX技术开发的产品可采用玻璃体内注射、前房内注射、鼻泪管插入三种给药方式。

据披露,支持ELUTYX平台的水凝胶技术(hydrogel technology)自1992年首次被用于人体以来,已经由FDA批准的8种疗法在500多万名患者中证明了安全性和有效性。
Ocular旗下已获批产品DEXTENZA®(地塞米松眼用植入剂)是FDA批准的第一款也是唯一一款药物洗脱型鼻泪管插入剂,2019年7月开始商业化推出,其活性成分是地塞米松,可无创植入到眼睑内侧的泪小管内,持续30天向眼表缓释地塞米松,且无需另行取出,DEXTENZA®会在鼻泪管系统自行吸收并排出。据摩熵医药数据显示,该产品已在美国和中国澳门获批上市,适应症包括眼科手术后眼部炎症和疼痛,以及与过敏性结膜炎相关的眼部瘙痒。
Ocular公司统计显示,DEXTENZA®自从推出以来已经应用于近55万只眼中,报告的不良事件发生率仅为每1万名患者中约2例。这展示了ELUTYX技术具有良好的耐受性。2024年6月,Ocular向FDA提交了DEXTENZA®应用于儿童白内障手术后眼部炎症和疼痛的临床试验数据,预计将在2025年第二季度收到FDA关于DEXTENZA®儿科标签的决定。

药融云数据,www.pharnexcloud.com;改名后为摩熵医药数据
据了解,Ocular针对DEXTENZA®海外市场在2020年10月与AffaMed Therapeutics(蔼睦医疗)达成了合作,以在大中华区、韩国和东盟市场开发和商业化Ocular的两种产品,即DEXTENZA®(地塞米松眼用植入剂)和目前在研的OTX-TIC(曲伏前列腺素眼内植入剂,也称为PAXTRAVA™)。
2024年2月,蔼睦医疗宣布DEXTENZA®的新药上市申请获得新加坡药品监督管理局受理,适应症也是眼科手术后炎症和疼痛、过敏性结膜炎有关的眼部瘙痒。2023年10月,蔼睦医疗公布DEXTENZA®用于治疗白内障手术患者的安全性和有效性的中国真实世界研究取得阳性结果。这是推进该药在中国大陆注册的一个重要里程碑。
Ocular曾经还有另一款上市产品ReSure Sealant,一种专门设计用于眼科手术中防止角膜切口液体泄漏的水凝胶密封剂,适用于成人白内障手术(含人工晶状体植入)中对透明角膜切口(最大3.5毫米)的术中管理。不过Ocular目前已经不生产这款产品。
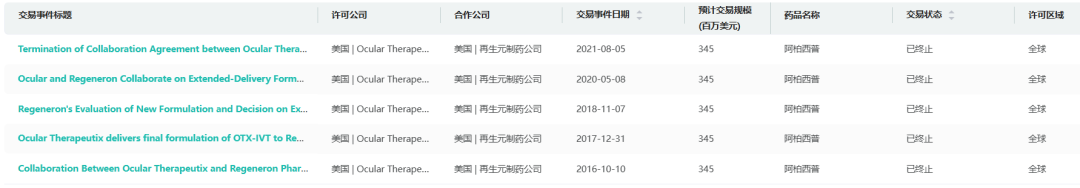
另据摩熵医药数据显示,Ocular曾与再生元就阿柏西普的缓释制剂达成过合作,合作最早可以追溯到2016年,不过目前已是终止合作的状态。
药融云数据,www.pharnexcloud.com;改名后为摩熵医药数据
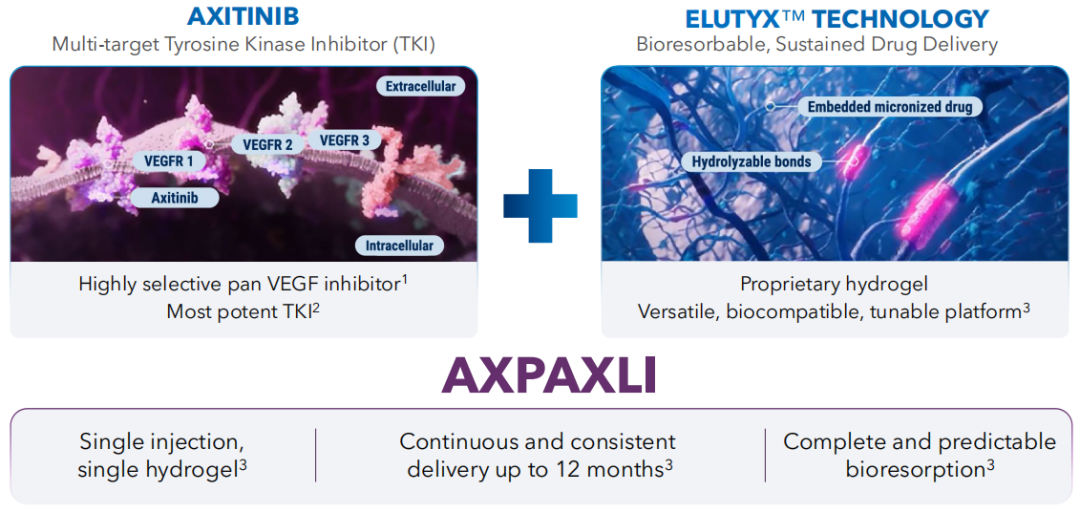
AXPAXLI™(阿西替尼玻璃体内植入物,也称为OTX-TKI)是Ocular当前最主要的视网膜疾病候选产品,基于专有的ELUTYX水凝胶技术开发。AXPAXLI™的活性成分阿西替尼是一种小分子、多靶点的酪氨酸激酶抑制剂(TKI),对VEGFR-1、VEGFR-2、VEGFR-3具有高度选择性,已被批准用于治疗肾细胞癌。Ocular正在开发AXPAXLI™用于治疗湿性AMD(湿性年龄相关性黄斑变性)、DR(糖尿病性视网膜病变)和其他视网膜疾病。
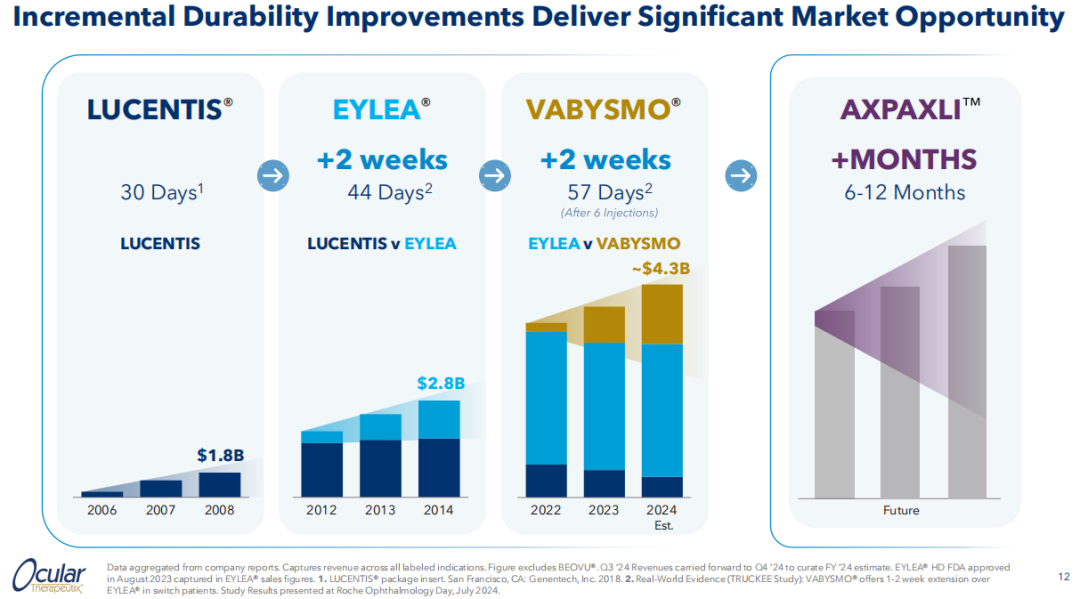
湿性AMD是发达国家50岁以上患者视力损害的最常见原因,据统计,2024年,美国约有170万人患有湿性AMD。目前针对湿性AMD的标准治疗方案是抗VEGF药物。这类药物在治疗视网膜疾病时均采用玻璃体内注射的方式,频繁注射导致患者依从性差是这类药物的一个主要痛点。从Lucentis(雷珠单抗)到Eylea(阿柏西普)再到针对VEGF-A/Ang-2双靶点的Vabysmo(法瑞珠单抗),患者的注射间隔经历了多次迭代,而Ocular对于AXPAXLI™的目标是将注射间隔延长到每6~12个月一次。
根据Ocular企业幻灯片,此前在美国开展的一项针对湿性AMD患者的1期临床概念验证性研究中,AXPAXLI™治疗组一次给药之后100%的患者在6个月内无需再次给药,80%的患者在10个月内无需再次给药。在澳大利亚开展的1期研究也显示了AXPAXLI™在未经治疗的湿性AMD患者中的单药治疗活性。
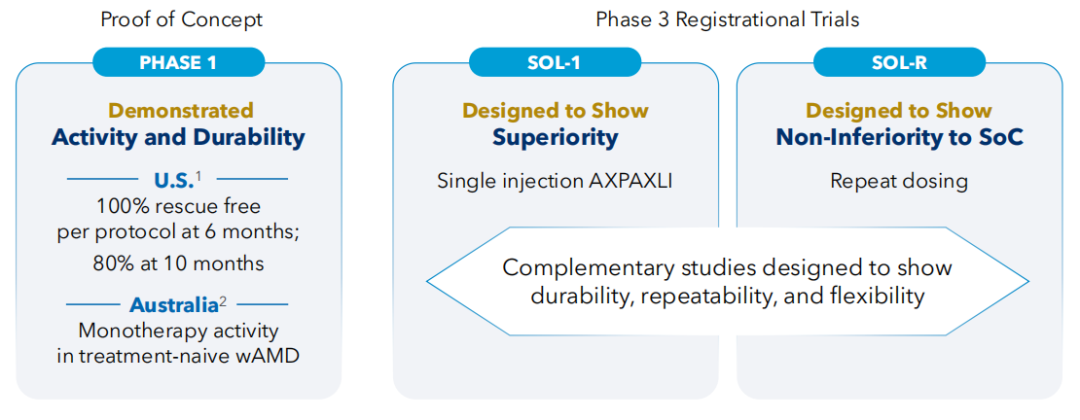
目前,AXPAXLI™针对湿性AMD开展了两项关键3期临床试验SOL-1和SOL-R,研究进度均超预期。
SOL-1试验设计为一项优效性研究,旨在比较单次优化剂量的AXPAXLI™(含450 µg的阿西替尼)和单次注射2 mg阿柏西普,并评估AXPAXLI™在湿性AMD患者中的安全性和有效性。此前SOL-1研究设计在与FDA沟通后经历过两次修改,后已在2024年12月完成了344名受试者入组,预计顶线结果将在2026年第一季度公布。SOL-R试验是一项非劣效性研究,主要终点是第56周时,AXPAXLI™组与按标签使用2 mg阿柏西普组之间从基线到平均变化的最佳矫正视力(BCVA)的非劣效性。截至2025年1月10日,SOL-R研究已经招募了311名受试者。若这两项研究获得积极结果,Ocular计划根据美国FDCA(《联邦食品、药品和化妆品法案》)第505(b)(2)节递交一个NDA申请。
AXPAXLI™另一项在研适应症糖尿病性视网膜病变(DR)也存在巨大且未满足的市场需求,DR是劳动年龄人群失明的主要原因。美国约有880万DR患者,其中有72%的患者属于NPDR(非增殖性糖尿病视网膜病变),而NPDR患者中仅有1%接受了治疗。
AXPAXLI™针对NPDR开展了1期临床研究HELIOS,旨在评估单次注射600µg剂量AXPAXLI™治疗中重度NPDR的患者的安全性、耐受性和有效性。2024年6月,Ocular公布了该研究顶线数据:对照组中37.5%(3/8)的患者疾病进展为增殖性糖尿病视网膜病变(PDR)或中心涉及型糖尿病黄斑水肿(CI-DME),而AXPAXLI™治疗组中这一概率为0,并且AXPAXLI™治疗组中46.2%(6/13)的受试者中在糖尿病视网膜病变严重程度评分(DRSS)上出现了1级或2级改善,其中有23.1%(3/13)的患者达到了2级改善。
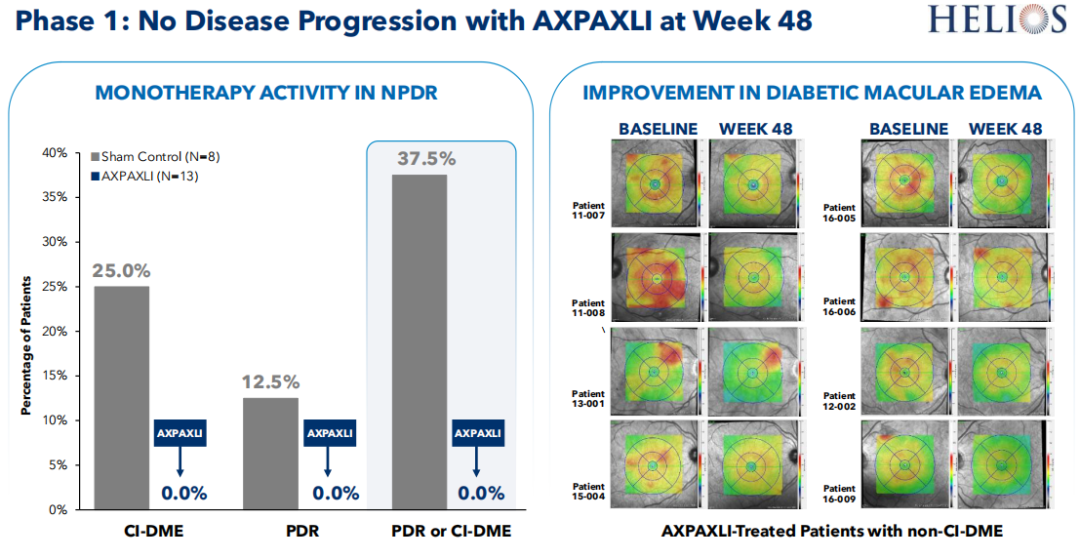
Ocular计划在2025年上半年与FDA讨论为AXPAXLI™治疗NPDR和DME(糖尿病黄斑水肿)设计潜在的注册临床试验,随后再评估下一步计划。
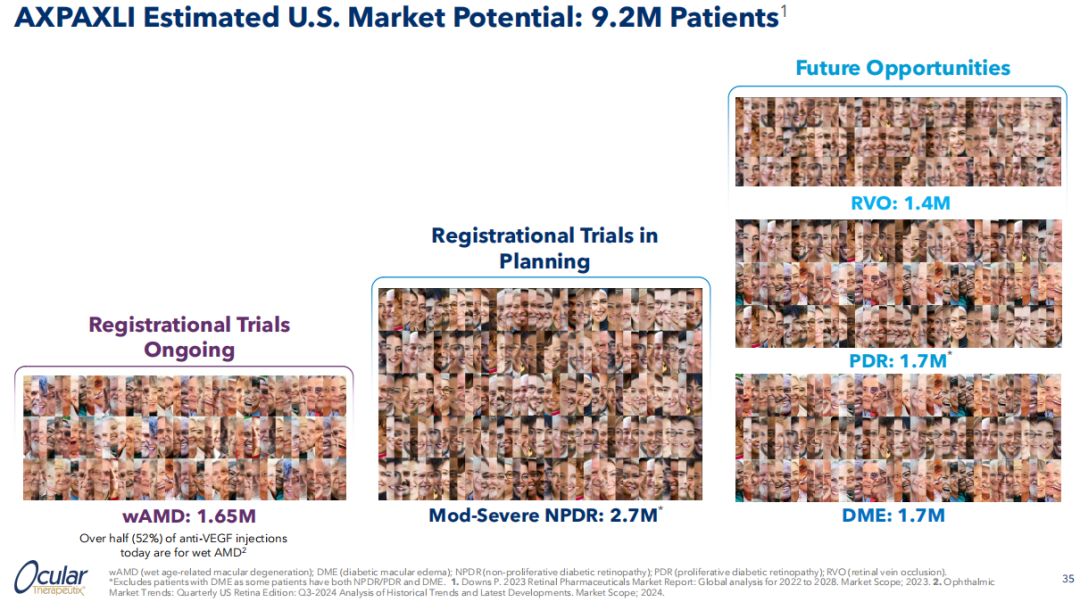
Ocular估计AXPAXLI™在美国市场有望触及wAMD、DME、NPDR、PDR(增殖性糖尿病视网膜病变)、RVO(视网膜静脉阻塞)共约920万患者人群。
Ocular正在开发的另一款候选产品PAXTRAVA™(曲伏前列腺素眼内植入剂,研发代号OTX-TIC)目前在开展2期临床试验,旨在评估PAXTRAVA™用于治疗原发性开角型青光眼(OAG)或高眼压症(OHT)患者的安全性、耐受性和有效性。
PAXTRAVA™的活性成分曲伏前列腺素是一种用于治疗青光眼或高眼压症的前列腺素类似物(PGA),通过增加眼睛内房水的排出量来帮助降低眼内压,该药通常以滴眼液的形式使用,但频繁使用滴眼液导致患者依从性差,进而影响治疗结果。PAXTRAVA™被设计为前房内注射给药,目标是单次治疗实现4~6个月的药物缓释。
据披露,Ocular还拥有两个干眼症项目:OTX-DED(地塞米松鼻泪管插入剂)用于干眼病症状和体征的短期治疗,以及OTX-CSI(环孢素鼻泪管插入剂)用于干眼病的慢性治疗,不过当前这两个项目并未处于积极开发的状态。
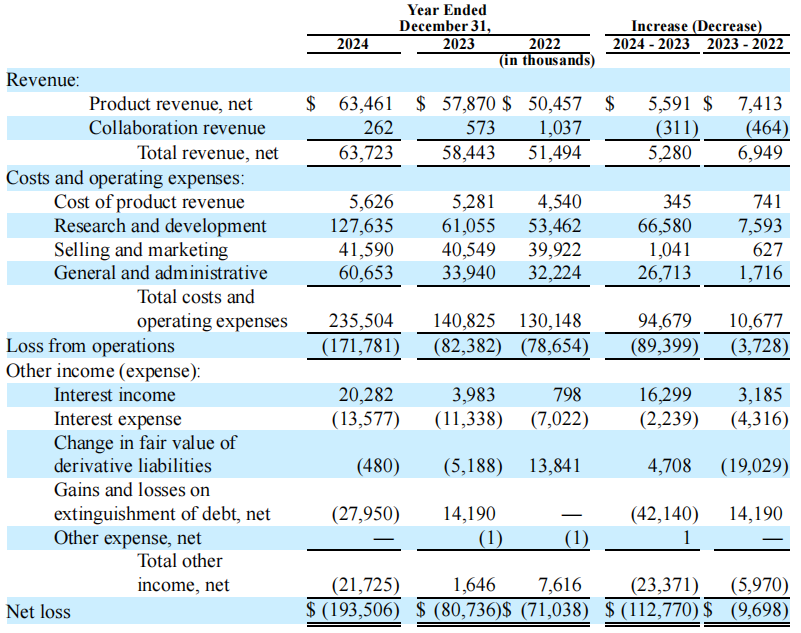
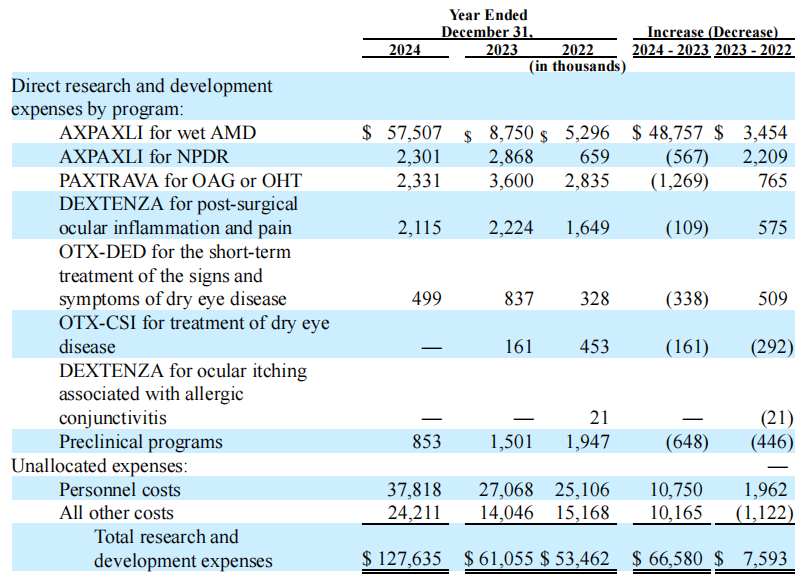
Ocular当前收入主要来自于DEXTENZA®(地塞米松眼用植入剂),2024年公司总收入6372万美元,同比增长9%,由DEXTENZA®业绩(6346万美元)增加推动,另外还有来自于AffaMed(蔼睦医疗)的26万美元合作收入。Ocular公司2024年总体研发费用1.276亿美元,上一年同期为6110万美元,主要是由于临床试验的开展;全年销售和营销费用4160万美元,上一年同期4050万美元;全年一般和管理费用6070万美元,上一年同期3390万美元;全年净亏损1.935亿美元。
另据披露,Ocular董事会在2024年5月批准了一项战略性裁员计划,以裁减37名全职员工,主要来自研发和技术运营部门,约占总员工数的13%。此举是为了优先将资源集中在AXPAXLI™(阿西替尼玻璃体内植入物)用于治疗湿性AMD的临床开发上。此次裁员相关离职补偿和遣散费用为160万美元。
2024年2月,Ocular还进行了私募股权融资,净收益约为3.164亿美元。
截至2024年底,该公司持有现金和现金等价物总额3.921亿美元,预计可支持其运营到2028年。截至2025年3月18日,Ocular总市值11.85亿美元。截止发稿前,市值为12.56亿美元。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China