近年来,随着免疫治疗、细胞治疗、基因治疗等新型治疗手段的快速发展,药企的研发强度不断提升。然而,新药研发面临周期长、投入大、成功率低的困境。据估计,一种药物从实验室到市场的所有过程的成本上亿,但目前超过80%的临床试验药物未能通过临床试验,其中60%的失败是由于缺乏疗效,另外有30%是由于毒性问题。究其原因,主要是传统临床前模型(动物、2D细胞培养)预测性不够,体现在两方面:一方面传统的临床前模型对于人体的仿生程度差,对于临床有效性和安全性的预测性低;另一方面,新型成药范式发展迅速,治疗方案复杂化,缺乏相应的临床前模型。新药研发亟待新的转化工具,类器官和器官芯片由此催生,助力临床前到临床转化之间巨大鸿沟的跨越,帮助药企实现降本增效。本文将围绕类器官与器官芯片展开介绍。
类器官(organoids)是由干细胞(胚胎干细胞ESC、成体干细胞ASC、诱导多能干细胞iPSC)、器官祖细胞或肿瘤细胞在体外培养时,发生与体内相似的细胞分化和空间限制的定向过程,从而形成的具有人体器官部分空间结构和特定功能的3D结构。
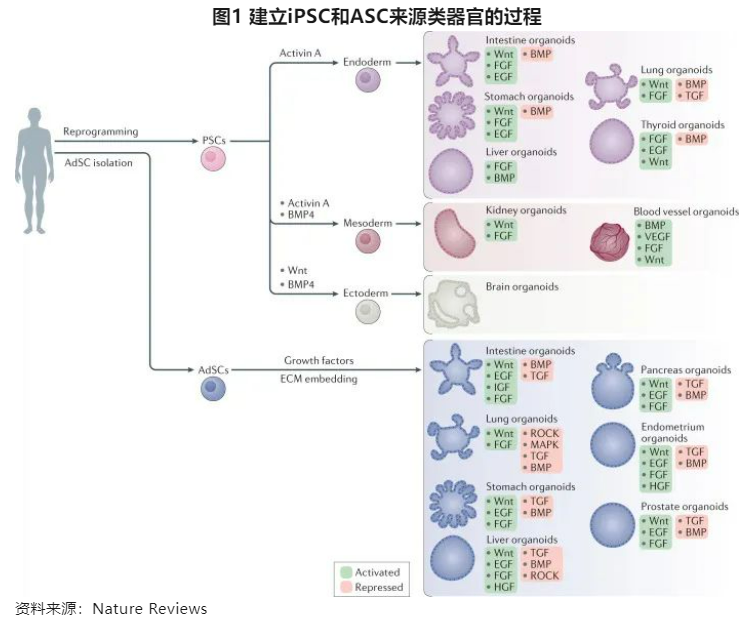
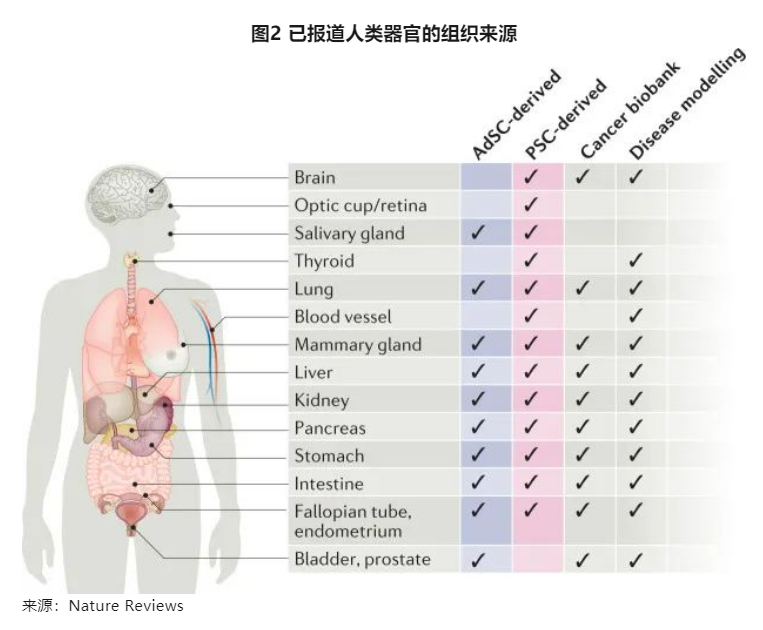
类器官的来源主要包括ASC、iPSC、肿瘤细胞等,不同的器官适用于不同的细胞来源。其中,ASC可以分化大多数的上皮类器官,包括肝、肠、结肠、胃、肺、胰腺,以及前列腺、乳腺、子宫内膜和卵巢等性器官,而心脏、视网膜和大脑、血管、甲状腺通常需要通过iPSC分化获得。ASC分化,关键在于分化信号通路的激活、细胞因子培养基以及3D基质胶环境,不同器官会有一些细微调整,其中较为通用的有,EGF和Wnt信号通路刺激扩增,BMP信号控制分化,一般在培养过程中需要EGF、R-spondin-1和Noggin培养因子,有的细胞不能分泌Wnt 3a,则还需要添加Wnt 3a,另外,还需要一些小分子抑制剂,比如TGF-β抑制剂等。iPSC分为内胚层(肺、肠、胃、肝、甲状腺)、中胚层(肾脏,血管)和外胚层(神经),诱导分化的方式较为多样。肿瘤类器官来自患者肿瘤组织,丰富的样本资源是类器官公司的核心竞争壁垒。
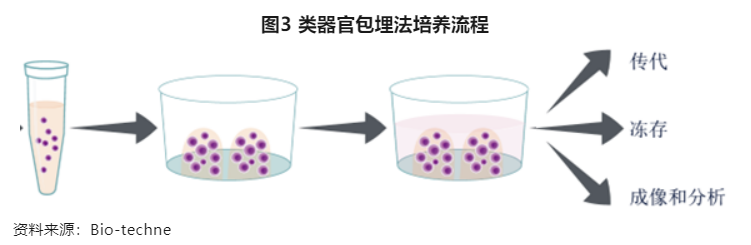
(1)分离原代组织干细胞或收集诱导多能干细胞;
(2)将细胞或类器官碎片直接悬浮在基质胶中,并以液滴形式分配到组织培养板表面;
(3)基质胶固化后,加入针对特定类器官培养的培养基和细胞因子、小分子等。
(1)在中间的滤膜皿中加入基质胶固化;
(2)将细胞悬浮在基质胶中加入到中间滤膜皿固化的基质胶上面;
(3)在外皿中加入特定类器官培养的培养基和细胞因子、小分子等。
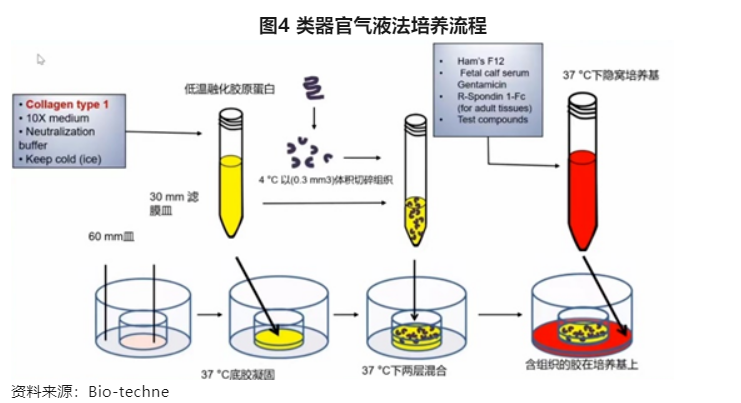
类器官培养基本组成有影响细胞生长、增殖、分化和成熟的细胞因子、支架/细胞外基质(ECM)和培养基条件,其中,基质胶较为通用,常用的有康宁的Matrigel和Bio-techne的Cultrex BME,不同类器官所需的培养基条件和细胞因子不同,是各个类器官公司的核心技术。
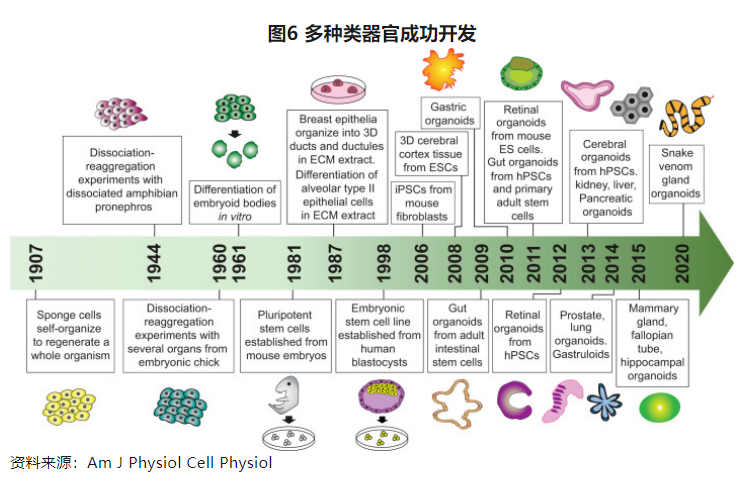
2009年,Hans Clevers团队利用基质胶构成的3D体系,将小肠来源的单个Lgr5(编码Wnt激动剂 R-spondin受体的基因)阳性成体干细胞在体外培养分化出具有自我更新能力、保持肠道腺窝-绒毛状结构的类器官,除了外观结构的仿生外,类器官的基因表达与新鲜分离的小肠隐窝保持高度相似,该模型可以持续扩增达3个月,稳定的基因组保证了纯化和生产放大等优势,此后这种方法被用于从其它主要器官上皮组织培养各种类器官,比如胃、肺类器官等,开启了类器官培养的时代。
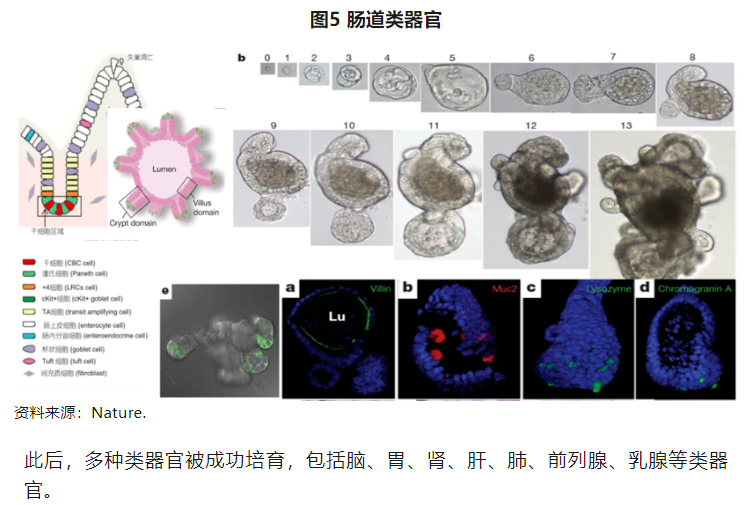
肿瘤类器官(Patient-Derived Organoids,PDO)是指将患者穿刺或手术切除的肿瘤组织在基质胶中培养数周得到的类器官。
传统的2D肿瘤细胞系培养的周期短、成本低,但临床预测性差。人源性组织异种移植(Patient-derived tumor xenograft,PDX)模型是将人源性肿瘤直接移植到动物体内进行造模,保留了肿瘤的异质性,临床预测性较高,但具有建模周期较长、成本高、成功率低的缺陷。PDO则兼具两者的优势,具有制备周期较短、成本适当、成功率较高的特点。
3D类器官一定程度上重现了人体器官结构和功能,但仍存在不足:
- 难以模拟组织界面:3D类器官难以重现组织间界面(如小肠上皮细胞-血管内皮细胞、肺泡上皮细胞-血管内皮细胞、血脑屏障等),而这种组织界面在物质转运、药物吸收、分布等过程起重要作用;
- 难以实现系统化:3D类器官难以实现多器官共培养,而多器官系统对于药物全面的有效性和安全性等指标的研究至关重要;
- 难以模拟机械力:在生理环境下,细胞常受到不同机械力的作用,例如流体剪切力、拉伸和压缩等,这些物理作用是促进细胞发育分化、维持正常功能或是导致病变的重要因素之一,然而3D类器官难以模拟这些重要的机械力。
器官芯片可以看做是在体外模拟人类器官单位功能的微型细胞培养装置,包含细胞、组织界面、生物流体、机械力等器官微环境的关键要素。一般来说,器官芯片的硬件设备主要由三部分构成:灌流系统、控制系统和微流控芯片。2010年,哈佛大学Wyss研究所Donald Ingber等构建了首个肺芯片模型:中间通道为具有通透性的多孔膜,用细胞外基质的分子包裹薄膜,上面铺一层肺细胞(从肺的气囊、肺泡中提取),另一面铺人肺毛细血管细胞,上层通空气,下层通培养基,用循环吸力使两侧真空通道收缩,模拟人体肺泡在呼吸过程中收缩的生理过程。在此基础上,还可以模拟肺部感染的时候白细胞抵御细菌入侵的过程。
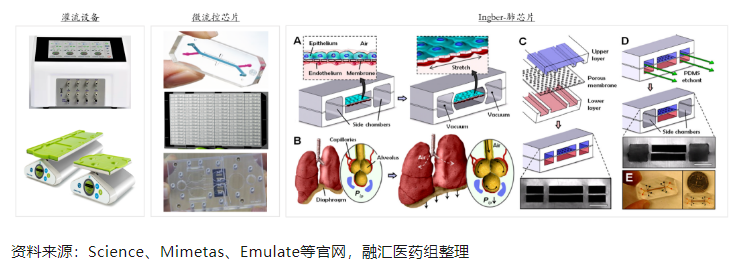
自2010年肺芯片开发出来后,肝芯片、肾芯片、肠芯片、心脏芯片、脑芯片、BBB(血脑屏障)等单器官芯片和多器官芯片逐渐被开发出来,器官芯片在屏障类生理模型、多器官体系的开发中更具优势。值得注意的是,静态培养下的肾脏类器官基本上是无血管化的,在微流控芯片上培养的肾类器官可产生可灌注的血管网络。与静态培养相比,微流控系统培养的肾脏类器官具有更成熟的足细胞和血管结构,且对肾毒性药物的敏感性更高。
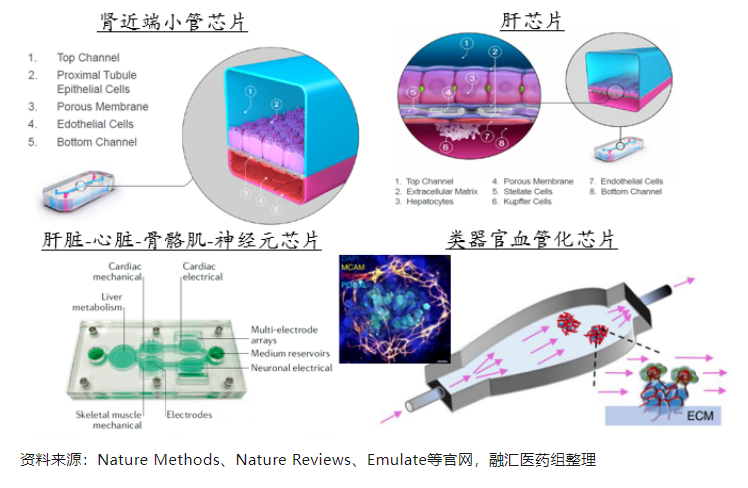
肿瘤类器官芯片:是指通过建立肿瘤类器官与肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)、免疫细胞、血管等共培养体系,以希望在体外较为真实的模拟人体肿瘤微环境。相较于单一肿瘤类器官而言,除提高模型仿生性外,在药物研发方面可能提供更广泛的应用,因为不但能够用来评估靶向肿瘤的药物,也可以用来评估靶向肿瘤微环境(如CAF、免疫微环境、血管生成)的药物。
复杂疾病模型构建:如前所述,因器官芯片的研发初衷是为了模拟器官单位功能,自然也被人们想到将之用于模拟病理状态下的器官,尤其是模拟一些发病过程比较依赖于多种细胞类型相互作用的、复杂的疾病,以期为人体体内病理过程提供一些洞见,例如:用于新冠病毒感染支气管气道的模型,NASH(非酒精性脂肪肝炎)模型,神经疾病模型等。
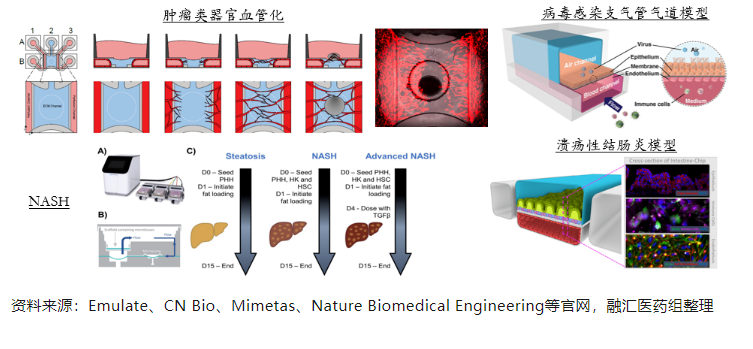
基于微流控的器官芯片表现出以下特点,具有高技术壁垒:
- 可控性和稳定性好:微加工的通道和培养室均一稳定,利用微流控芯片技术,可以操纵许多在孔板、3D静态培养和生物反应器等培养体系中难以控制的环境因素;
- 可实现组织界面模拟:中间用具有通透性的多孔膜,上层和下层分别培养特定的细胞类型,实现组织界面的模拟;
- 可实现多器官芯片系统串联:将多个模拟不同器官的芯片,按照体内的关系,用流体连接起来,在体外模拟体内不同器官之间的生理相互作用和药物分布等;
- 可提供机械力:利用微流控技术产生精确可控的流体剪切力和溶质浓度梯度变化的灌注液,以更好地模拟体内微环境;
- 可提供更加丰富的监测指标:在设计制作芯片装置时,通常加入一些微传感器实时监测芯片中细胞培养微环境的变化,组织屏障的完整性、流体压力、氧气含量等指标。
理论上来讲,类器官和器官芯片可以嵌入到药物开发全流程的各个环节,包括药物发现阶段、临床前阶段、临床阶段和批准上市后,但是毕竟类器官和器官芯片的成本高于传统的2D细胞实验,因此对于药物发现阶段,目前用的比较少;对于药物开发中的临床阶段的试验设计、患者识别招募等环节,类器官和器官芯片的应用尚处在探索阶段,目前还没有完全实现。综合来看,临床前阶段的药物评估和药物上市后的药敏检测是目前类器官和器官芯片在实际药物开发中应用较多的场景。
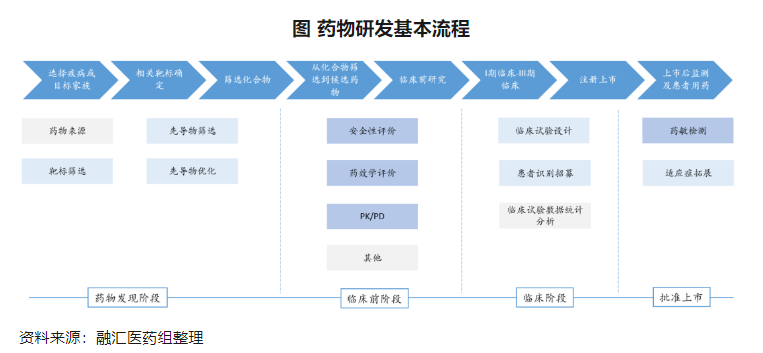
其中,临床前的药物评估方面涉及安全性、药效和ADME评价:
- 类器官和器官芯片在安全性评估方面初步展现出比传统的临床前模型更高的灵敏度,比如在肝毒性方面,Emulate开发的肝脏芯片,通过对27种药物(已知肝毒性和无毒性)在盲法条件下测试,PPV(Positive Predictive Value,阳性预测值)为100%,SEN(Sensitivity,灵敏度)达到87%,相比传统的临床前模型PPV(啮齿类33%,狗27%,猴子50%)和SEN(啮齿类65%,狗50%,猴子27%)有明显提升。
- 由于物种之间免疫反应的根本差异,一些新型药物模式缺乏有效的安全性评估模型,类器官和器官芯片由于来自人体细胞,解决了物种差异的问题,因此可用于此类药物的风险评估,比如,罗氏等MNC在肠芯片上评估T细胞engager双抗药物的安全性、以及方兴未艾的CGT领域也有不少公司在尝试类器官的评价体系。
2.药效评价:器官芯片可被用于构建复杂疾病模型,并进行有效性评价,比如CN Bio构建的NASH模型芯片,表现出脂肪堆积、促炎细胞因子产生和纤维化的关键疾病特征,显示比现有动物模型更高的人源样本转录组相关性,在此模型上进行奥贝胆酸和Elafibranor等药物测试,得到与临床结果较为一致的有效性数据。
3.ADME评价:器官芯片被初步用于药物的ADME评价,比如通过肝脏-心脏多器官芯片模型来评估经肝脏代谢小分子药物的PK/PD、及其代谢物的心脏毒性。
除此之外,肿瘤类器官也被尝试用于药敏检测,指导患者精准用药。2018年初 Science杂志发表的结直肠癌类器官临床试验发现,肿瘤类器官组织学和遗传水平和肿瘤组织高度相似,21例小样本量临床数据显示,肿瘤类器官药敏检测PPV为88%,NPV(Negative Predicitve Value,阴性预测值)为100%,更大样本量的临床试验有待进一步开展。
FDA推动了器官芯片和类器官的开发、验证及其在药企端的应用。2011年起,NIH、美国国防部和FDA宣布联合开发器官芯片等。随后,NIH采用“三步走”策略,依次促进开发人体器官生理模型以预测药物安全性、开发疾病模型以评估药物的有效性、为临床试验设计提供信息等,类器官和器官芯片技术在药企中逐渐得到应用,同时此类技术企业得到极大发展。2022年底,《FDA现代化法案2.0》获批,进一步促进器官芯片等在新药研发中的应用。

CDE鼓励在基因治疗/细胞治疗等中应用类器官、器官芯片等开展研究。2021年1月,科技部发布《通知》,将类器官列入“十四五”首批重点专项。2021年11月,CDE发布《基因治疗产品非临床研究与评价技术指导原则(试行)》和《基因修饰细胞治疗产品非临床研究技术指导原则(试行)》,明确提出在缺乏合适的动物模型情况下,可以使用更完善的体外试验系统、替代性模型,例如类器官、二维/三维组织模型、微流体模型等开展研究。

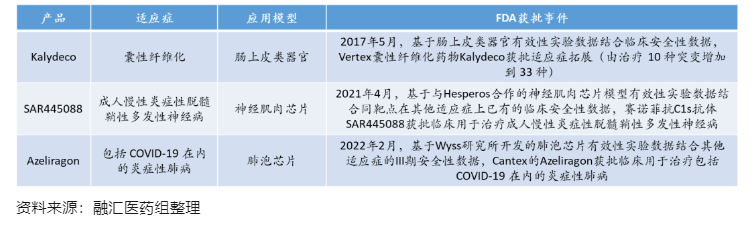
截至目前,已有多款药物成功基于类器官/器官芯片有效性实验数据结合药物的长期临床安全性数据获得FDA批准新适应症的临床,同时国内多款药物的IND申报数据包中纳入类器官/器官芯片数据,类器官和器官芯片在新药研发和申报中的作用逐渐得到监管机构的认可。
目前国内外的类器官和器官芯片公司根据客户类型分为to B端和to C端,商业模式包括提供服务和直接销售产品。To B端面向药企、CRO企业、高校等,类器官和器官芯片公司提供基于模型的测试服务在国内外均为主流的业务模式,通过销售芯片、配套设备及试剂等产品的业务模式在国外较为成熟。To C端面向患者以指导精准用药,是国内一些类器官和器官芯片公司重要的业务方向,短期内以LDT模式为主。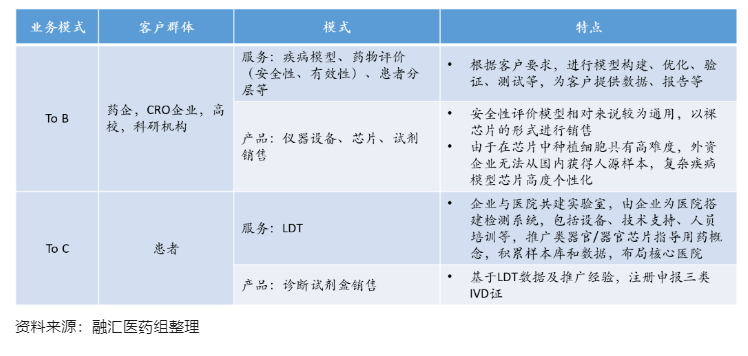
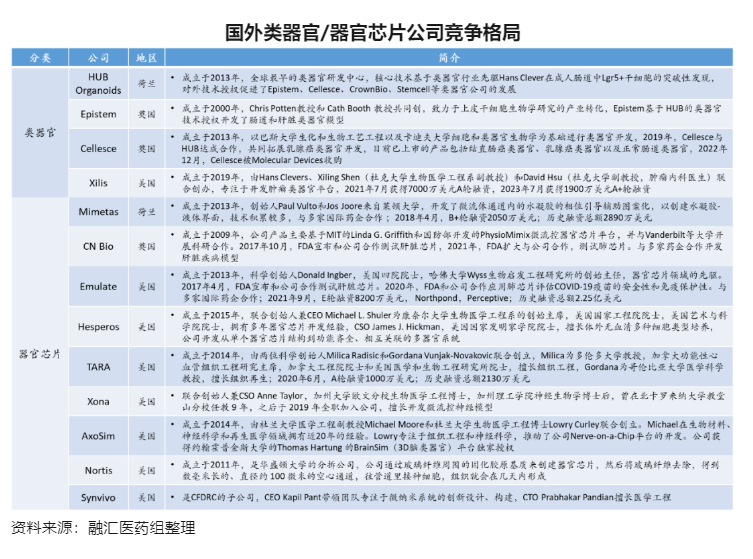
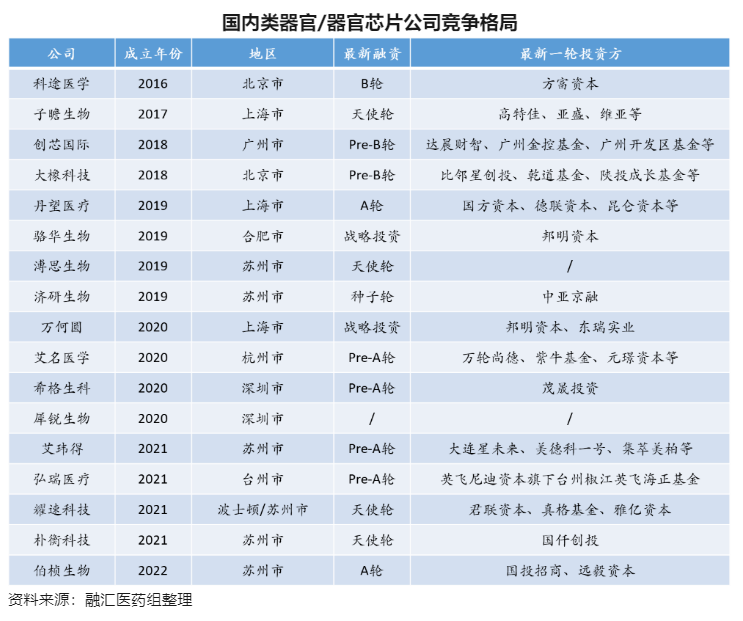
国外类器官和器官芯片的开发及应用早于国内,且在监管机构、MNC等的推动下得以加速。在类器官方面,国外以HUB Organoids为代表,已搭建了相当规模的类器官模型库,并通过对外技术授权推动了Epistem等类器官公司的发展,国内科途、创芯、丹望等较早入局。在器官芯片方面,国外Emulate、Mimetas、CN Bio、Hesperos等头部器官芯片公司占主导,多家公司得到NIH赞助,并与MNC达成重磅合作,国内大橡科技、艾玮得等积极布局。
类器官和器官芯片作为一类新兴的转化工具,有望为新药研发提供更为真实可靠的体外模型,有助于揭示疾病机制、药物疗效、安全性、PK/PD等方面的信息,帮助药企实现降本增效。随着个性化医疗的发展,类器官和器官芯片也将为个体化医疗提供精确的预测模型,从而为患者提供更为个性化的治疗方案。虽然类器官和器官芯片的应用前景广阔,但还有些技术、法规和商业化等方面的问题需要解决,技术上,有待进一步提高类器官和器官芯片模型的生物功能相似性、预测的准确性和稳定性,以及开发出标准化、规模化的生产方法;法规上,类器官和器官芯片模型涉及到人类组织和器官的建模和再生,需要关注人源样本使用的伦理问题;商业化方面,当前此类技术的价格仍然较高,商业模式也处于初步探索阶段,需要降低成本、提高产量以及与药企等下游客户合作推进商业化和应用。随着行业投入、政策鼓励、资本助力,类器官和器官芯片技术将不断突围,在未来应用到更广泛的领域中。















