在过去的2023年,美国纳斯达克有多起大型募资交易的IPO,作为法国上市生物技术公司有史以来最大的美国IPO(交易金额2.36亿美元),Abivax绝对值得我们特别斟酌。
从药融云数据库获悉,创立于2013年12月的Abivax Sa总部位于法国,主要专注于开发创新药物疗法,利用人体的自然调节机制来调节慢性炎症性疾病患者的免疫反应。虽然公司目前只有一个处于临床试验阶段的研发药物,但是目前正在开发其针对多个适应症,且在寻机扩大公司的研发管线。自成立以来公司完成了多轮融资,虽然之前的融资都只能算“小交易”,但是从2022年开始,融资金额就以几倍增长,2023年更是在短时间完成两轮上亿美元交易,并在10月份20日IPO上市。
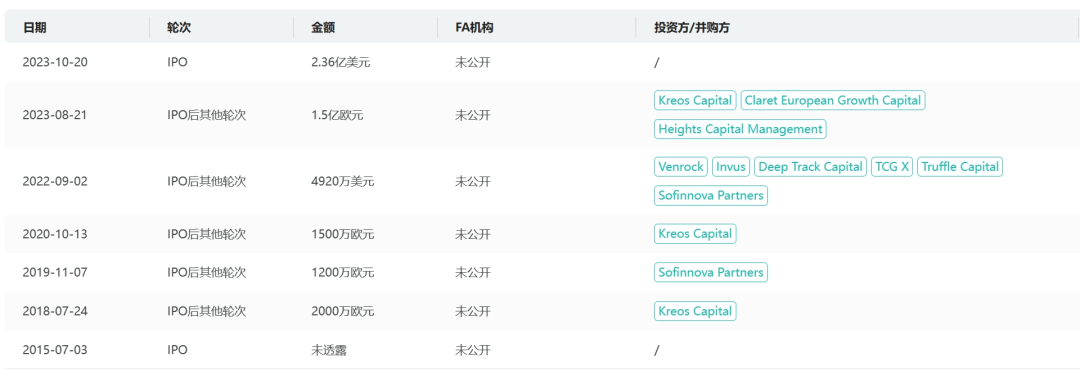
药融云数据库:融资信息
Abivax的优势绝对离不开其科研团队和合作伙伴的加持,公司的创始人兼首席执行官是Philippe Pouletty博士,同时他还是Truffle Capital(法国的生物技术风险投资公司)的联合创始人兼首席执行官(Truffle Capital是Abivax的最大股东)。Philippe Pouletty博士在欧洲和美国拥有深厚的背景,是生物技术和医疗器械领域的先驱,除了Abivax外,他还创立(或共同创立)了Carmat、Deinove、Pharnext等多家公司。

Philippe Pouletty博士(图源Truffle Capital)
Abivax的科研团队由多位经验丰富的生物技术领域的专家组成,首席科学官Hartmut Ehrlich博士曾在拜耳担任全球生物制药部门的副总裁,负责多个创新药物的研发和上市;首席医学官Jean-Marc Steens博士曾在诺华公司担任全球抗感染药物的医学总监,负责多个抗病毒药物的临床试验和批准;首席运营官Didier Blondel博士曾在赛诺菲公司担任全球财务总监,负责多个并购和合作项目的财务管理。公司合作伙伴包括多个国际知名的科研机构和医疗机构,比如法国国家科学研究中心(CNRS)、法国国家卫生与医学研究院(INSERM)和巴黎多所大学。
Abivax目前的研发管线只有Obefazimod(音译奥贝法兹莫德)这一种口服小分子候选药物,是第一个也是唯一一个增强miR-124表达的分子,miR-124是炎症反应的天然调节因子,增强miR-124的表达会使细胞因子和免疫细胞的减少,有助于减少炎症并控制UC(溃疡性结肠炎)等疾病的进展,通过选择性上调miR-124表达而具有抗炎特性。最初这一药物被研究用于治疗HIV感染,但是在溃疡性结肠炎患者的临床试验2期研究中显示出可观的效果,维持试验结果表明,长期obefazimod治疗可改善疾病的临床症状,相当一部分患者临床症状得到缓解,总体安全性良好。
注:miR-124是一种在大脑皮层和小脑中特异性表达最丰富的miRNA,miRNA (Micro RNA)是一类长度约为18~24个核苷酸的非编码小RNA,通过与靶mRNA的3端非编码区域结合,降解mRNA或阻止mRNA的翻译,发挥负性调节作用。炎症是具有血管系统的活体组织对损伤因子发生的防御性反应,可以清除进入机体的有害物质,但有些时候却对机体自身发生反应而造成损伤。目前发现多种miRNA参与炎症性疾病的发生、发展过程,因此研究与炎症性疾病有关的miRNA对这些疾病的诊断和治疗有重要的意义。

中度至重度活动性溃疡性结肠炎(UC)(单药治疗)
溃疡性结肠炎是一种常见的慢性非感染性炎症性肠道疾病,主要表现为腹泻、粘液脓血便、腹痛等。2021年4月,Abivax完成了在15个欧洲国家、美国和加拿大进行的随机、双盲和安慰剂对照的临床试验2b期研究,该研究涉及252名患者。在第8周时,每天给予一次obefazimod(25 mg、50 mg、100 mg)达到主要终点,改良梅奥评分的统计学显著降低(改良梅奥评分系统是根据症状判断UC病情的工具)。此外,与安慰剂相比,所有关键的次要终点,包括内镜改善、临床缓解、临床反应和粪便钙防卫蛋白的减少,在obefazimod给药的患者中显示出显著差异。
2022年11月,1074名患者和志愿者接受了obefazimod治疗,其中209名患者接受了50mg obefazimod治疗一年或更长时间,没有观察到新的不良安全信号。
2023年9月,Abivax报告了一项中期分析,即在UC患者中,使用Obefazimod进行开放标签维持治疗的第三年和第五年,将剂量从50 mg降至25 mg。在临床试验2a期研究中,患者每天一次口服50mg obefazimod治疗约四年,在临床试验2b期研究中治疗约两年。如果患者的梅奥内窥镜评分为0或1,则有资格参加试验,符合条件的患者改用25 mg,并在第48周进行中期分析,截止日期为2023年7月31日。在71名符合条件的患者中有63名完成了为期48周的访视,在这些患者中,63名患者中有53名(84%)呈现出疾病控制率(稳定或改善的改良梅奥评分)。在接受每日一次口服obefazimod治疗长达五年的UC患者中未检测到新的安全性信号。预计在2024年第三季度公布25mg obefazimod在持续治疗UC两年的延长试验情况。
当前正在进行临床试验3期研究,这项名为ABTECT项目的研究主要探究成人中度至重度活动性UC的疗效性和安全性,包括两项诱导试验(ABTECT-1、ABTECT-2)和一项后续维持研究(ABTECT维持试验),这三项关键研究都是随机、双盲和安慰剂对照的,使用对录像内窥镜的独立和集中审查。根据FDA的要求,在第8周(诱导)和第44周(维持)评估的主要疗效终点将是根据改良梅奥评分的临床缓解。在与包括FDA、EMA、PMDA和CDE在内的国际监管机构协商后,obefazimod(25mg和50mg)将在临床试验3期进行研究,后用于治疗初发的高级疗法(AT)和AT失败的UC患者,以支持未来提交上市许可。预计在2024年第四季度ABTECT项目招募最后一名患者参加诱导试验;2025年第一季度ABTECT项目在治疗8周后得到顶线诱导数据;2026年第一季度ABTECT项目在治疗一年后获得顶线维护结果。
克罗恩病(CD)(单药治疗))
克罗恩病是一种以消化道透壁性炎症为特征的疾病,多见于末端回肠,结肠和肛门,引起腹痛、腹泻、和肛门周围病变等症状。由于克罗恩病和溃疡性结肠炎的病理生理学和临床相似性,Abivax认为obefazimod有可能对克罗恩病患者产生作用,并计划在克罗恩病患者中启动临床试验2b期研究,以证明其临床试验2期研究中观察到的结果与重度至重度活动性溃疡性结肠炎的临床试验2期研究一致。
基于现有的临床前和临床炎症性肠病(IBD)支持性数据,Abivax正在中度至重度活动性克罗恩病(CD)的临床试验2期研究中推进obefazimod。在2023年第四季度ENHANCE-CD试验的IND已提交并获得批准,Abivax目前正在评估FDA的意见,并将考虑对试验设计的建议进行调整。预计2025年下半年ENHANCE-CD计划得到顶线诱导数据,等待在评估FDA意见后修改试验设计。
注:炎症性肠病(IBD)是指原因不明的一组非特异性慢性胃肠道炎症性疾病,包括溃疡性结肠炎(UC)、克罗恩病(CD)和未定型结肠炎(IC)。
其他研发项目
obefazimod联合治疗:根据其早期临床特征,评估口服和注射候选药物联合治疗obefazimod治疗UC的正式过程正在进行中,预计在2024年下半年提供临床前数据以支持联合药物的决策。
从miR-124库中选择obefazimod后续候选药物:从Abivax化合物库中选择的潜在后续候选药物的研发工作正在进行中。预计将于2024年第三季度选出第一个后续候选药物,以进一步加强Abivax产品线。
Abivax后续将通过在联合治疗中使用已有产品以及在慢性炎症性疾病领域使用其他化合物来加强公司的产品管线
2023年6月份,Abivax递交的obefazimod临床试验申请获CDE受理,目前国内正在进行针对溃疡性结肠炎的临床试验3期研究。
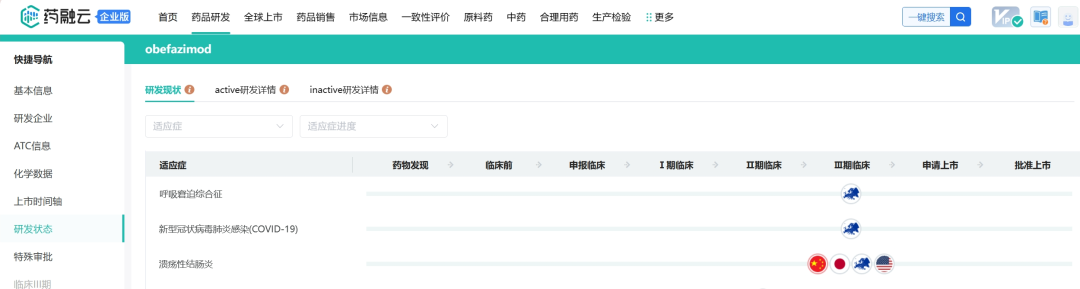
药融云数据库:研发状态
截至2024年3月11日,Abivax只公布了公司截至2023年6月30日的半年财报,截至2023年6月30日的六个月期间,总营业收入为230万欧元,而上年同期为230万欧元,在此期间没有显著变化。总运营费用为3950万欧元,而上年同期为2830万欧元,增加了1120万欧元,增幅为40%。这一增长主要是由于研发费用增加了1750万欧元,一般和行政费用增加了450万欧元,部分被截至2023年6月30日没有商誉减值损失所抵消(截至2022年6月30日为1100万欧元)。
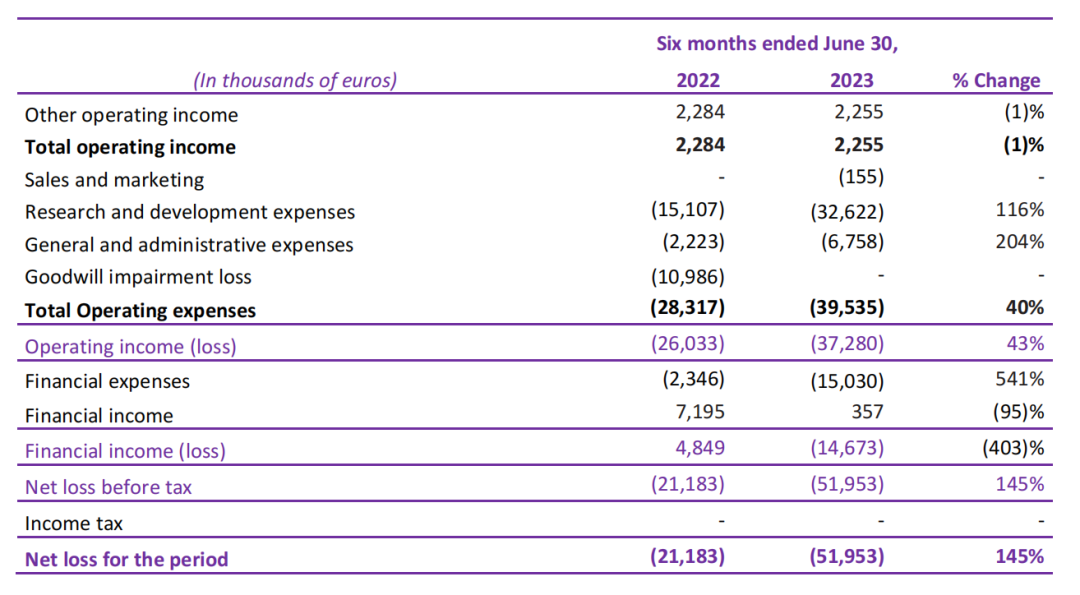
根据目前的财务状况,Abivax预计为2025年第一季度的ABTECT诱导试验和2025年下半年的ENHANCE-CD诱导试验的顶线数据提供资金。同时为了确保长期融资并延长公司当前的现金跑道,Abivax正在实施多管齐下的战略,为其额外的项目提供资金,并扩大其临床、医疗和商业能力。

目前市值约9.34亿美元。公司IPO前,TCG Crossover持股11.65%,有9.99%投票权;Truffle Capital持股10.99%,有17.8%的投票权;Sofinnova Crossover持股9.55%,11.59%的投票权;Invus持股9.48%,有8.13%投票权;Deep Track Capital持股6.29%,有5.39%投票权;Venrock持股6.14%,有5.27%投票权。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 南京市江宁区科学园乾德路5号