作为疾病的“治本”疗法,基因治疗正成为新药研发的下一个风口。本文就基因治疗的概念、发展历程、递送方式、上市产品、国内外产品管线布局及市场机会进行讨论。
一、基因治疗简介
基因治疗是指通过修饰或操纵基因的表达以改变活细胞的生物学特性,从而达到治疗目的的治疗手段,主要作用机制有正常基因替换致病基因、使不能正常工作的基因失活或者引入新的或修饰的基因等方式。随着基因治疗技术的不断发展,临床研究的不断深入,基因治疗已为多种难治性疾病提供了新的治疗策略。基因治疗药物包括被批准的质粒DNA、反义寡核苷酸、小干扰RNA-脂质复合体、病毒以及遗传工程细胞治疗产品。
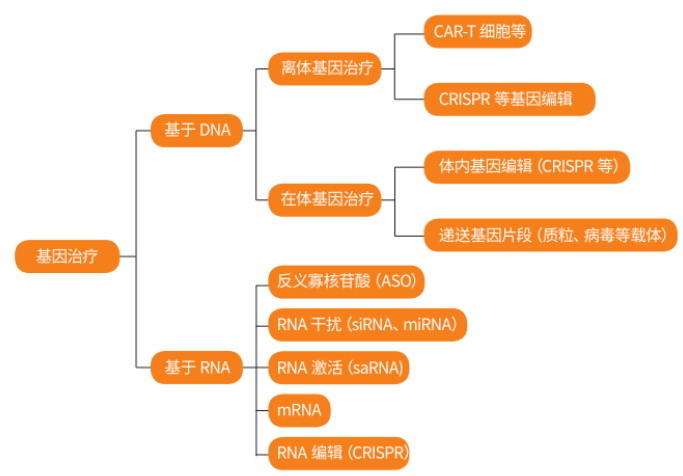
图1 基因治疗的分类
根据基因治疗药物使用方式,可分为体内治疗和体外治疗。
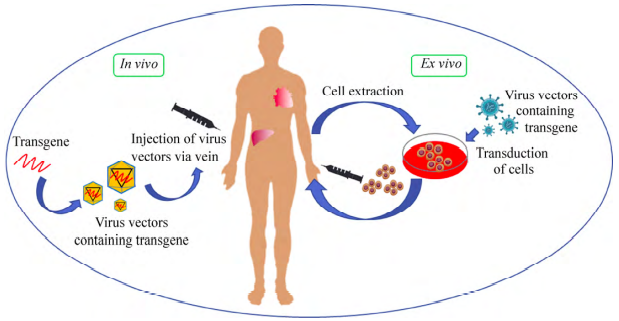
图2 体内基因治疗和体外基因治疗
自1998年FDA批准首款基因治疗产品Vitravene,至今已有20余个基因治疗产品上市(其中Vitravene和Glybera已撤市)。
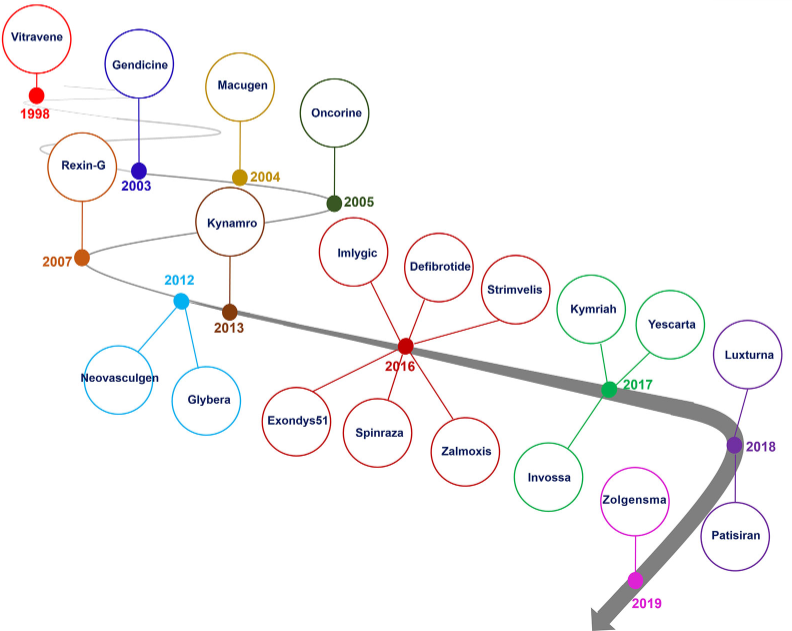
图3 已上市基因治疗药物
二、基因治疗药物的递送
2.1
基因治疗药物的病毒递送策略

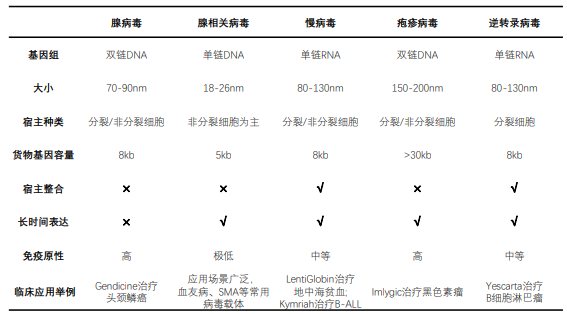
近年来,基因治疗药物的病毒载体因其高转染效率和稳定的转基因表达而在体内和体外得到广泛应用。常用的病毒载体包括腺相关病毒、腺病毒、慢病毒和逆转录病毒。腺相关病毒、腺病毒、非病毒载体等常用于invivo(体内直接转移),而慢病毒、腺病毒、逆转录病毒等常用于exvivo(离体递送)。
根据2021年12月3日CDE颁布的《基因治疗产品长期随访临床研究技术指导原则(试行)》,具有基因组整合活性的载体(例如γ-逆转录病毒和慢病毒载体)和转座子元件建议观察不短于15 年;可以产生持续感染、或有潜伏再激活风险的细菌或病毒载体(如单纯疱疹病毒)建议观察15 年或至数据表明不再存在任何风险(感染或再激活);腺相关病毒载体建议观察5年或至数据表明不再存在任何风险。根据该指导原则,腺相关病毒(AAV)载体安全性风险最小,观察时间最短,与此趋势一致,AAV也是目前应用最为广泛且最为重要的基因治疗病毒递送载体。
表1 不同病毒载体对比
2.1.1 腺相关病毒(AAV)

AAV是一种无包膜双链DNA病毒,具有良好的生物学特性、遗传稳定性、低免疫原性、高基因转导效率和大规模易用性。已经有几款使用AAV载体的药物相继获批。2012年获欧盟批准上市的Glybera是第一款获批的AAV药物;随后在2017年,美国FDA批准了SparkTherapeutics的Luxturna上市;2019年美国FDA又批准了诺华旗下AveXis的Zolgensma上市。
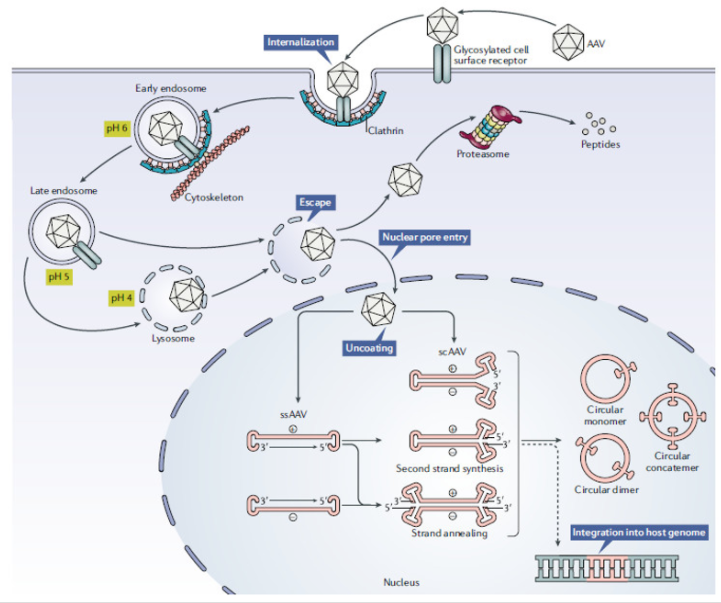
图4 重组AAV载体介导转基因表达
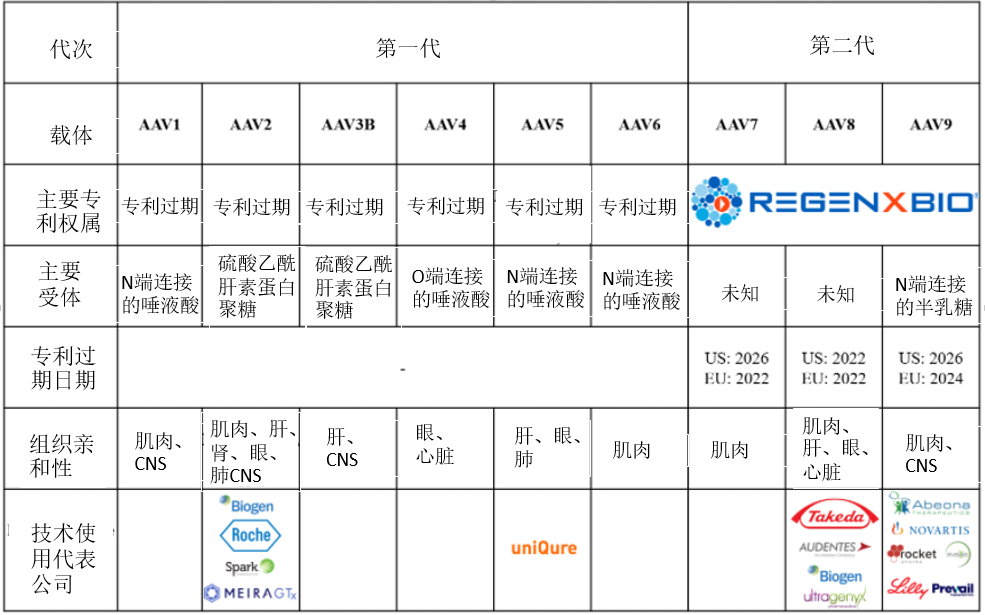
AAV有9种常见的血清型AAV1~9,还存在AAV10、AAV-DJ、AAV-DJ/8等血清型,不同的血清型对组织或器官有着不同的亲和性,其中AAV2、AAV3、AAV9源自人类本身,是迄今研究最为彻底、应用最为广泛的腺相关病毒载体。在小鼠肝脏转导效率影响的实验中,发现效率最高的是AAV8血清型载体;AAV9型病毒载体能够有效转染中枢神经;在视网膜的转染实验中,AAV5血清型载体转染效率优于AAV2血清型载体;在对肌肉组织进行基因治疗时,AAV1和AAV7型血清型载体要优于AAV2、AAV3、AAV4、AAV5血清型载体。
表2 不同血清型AAV载体对比
但是AAV的封装限制只有4.5kb,制作过程复杂,成本高,所以AAV载体的应用有一定的限制。日前,利用蛋白质剪接技术开发下一代基因疗法的生物技术公司SpliceBio宣布完成了5000万欧元(约合5700万美元)的A轮融资。他们将要递送的更大的基因拆分并包装到两个AAV载体上,在递送后通过分裂内含肽(SplitInteins)将其重新组装成完整的全长蛋白,从而突破AAV基因治疗的主要障碍。内含肽的方法为AAV载体改造提供了新的思路。
2.1.2 慢病毒(LV)

LV是基因治疗中广泛使用的基因递送载体,可在高度分化的转导细胞中稳定整合并长期表达。LV是由单链RNA组成的球形结构,封装体积约为8kb。LV主要用于离体基因治疗方法,使用基因修饰的造血干/祖细胞治疗各种遗传疾病,或使用基因修饰的T 细胞(如CAR-T 细胞)进行癌症免疫治疗。目前有一百多项使用LV 的基因治疗试验正在进行中,几种基于LV 的基因治疗药物(Zynteglo、Kymriah、Abecma)已获得上市批准。
整体上来说,慢病毒感染体系完整保留了原本逆转录病毒高表达效率和长表达时间的优点,并且在感染能力上有了巨大的提升。但是这并不代表着慢病毒体系的绝对安全。慢病毒在继承逆转录病毒优点的同时,也继承了其随机插入的不稳定性。Bluebird用于治疗镰刀状细胞贫血症(SCD)的产品LentiGoblin发生了安全性问题,在该产品的1/2期临床研究中,有两名患者分别确诊了急性髓细胞白血病(AML)和骨髓细胞异常增生症(MDS),导致该药正在进行的一系列临床研究也因此宣布暂停。这一事件同时也影响到了Bluebird的其他产品,其已经上市的Zynteglo因为与LentiGoblin使用了同样的慢病毒载体也因此被暂停销售。GSK的Strimvelis可能导致了一名患者的白血病。Strimvelis最早在2016年获欧盟批准,用于ADA-SCID的治疗,Strimvelis的销售也因安全性问题被暂停。
LV可通过基因组整合实现长期表达和低免疫原性,这对于临床研究和应用非常重要。因此,LV已成为基因治疗中一个很有前景的选择。尽管存在插入突变、低滴度、高成本等诸多挑战,但LV治疗在白血病、血友病、帕金森病等多种疾病上已取得突破性进展。未来,在提高其治疗用途的安全性和转导效率之后,新一代的LV应该有望成为人类基因治疗的医疗产品。
2.2
基因治疗药物的非病毒递送策略
尽管病毒载体通过细胞转导有效地传递基因治疗药物,但它们的高免疫原性和高突变风险等安全问题也限制了它们的临床转化,非病毒载体的巧妙设计弥补了基因治疗药物的缺陷。非病毒递送载体可以根据材料的来源分为合成纳米载体和内源性纳米载体。常用的非病毒递送载体包括脂质体纳米粒(LNPs)、外泌体等。
2.2.1 LNP

LNP是由磷脂生物分子定向形成的,可以包裹脂溶性和水溶性药物,通过与细胞膜融合将遗传药物输送到体内。LNP具有药物靶向性和良好的生物相容性、降低药物毒性、克服耐药性、促进内体逃逸等优点.因此,LNPs已广泛应用于基因治疗药物的递送,其中Lipofectamine™、TurboFect™和Stemfect™已实现商业化。由带正电荷的两性化合物和中性脂质形成的阳离子脂质体是传递基因治疗药物的主要力量。阳离子脂质体携带的正电荷可以与靶基因上的负电荷相互作用形成稳定的复合物并且增加循环时间从而提高转染效率。为了提高基因治疗药物的递送效率,大量经过巧妙设计的脂质体非病毒载体开始出现,包括外泌体-脂质体杂化纳米颗粒、DOTAP脂质体,透明质酸修饰的阳离子niosomes。
2.2.2 外泌体

外泌体是细胞分泌的一种纳米级(40-100nm)的囊泡,在细胞间物质运输和信号通讯中发挥着重要作用。外泌体具有与细胞膜相似、体积小、带负电、避免吞噬作用、产生免疫逃逸、延长循环时间、穿透深层组织等优点。由于不同细胞来源的外泌体的潜在生物学功能差异较大,因此外泌体的来源存在争议,存在促进肿瘤生长和免疫抑制的风险。Gyorgy等人构建了外泌体AAV通过将外泌体与腺相关病毒偶联来进行载体。引人注目的是,exo-AAV9转导了几乎 95%的内毛细胞(IHC) 和外毛细胞(OHC)。常规AAV1-GFP 载体转导约20% 的IHC 和OHC,而exo-AAV1-GFP 转导高达65% 的IHC 和50% 的OHC,表明exo-AAV1-GFP 比常规AAV1-GFP 更有效,并且它可能是一种重要的耳聋转基因载体。外泌体用作封装基因药物的膜,具有高封装效率。
三、基因治疗的研究进展
全球在研的基因治疗临床试验均集中在肿瘤和感染性疾病领域,正逐步拓展至其他疾病领域未被满足的临床需求。根据ClinicalTrials.gov的临床试验来看,2015- 2021年,全球正在进行的基因治疗临床试验中有超过一半针对肿瘤治疗,目前基因治疗已在多种疾病中取得突破性进展,现将部分进展列举如下。
3.1
A型血友病
BioMarin公司的valoctocogeneroxaparvovec(BMN270)采用了AAV5载体。其I/II期临床的3年随访结果显⽰,VIII因子在体内展现出了持久的表达,6x1013vg/kg队列的6位患者治疗三年后的平均年化出血率(ABR)从入组前的16.3降至0.7,降幅高达96%,且所有的患者都不需要进行预防治疗。正在进行的III期临床也展现出了同样优异的结果。
Spark的SPK-8011则采用了生物工程AAV衣壳Spark200。其I/II期临床结果显示,12名患者出血事件和需要传统治疗频率降低97%,但是即使高剂量组7位患者的FVIII号因子平均值也只达到正常值的22%,这主要是因为两个患者产生免疫反应令FVIII因子水平降低到5%以下。虽然SPK-8011也几乎达到“痊愈”标准,但是其疗效与安全性均劣于BMN270。
Sangamo的SB-525采用的AAV6载体在ASH2019年会上公布的结果显示3*1013vg/kg剂量的5名患者中,过5-7周可以达到正常FVIII因子水平,且前两名患者在37周和44周时仍然保持稳定的FVIII因子水平,疗效持久。Sangamo/辉瑞也即将开展SB-525的III期临床。
3.2
B型血友病
Spark/辉瑞的SPK-9001的I/II期临床结果显示,患者在接受SPK-9001治疗后,FIX活性水平范围在第6周时为正常表达水平的14%至68%,在第8周时为16%至78%,在12周时为14.3%至76.8%(平均为35.5%),并使年出血率降低了97%,正在开展III期临床。
uniQure的AMT-061则采用了AAV5载体。早期结果显示,给药后6周,3名患者的平均FIX活性水平为正常值的31%,处于III期临床。
3.3
黑色素瘤
安进的Imlygic于2015年10月被FDA批准在美国上市,它是一款针对局部不可切除的黑色素瘤的基于单纯疱疹病毒的注射型基因药物,它能够引起局部炎症,导致癌细胞的死亡。同时,它所表达的人类GM-CSF蛋白能够有效的聚集树突状细胞,从而增加抗原展示,以引起周边CD4+、CD8+T细胞的免疫反应,继而对肿瘤细胞起到破坏的作用,形成了一个消灭癌细胞的正循环,达到一次或少次用药即治愈的效果。
3.4
杜氏肌营养不良症
Sarepta/Roche的SRP-9001采用了AAVrh74载体递送micro-dystrophin基因,正处于临床II期。初步临床结果显示,在接受单剂量2.0*1014vg/kg的SRP-9001静脉给药后,患者肌肉纤维中能检测到微肌营养不良蛋白,同时显示出NSAA分数的功能改善。基于此优异结果,FDA于2020年7月授予了SRP-9001快速资格认定(FTD)。
辉瑞的PF-06939926采用了AAV9载体来递送mini-dystrophin基因,已开展III期临床,9名患者中有3名出现了SAE,其中有一例患者出现了肾损伤,曾短暂暂停了临床试验。
SolidBiosciences的SGT-001则采用了公司筛选得到的AAV- SLB101载体来递送micro-dystrophin基因,AAV -SLB101在人类骨骼肌细胞体外实验中显示出了优于AAV9的基因转导效率。SGT-001正处于临床II期,但是临床中曾两次出现了比较严重的肾损伤副作用,因此目前临床遭到了FDA的叫停。
3.5
遗传性视神经病变
GenSightBiologics公司的AAV2-ND4目前正处于III期临床,采用了AAV2载体递送ND1基因到患者眼部,用于治疗由ND4基因突变引起的Leber遗传性视神经病变。
3.6
X-连锁视网膜色素变性
目前正处于临床II/III期的NightstarTherapeutics公司的NSR-RPGR,用于治疗X-连锁视网膜色素变性。NSR-RPGR采用了AAV8载体,在2021年1月公布的中期I/II期临床数据结果显示,一部分患者的病情得到了持续3到6个月的改善。
MeiraGTx公司的AAV-RPGR也是一款用于X-连锁视往膜色素变性的基因疗法,其采用了AAV2载体,正处于I/II期,在2021年7月份公布的初步结果显示出积极疗效,将支持AAV-RPGR进入III期临床。
3.7
无脉络膜症
Spark公司的SPK-7001用于治疗无脉络膜症,正处于I/II期临床,其早期结果优异,已获得了孤儿药资格认定。
3.8
转甲状腺素蛋白淀粉样变性
IntelliaTherapeutics和再生元(RegeneronPharmaceutical)体内基因组编辑候选疗法NTLA-2001用于治疗转甲状腺素蛋白淀粉样变性,其最新发布的I期临床试验数据结果表明所有的给药剂量都耐受良好,目标蛋白的血清水平分别取得平均86%和93%的降低。在所有四个剂量组中,水平降低的程度也呈现给药剂量的依赖性。
四、国内外基因治疗公司布局
根据再生医学联盟(Alliancefor RegenerativeMedicine,ARM)的数据,在2021年,基因治疗行业的投资总额达到了约115亿美元,国内外多家公司布局基因治疗领域。
表3 国外知名基因治疗公司布局
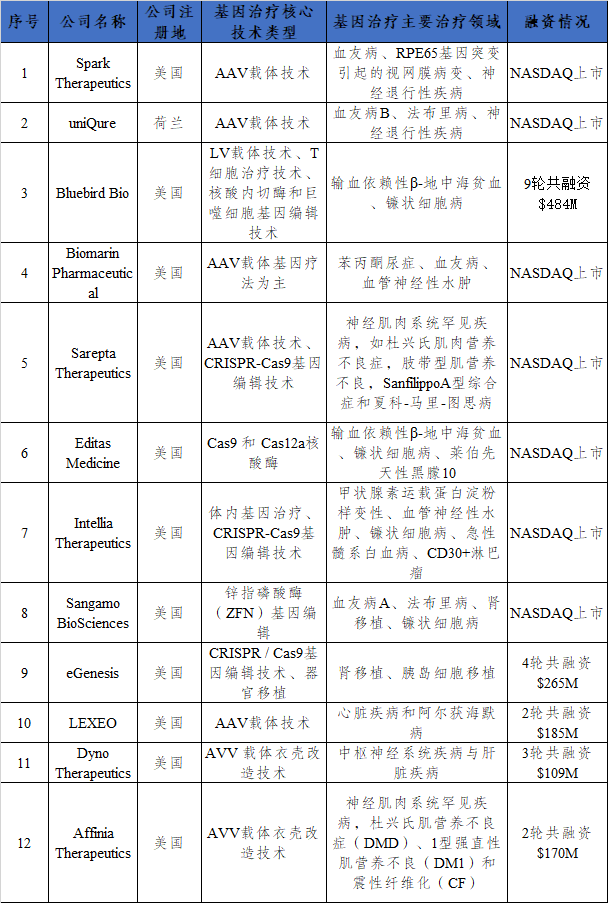
表4 国内知名基因治疗公司布局 五、面临的机会和挑战 虽然大部分基因疗法在临床上展现出了较好的耐受性,但是仍有部分产品在临床上出现了严重副作用,UniQure、Bluebirdbio,以及最近的AllogeneTherapeutics都报告了癌症或基因异常病例,导致研究暂停和被调查,安全仍是基因治疗需要注意的首要风险。此外,目前超70%基因递送药物均采用AAV载体递送,由于AAV基因组不会整合进基因组,因此AAV递送的基因有可能会随着细胞的分裂、死亡或者其他原因不断被稀释从而导致疗效不能持久。所以基因疗法的耐久性问题也一直备受关注。 进入2022年,多款基因疗法拟推进上市。蓝鸟生物的2款基因疗法(分别用于治疗B型血友病和一种罕见的脑部疾病),目前正在接受FDA的审查,目标决定日期为今年5月和6月。在获得A型血友病基因治疗的更多数据后,BioMarin计划很快与FDA接洽,重新提交上市申请。其他公司,如CSLBehring和PTCTherapeutics,目前也计划在2022年向FDA提交其基因疗法的上市申请。基因疗法因其光明前景和巨大商业潜力必将作为成为了各大药业巨头寸土必争之地。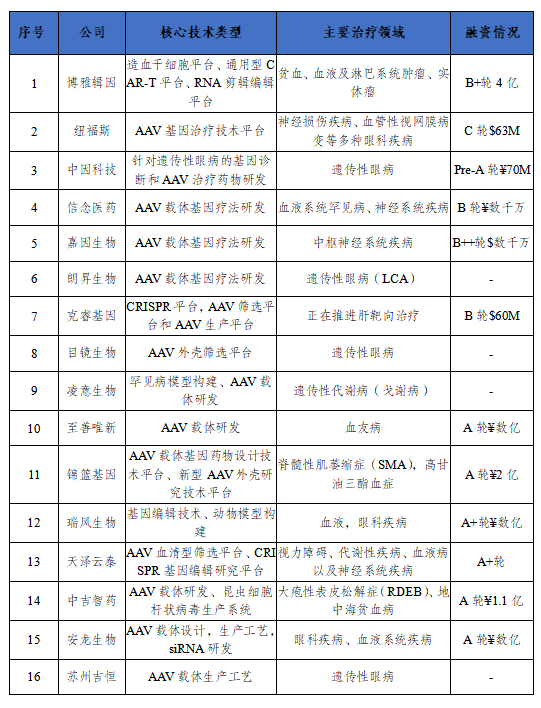
基因治疗让我们能够治疗“无法治愈”的疾病,也为其他疾病带来新的治疗思路。目前基因治疗的主要应用场景是治疗罕见病,随着AAV递送系统不断成熟,基因治疗“⼀次给药”的特性对病⼈吸引力越来越大,越来越多的在研管线将应用场景从罕见病拓展到常见病。然而,作为一种“革命式”的新型疗法,基因治疗也面临诸多挑战。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 南京市江宁区科学园乾德路5号