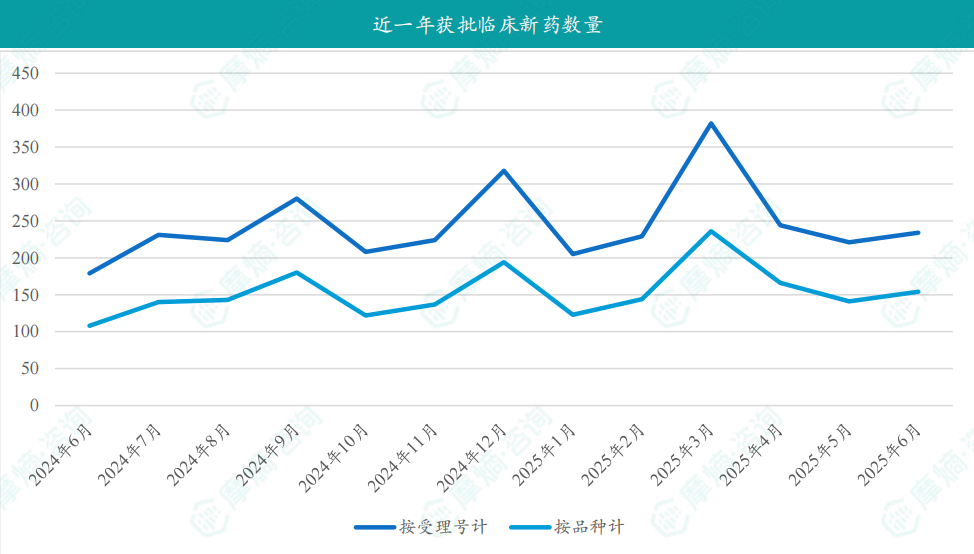
根据摩熵医药数据库统计,2025年6月共有154款新药获批临床(共计234个受理号),较上个月增加了13款,其中包括82款化药,69款生物制品,3款中药。
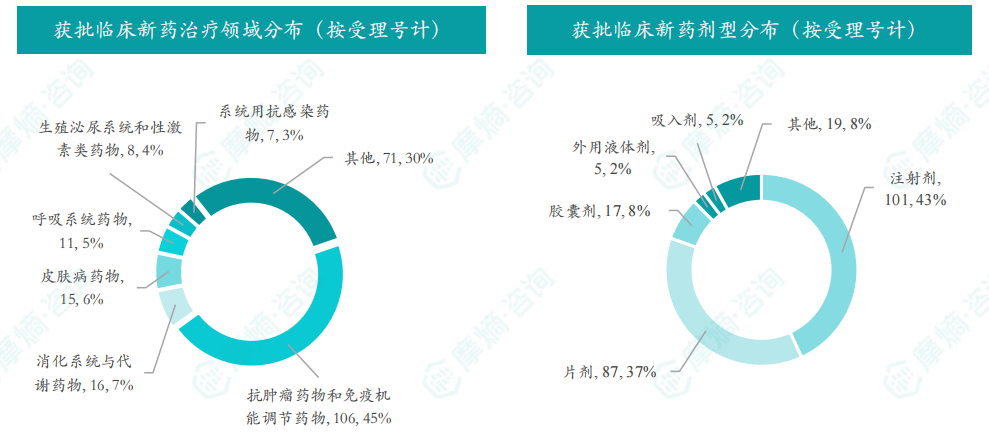
6月获批临床受理号数量最多的新药为抗肿瘤药和免疫机能调节药物,有106个,占比为45%,消化系统与代谢药物获批数量也比较多,有16个。获批剂型主要为注射剂与片剂,分别有101个,87个。
截图来源:摩熵咨询月报
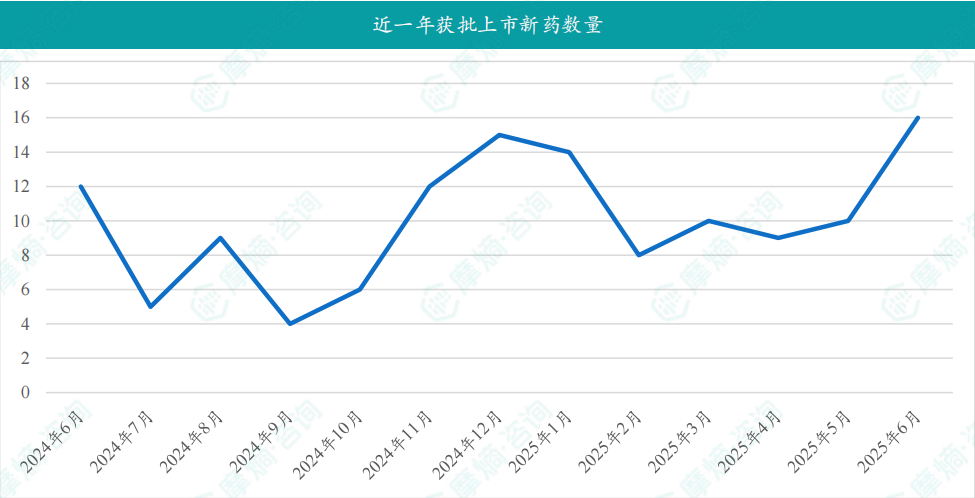
在6月份,国内医药市场迎来了16款创新药物的获批上市,涉及诺华的布西珠单抗注射液,用于治疗糖尿病黄斑水肿(DME)适应症;海创药业自主研发的1类新药氘恩扎鲁胺软胶囊,用于治疗接受醋酸阿比特龙及化疗后出现疾病进展,且既往未接受新型雄激素受体抑制剂的转移性去势抵抗性前列腺癌(mCRPC)成人患者;复星医药1类新药芦沃美替尼片(曾用名:复迈替尼片),适用于朗格汉斯细胞组织细胞增生症(LCH)和组织细胞肿瘤成人患者;恒瑞医药的苹果酸法米替尼胶囊,联合注射用卡瑞利珠单抗用于既往接受含铂化疗治疗失败但未接受过贝伐珠单抗治疗的复发或转移性宫颈癌患者,此外恒瑞医药还有注射用磷罗拉匹坦帕洛诺司琼和注射用瑞康曲妥珠单抗均已获批上市。
截图来源:摩熵咨询月报
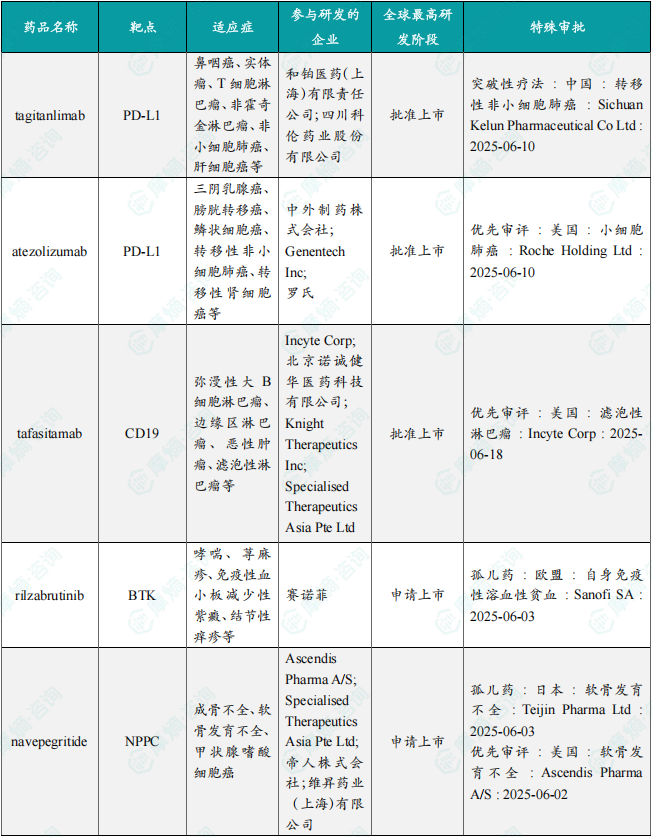
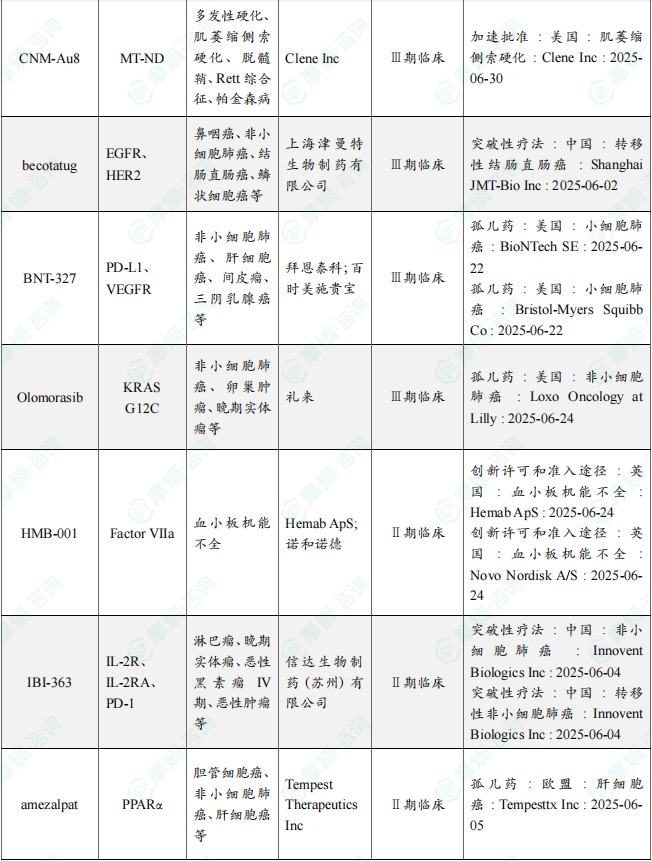
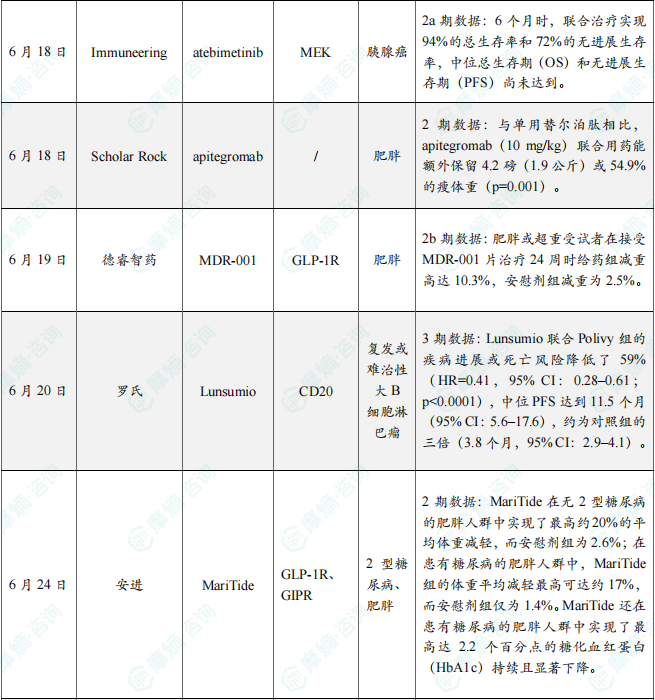
6月共有77款药物获孤儿药/突破性/快速通道资格认定。其中值得注意的是:和铂医药(上海)有限责任公司、四川科伦药业股份有限公司共同研发的 tagitanlimab 批准上市,适应症包括鼻咽癌、实体瘤、T细胞淋巴瘤、非霍奇金淋巴瘤、非小细胞肺癌、肝细胞癌等;此外,赛诺菲的 rilzabrutinib 正在申请上市,用于治疗哮喘、荨麻疹、免疫性血小板减少性紫癜、结节性痒疹等病症。6月本月全球孤儿药/突破性/快速通道资格认定品种(部分)一览表
备注:完整数据识别文末二维码下载查看
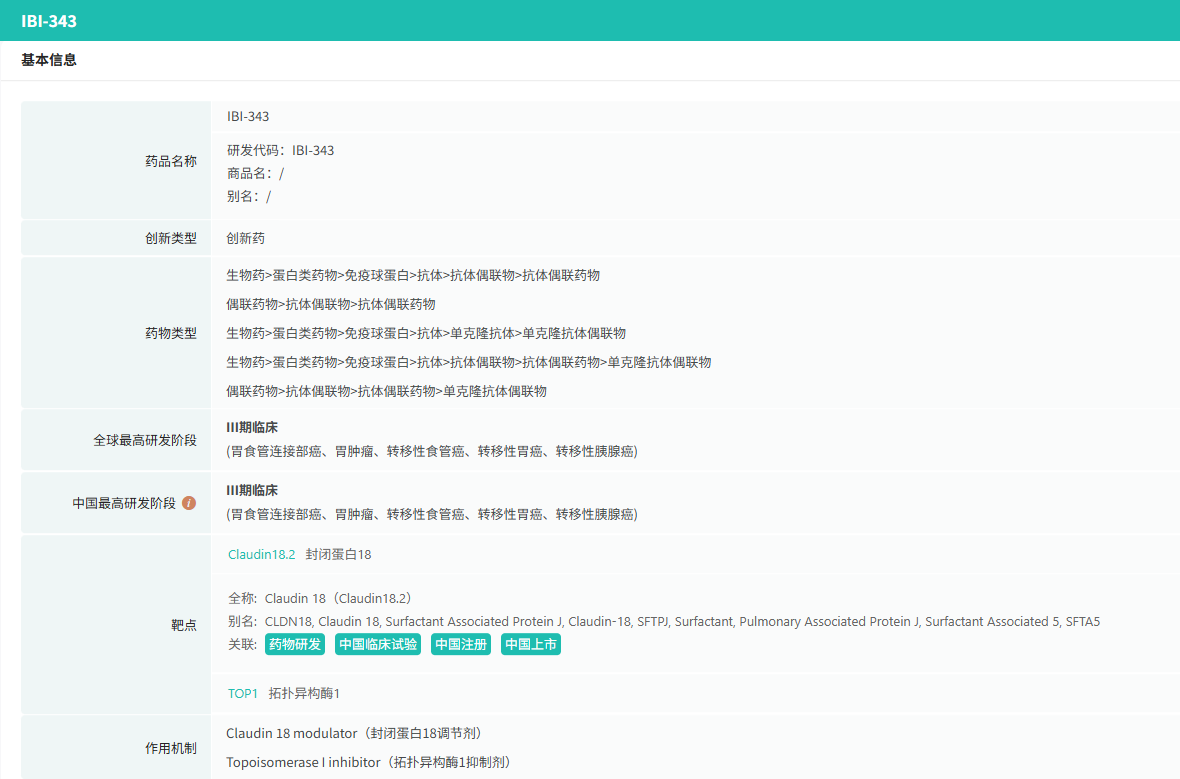
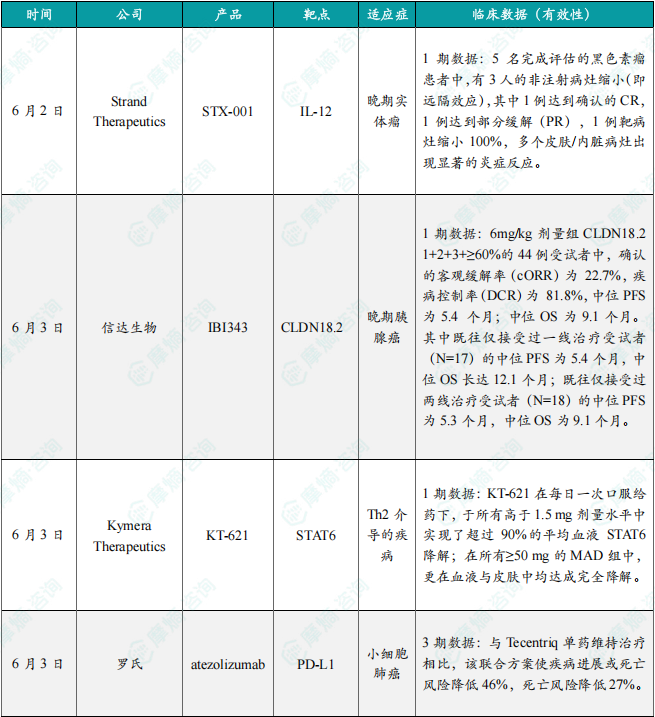
在6月全球创新药研发动态中,6月3日,信达生物在2025年美国临床肿瘤学会(ASCO)年会上口头报道了 IBI343(创新型抗CLDN18.2 ADC)治疗晚期胰腺癌临床1期研究数据更新。本项研究为一项1a/1b期剂量递增和剂量扩展研究(NCT05458219),本次大会公布了扩展队列的最新研究数据:截至2025年3月14日,共有83例胰腺癌患者接受了至少一次IBI343治疗,中位随访时间为11.1个月。截至数据截止日期,6mg/kg剂量组CLDN18.2 1+2+3+≥60%的44例受试者中,确认的客观缓解率(cORR)为 22.7%,疾病控制率(DCR)为 81.8%,中位PFS为5.4 个月;中位OS为9.1个月。其中既往仅接受过一线治疗受试者(N=17)的中位PFS为5.4个月,中位OS长达12.1个月;既往仅接受过两线治疗受试者(N=18)的中位PFS为5.3个月,中位OS为9.1个月。安全性方面,总体耐受性良好,消化道毒性低,未出现新的安全信号。98.8%受试者发生治疗期间不良事件 (TEAE),常见的TEAE为贫血、中性粒细胞计数减少、白细胞计数减少。≥3级恶心、呕吐发生率均为0。根据新闻稿,在经过更长时间的随访后,基于更成熟的PFS和OS数据,IBI343 在治疗CLDN18.2表达阳性的晚期胰腺癌患者中展现出优秀的治疗潜力,有望在这一难治癌种中实现突破。此外,6月27日,辉瑞(Pfizer)宣布其评估TFPI靶向抗体Hympavzi(marstacimab)用于体内存有抑制物的血友病A或血友病B成人和青少年患者的3期BASIS研究获得积极顶线结果。该研究达到了主要终点和关键的次要出血终点,结果显示每周一次皮下注射 Hympavzi 在改善关键出血结局方面优于按需治疗方案。辉瑞计划与监管机构讨论这些数据,目标是启动 Hympavzi 用于伴抑制物血友病患者的监管申请。分析显示,在伴抑制物的严重血友病A或B患者中,Hympavzi 的预防性治疗可显著降低需要治疗的年化出血率(ABR),在统计学和临床上均具有显著意义。在48名血友病患者接受为期12个月的 Hympavzi 治疗后,与接受按需治疗的患者相比,其ABR降低93%(1.39 vs 19.78;p<0.0001)。Hympavzi 在所有出血相关次要终点(自发性出血、关节出血、靶关节出血和总出血)上也显示出优势。该疗法总体耐受性良好,与过去的1/2期结果一致,未报告死亡或血栓栓塞事件。备注:完整数据识别文末二维码下载查看
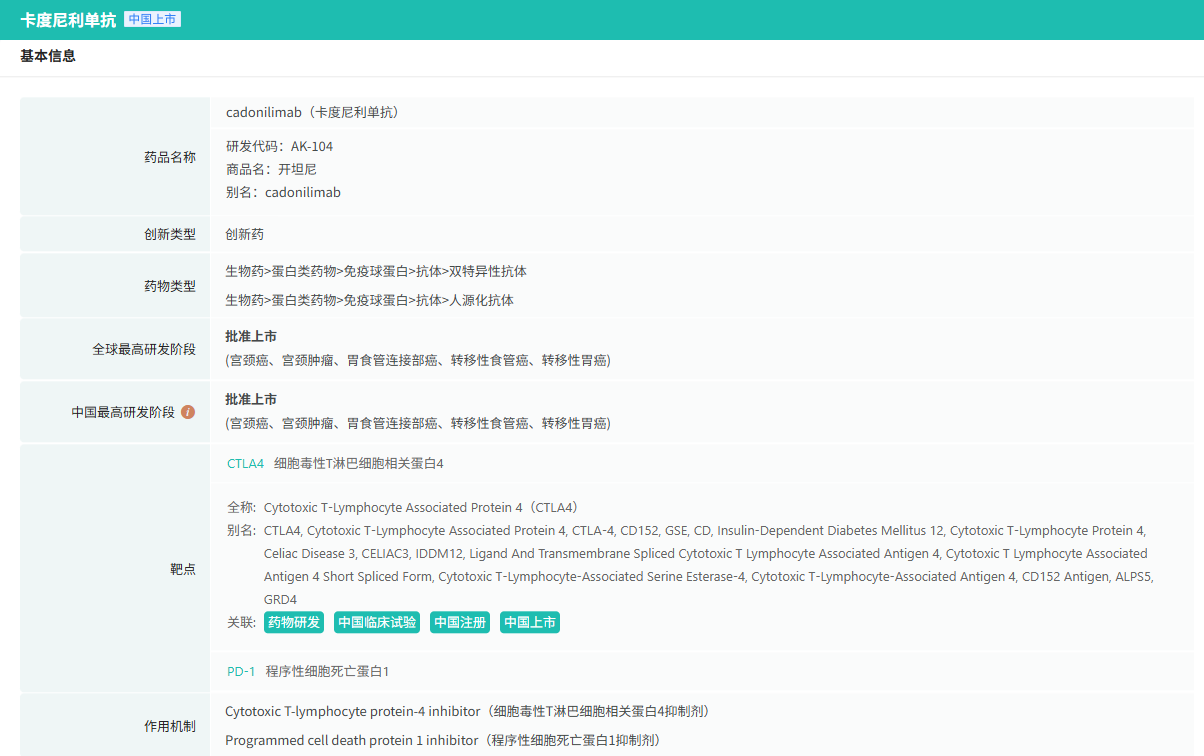
在6月全球创新药研发进展TOP20榜单中,亮点纷呈。6月4日,中国国家药监局(NMPA)官网公示,康方生物研发的PD-1/CTLA-4双特异性抗体卡度尼利单抗注射液的一项新适应症上市申请已获得批准。该药本次获批的适应症为:卡度尼利单抗加含铂化疗联合/不联合贝伐珠单抗用于一线治疗持续、复发或转移性宫颈癌。
卡度尼利是康方生物自主研发的PD-1/CTLA-4双特异性肿瘤免疫治疗药物,最早于2022年6月获NMPA批准,用于既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者的治疗。2024年9月,该药再次获NMPA批准联合奥沙利铂和卡培他滨(XELOX)一线治疗不可手术切除的局部晚期复发或转移性胃或胃食管结合部(G/GEJ)腺癌。相关临床研究数据显示,卡度尼利与PD-1单抗联合CTLA-4单抗的联合疗法相比,毒性显著降低,具有明显的安全性和疗效优势。
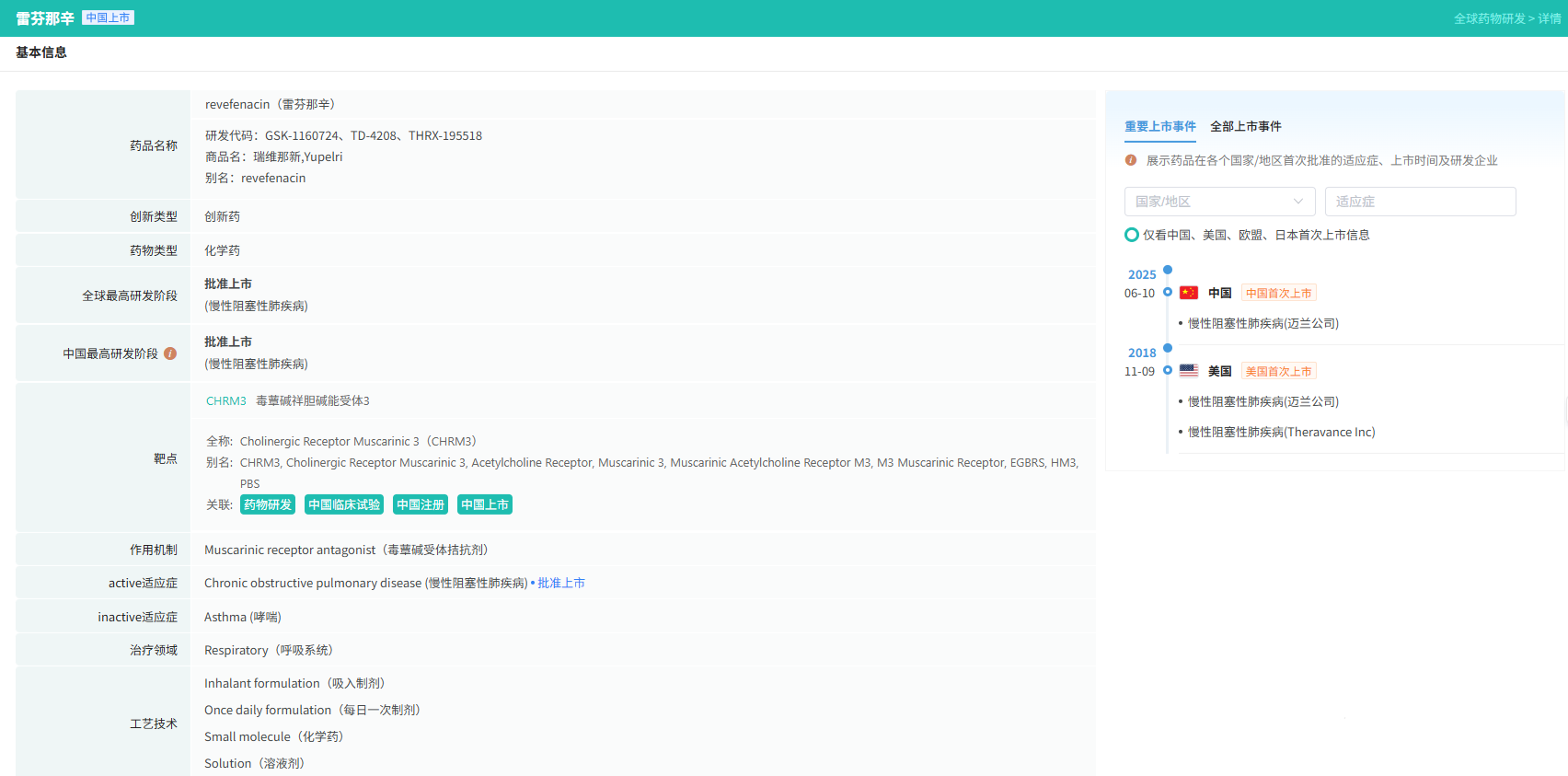
6月12日,中国国家药监局(NMPA)官网公示,晖致医药(Viatris)申报的瑞维那新吸入溶液(曾用名:雷芬那辛吸入溶液,revefenacin)的上市申请已获得批准。公开资料显示,这是一款治疗慢性阻塞性肺病(COPD)的每日一次、长效雾化支气管扩张剂,此前已经于2018年获得美国FDA批准上市(商品名:YUPELRI)。瑞维那新是一种长效毒蕈碱拮抗剂(LAMA)的雾化剂。它具有高度的肺特异性,在每天只用一次的情况下,能够保持长久的支气管扩张,同时防止毒蕈碱拮抗剂的全身性副作用,例如口干、便秘和尿潴留等。瑞维那新吸入溶液最初由Theravance Biopharma开发,晖致医药在2019年通过合作获得了该产品的雾化剂型在大中华区的独家开发和商业化权。