一、CRISPR/Cas简介
CRISPR的全称是Clustered Regularly Interspaced Short Palindromic Repeats(成簇规律间隔的短回文重复序列),形如其名,CRISPR 序列结构正是成簇的规律间隔的短回文重复序列,该序列与CRISPR associated(Cas)蛋白组成CRISPR/Cas系统。CRISPR/Cas系统是原核生物的一种自我保护机制,也是大多数细菌及古细菌中抵御病毒入侵的一种获得性免疫方式。CRISPR 诊断被称为下一代分子诊断技术,主要利用 RNA 来检测血液或尿液等生物液体中的生物标志物,包含样本前处理(含预扩增)、靶标识别、信号释放和检测几部分。在适应阶段,细菌通过Cas蛋白(Cas1和Cas2)捕捉入侵的外来核酸,并整合至自身基因组的CRISPR 序列中形成记忆功能,以便下次出现入侵时,细菌可启动免疫反应;在表达阶段,CRISPR 序列转录生成前体crRNA (pre-crRNA)和反式激活RNA(trans-activating crRNA, tracrRNA),pre-crRNA通过加工,形成含有与外来基因序列匹配的crRNA,crRNA与tracrRNA通过碱基配对形成向导RNA(single-guide RNA,sgRNA),用于Cas蛋白的募集;在干扰阶段,sgRNA引导Cas蛋白定位到与其同源的外来核酸靶标,并激活Cas蛋白的内切酶活性,对靶标核酸进行切割,从而发挥免疫功能。CRISPR在1987年首次被发现, 直到最近几年CRISPR-associated(Cas)诊断技术得到的广泛应用,离不开两位大牛,麻省理工的张锋和加州大学伯克利分校的Jennifer Doudna。两人不但在CRISPR基因编辑上做出奠基性贡献,也对CRISPR在分子诊断行业的应用做了开拓性工作。正是两位大牛在2015~2018这四年的你来我往交锋中,开启了CRISPR分子诊断这一全新领域。国外最早于2016年发现的酶是Cas13 跟 Cas12a的酶,并在2018年发表基于Cas13 跟 Cas12a的酶的检测技术。2020年的诺贝尔化学奖颁给了CRISPR的奠基者Emmanuelle Charpentier和上面提到的Jennifer Doudna,CRISPR技术被誉为会改变和造福人类的发明。CRISPR/Cas技术在基因治疗、合成生物学,疾病模型和科学研究方面的应用如爆发的火山,一发不可收拾。2022年,Nature发布年度值得关注的技术榜单,其中CRISPR-Cas诊断检测被列为其中之一,通过Cas12酶或者Cas13酶的特征,可检测广泛的病原体,乃至有效地诊断其他非感染性疾病。目前国内外的公司借助CRISPR检测技术已经可以在30分钟内实现针对病原的快速、准确的检测。迄今为止,基于CRISPR的诊断主要应用在传染病的检测。2022年8月4日,伦敦帝国理工学院和博德研究所的研究人员开发了一种易于使用的 CRISPR 检测技术,这项新检测技术通过检测生物标志物,在室温下能够更快地诊断心脏病和癌症等非传染性疾病,且操作简便。相信假以时日,CRISPR 检测技术在遗传性疾病、其它非传染性疾病和癌症检测上一定会大放异彩。
2015年,上述两个团队发现了CRISPR的新酶,可以进行非特异性的切割,CRISPR检测技术便由此展开。
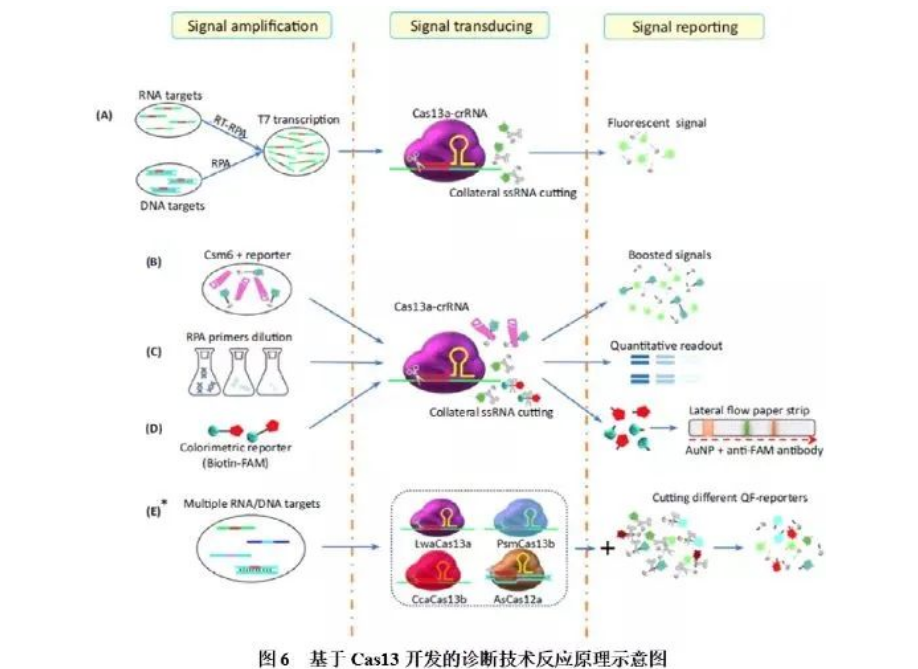
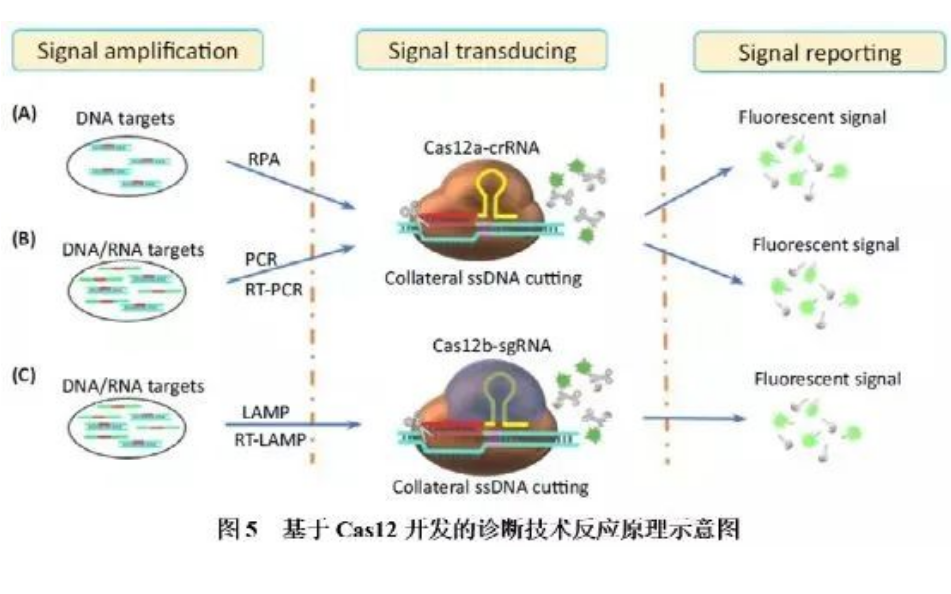
CRISPR诊断的原理就是:当待检体系中存在靶标核酸时,Cas蛋白在向导RNA的引导下特异识别靶标序列,形成复合物,进而被激发出针对单链RNA的“附带切割活性“,将体系中的荧光标记探针切碎,发出荧光信号,完成检测过程,通过检测体系是否发光来判断靶标核酸是否存在。CRISPR/Cas系统反式切割活性的检测技术所用的Cas蛋白主要有Cas12、Cas13和Cas14,这类蛋白除了具有特异性切割靶序列的功能外,在激活状态下,还具有非特异性切割其它核酸序列的功能。在没有激活的状态下,Cas蛋白保持沉默,不会胡作非为;一旦被激活,便会进行非特异性切割其他携带荧光信号的核酸序列,也就是对非靶标核酸进行切割,像一个没有感情的收割机,高举镰刀,看到韭菜就要割,被割下的一茬茬绿油油韭菜,释放荧光信号,即是可用来检测的信号。
Cas12在crRNA引导下即可识别靶标dsDNA,并靶向富含T的PAM位点,对靶序列进行特异性切割,同时附带非特异性切割ssDNA的活性。靶标核酸经等温(RPA或LAMP)扩增富集,然后扩增产物与Cas12-crRNA结合,激活Cas12的附属切割功能,对ssDNA荧光探针进行切割,释放荧光基团,形成检测信号。
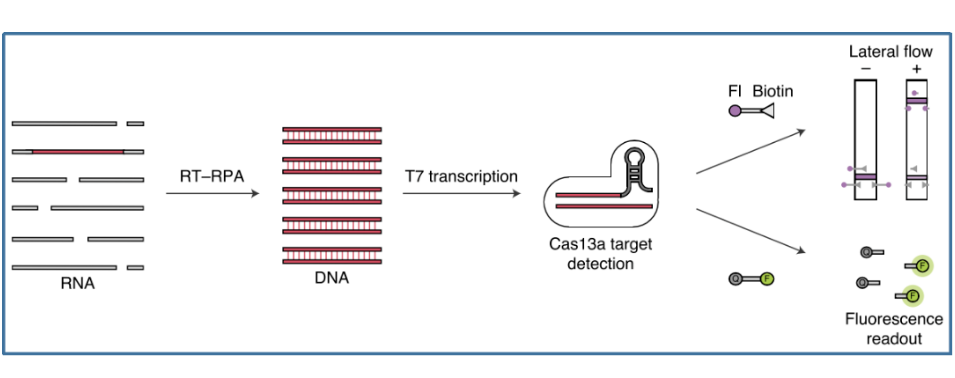
Cas13是一种RNA引导的RNA核酸内切酶,可在crRNA的引导下特异性切割单链靶标RNA,并在完成切割后,可继续保持活性并切割其他非靶标RNA。靶标核酸经等温扩增技术RPA扩增并引入T7启动子序列后,再利用T7 RNA聚合酶转录形成ssRNA,转录产物与Cas13a-crRNA结合,激活Cas13a核酸酶活性,切割ssRNA荧光探针,释放可被检测的荧光基团。基于Cas蛋白的这个特点,张锋和Jennifer Doudna各自创立了对应的体外诊断公司,专注于开发与CRISPR/Cas系统相关的体外诊断技术及产品。
三.未来可期
CRISPR/Cas系统具有作为疾病和病原体检测诊断工具的潜力。大多数已报道的 CRISPR/Cas生物传感系统具有高分辨率(单碱基分辨率)、高灵敏度(达到amol 级)、低成本( 1美元以下)、操作简易(裸眼判读的试纸)、易储存(室温下储存一年以上)的优点。
具有反式切割活性的三种Cas蛋白(Cas12、Cas13和Cas14)被激活后,可对非靶标核酸进行切割,将检测信号进一步放大,提高了检测灵敏度,同时gRNA对靶序列的特异性识别,进一步提高了检测特异性,使得CRISPR/Cas诊断系统具有高灵敏度、高特异性的特点。不同特性Cas蛋白的发现,丰富了检测核酸类型的选择,从dsDNA到ssDNA再到RNA,均可作为CRISPR/Cas分子诊断系统的靶序列,结合层析技术等显色反应,还可实现检测结果的可视化,为分子POCT领域的应用场景带来了无限可能。
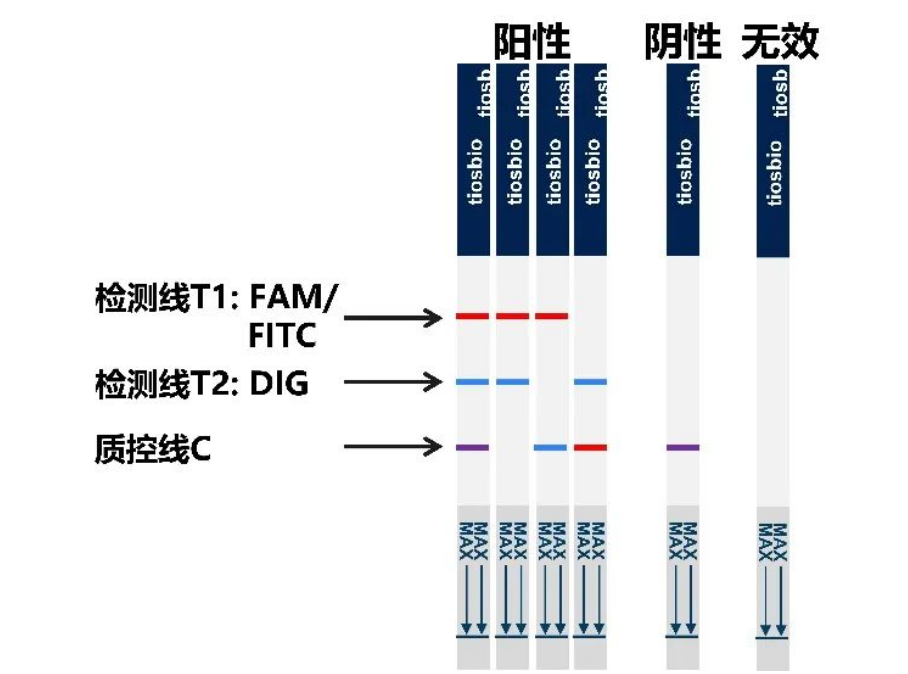
Tiosbio宝盈同汇双靶标核酸检测试纸条
作为一种可特异性识别靶序列,具有催化放大信号功能,可直接对靶标序列进行检测的技术,按目前的检测方法,大多需要预先扩增 RNA 靶标来放大信号,这增加了操作步骤,耗时也更长了。
另外CRISPR/Cas系统的反式切割活性具有随意性,对实现定量和多靶标检测有一定难度。现有Cas蛋白大部分依赖于PAM序列发挥作用,对靶标序列的选择受到限制。作为一种基因编辑技术,其脱靶效应的存在也会影响到诊断结果的准确性。
但是,CRISPR/Cas系统作为下一代诊断技术的引领者,相信国内外研究者能改进驾驭这个技术,使其更趋近于理想的诊断技术。未来可期!
参考资料 :https://mp.weixin.qq.com/s/2JQR5Eth1trgy1wdPvpyRg;https://mp.weixin.qq.com/s/20ALfr-wMvtWUZxn8p2VpQ