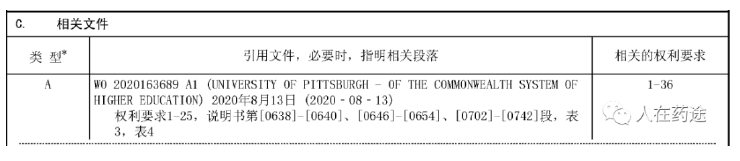
目录
GPR75与20-HETE
GPR75小分子拮抗剂——文献与专利溯源
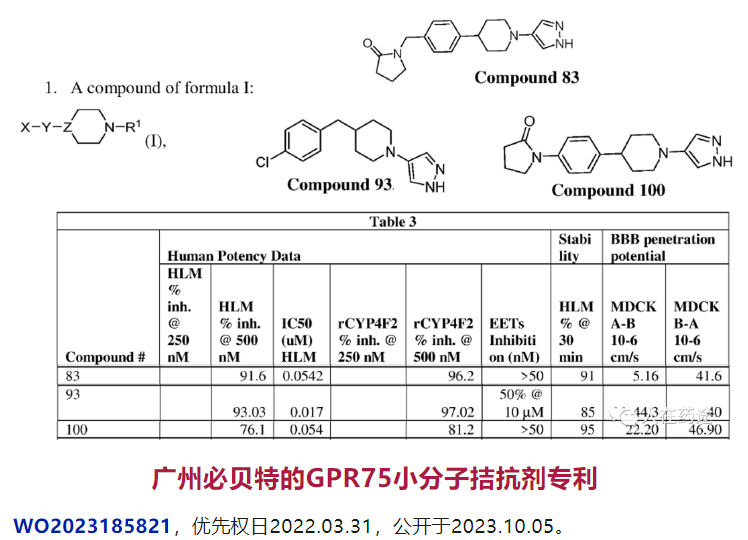
广州必贝特的GPR75小分子拮抗剂专利
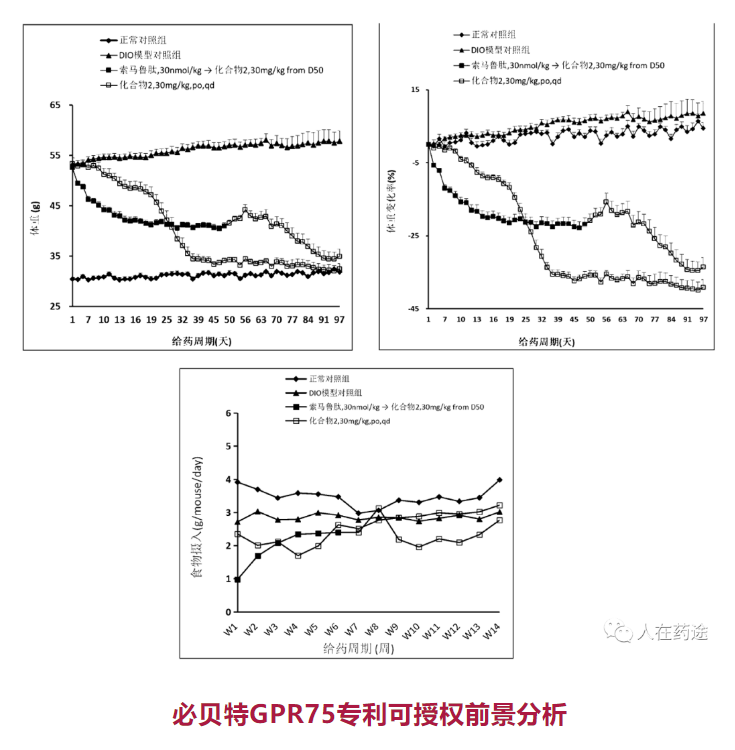
必贝特GPR75专利可授权前景分析
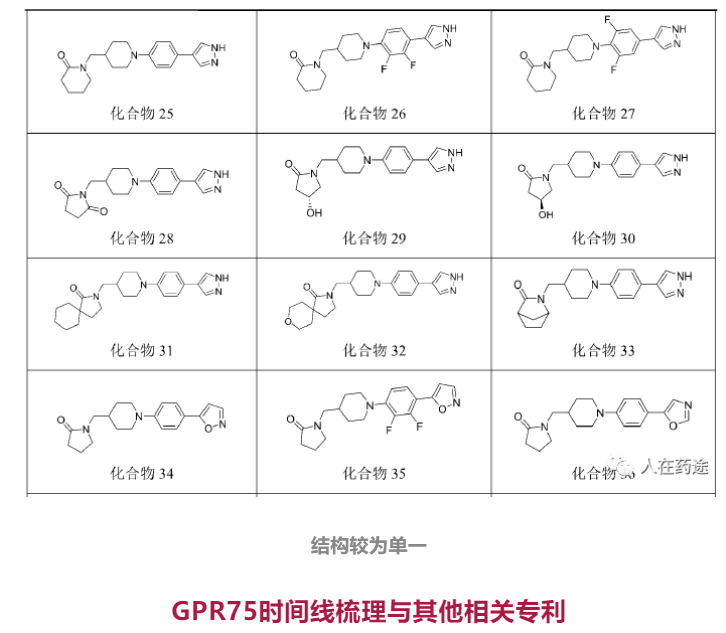
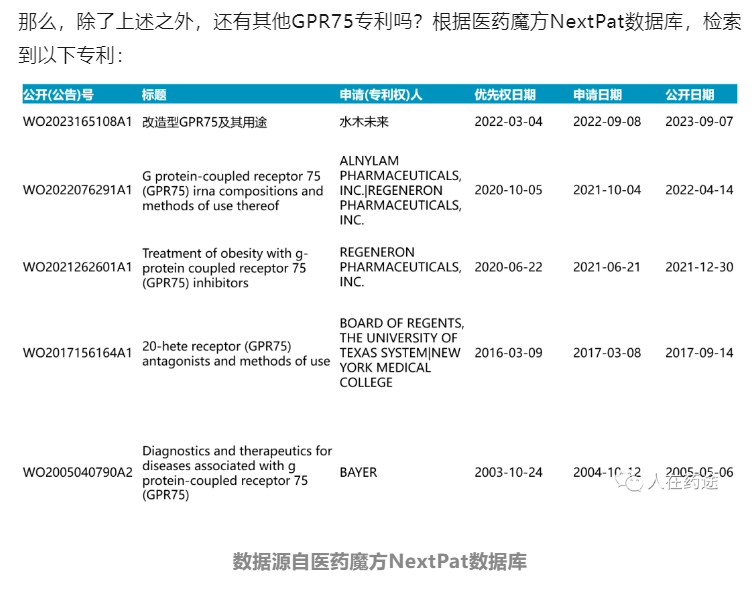
GPR75时间线梳理与其他相关专利
GPR75与20-HETE
20-羟基二十碳四烯酸(20-HETE)是由细胞色素P450(CYP)4A和4F家族酶产生的花生四烯酸(AA)的代谢物。在小鼠中Cyp4a12是20-HETE的主要生成酶,大鼠体内产生20-HETE的酶包括Cyp4a1、Cyp4a2和Cyp4a3。人体内产生20-HETE的主要酶是CYP4A11和CYP4F2(PNAS 2017,114-3181-3185;Onco Targets Ther.2013;6:243–255;Hypertension.2008;51:1393–1398)。
20-HETE可促进血管平滑肌收缩、内皮功能障碍、炎症和细胞增殖(Curr Opin Nephrol Hypertens 26:74–82,2017.)。研究表明,缺血事件后20-HETE 合成增加,20-HETE合成抑制剂可保护神经元并预防脑血流障碍、脑水肿和血脑屏障 (BBB) 受伤后功能障碍。
多项研究表明,在高血压、中风、冠状动脉疾病、心肌梗死、急性肾衰竭、慢性肾病、多囊肾病、以及肿瘤生长和转移,终末器官损伤和纤维化等多种疾病中,20-HETE的表达水平显著增加(J Lipid Res 54:786–793,2013.,Pharmacol Ther 125:446–463,2010.)。
20-HETE在肥胖、胰岛素抵抗和代谢综合征的发生和进展中同样发挥了重要的作用。临床前动物模型表明20-HETE水平与体重增加和代谢综合征(包括高血糖、糖尿病、以及糖尿病相关视网膜病变和肾病)之间存在相关性
(Am J Physiol Endocrinol Metab 302(5):E500-9,2012.,Am J Physiol Regul Integr Comp Physiol 315(5):R934-r44,2018.)。临床研究表明,尿和血浆中的20-HETE水平与身体质量指数(BMI)相关,并在肥胖、糖尿病和代谢综合征患者中升高(Other Lipid Mediat 100-101:15-21,2013.,Prostaglandins Other Lipid Mediat 123:68-77,2016.Free Radic Biol Med 46(2):263-70,2009.)。 此外,过度表达 Cyp4al2-20-HETE 合酶的小鼠在喂食高脂肪饮食时,会迅速出现肥胖、高血糖、高胰岛素血症和糖耐量受损。这些动物的骨骼肌、肝脏和脂肪组织也出现了胰岛素抵抗。
2017年,Garcia等人发现孤儿受体GPR75是20-HETE特异性受体,并报道了20-HETE导致高血压和血管功能障碍的近端信号机制(Circ Res 2017;120:1776–1788)。敲除 GPR75 或 GPCR 激酶相互作用蛋白-1 可防止 20-HETE 介导的内皮生长因子受体磷酸化和血管紧张素转换酶诱导。
2021年,再生元Science发文揭示肥胖新靶点GPR75。通过对近65万人进行测序,并识别出具有罕见保护性突变的个体,发现至少有一个G蛋白偶联受体75(GPR75)基因非活跃拷贝的个体的体重指数(BMI)较低,体重往往比没有突变的个体轻约12磅,肥胖风险降低 54%,并显示出糖尿病参数的改善,包括降糖。4在高脂饮食模型中,敲除小鼠的GPR75基因导致了对体重增加的抵抗和血糖控制的改善。这一研究直接表明了抑制GPR75可能为肥胖提供了一种治疗策略(Science 373,eabf8683,2021.) [“瘦子基因”找到了!再生元Science发文揭示肥胖新靶点——GPR75]。这一里程碑文章发表后没多久,便传来了阿斯利康与再生元合作开发靶向GPR75小分子抑制剂的新闻报道[针对肥胖!阿斯利康与再生元合作开发靶向“瘦子基因”GPR75的药物]。
2022年,水木未来在BioRxiv上以预印版的形式,报道了通过人源GPR75的序列优化,获得首个高分辨率GPR75结构(https://doi.org/10.1101/2022.08.18.503988)。这一结构的获取将很大程度加速GPR75靶向药物的开发。已有头部企业与水木未来开展GPCR靶向药物开发的合作。
2023年1月,广州必贝特科创板上市申请IPO过会,在其招股书中,表明其用于治疗肥胖的GPR75小分子拮抗剂已到了CMC阶段,预计2023年提交IND,表明其GPR75小分子拮抗剂的研发已经走在全球前列。除此之外,诺奖得主创办的ConfometRx也于其公司官网公布其GPR75管线,目前正处于Lead优化阶段。
GPR75小分子拮抗剂——文献与专利溯源
鉴于20-HETE/GPR75通路在诸多疾病的发生发展中起着重要的作用,20-HETE配体生成抑制剂或GPR75受体拮抗剂可能提供治疗肥胖症、糖尿病等多种代谢性疾病的选择。
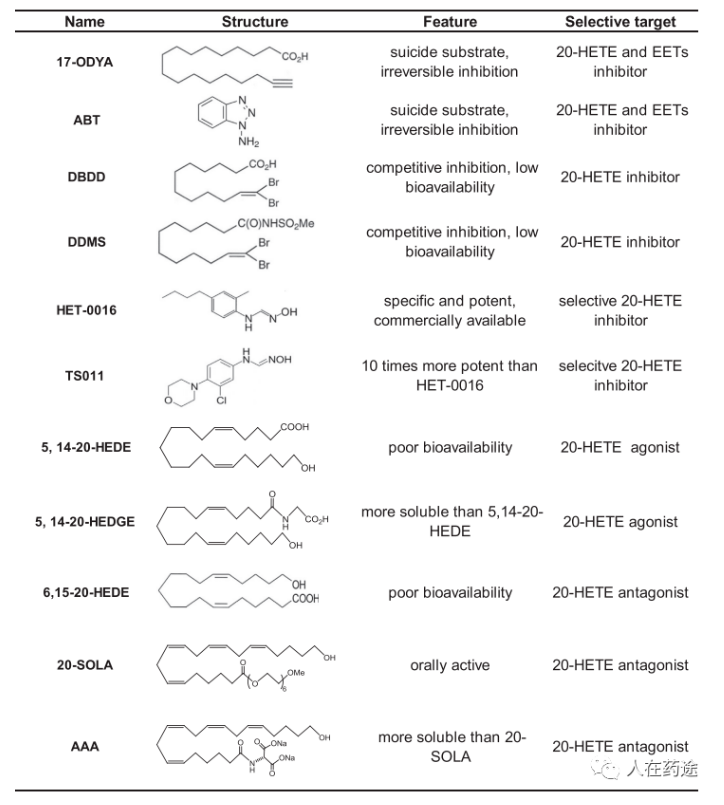
20-HETE相关药物开发(European journal of pharmacology, 2018, 833: 190-200.)
起初开发的20-HETE相关药物均为其结构类似物。由于这类化合物的结构必然导致其低pH、溶解度差、半衰期极短等弊端,同时这些化合物药效弱、选择性低,不适合进一步进行药物开发。另一类结构如HET-0016与TS011,具有较高的效力和选择性,但药代动力学特性较差,成为了进一步优化的起点。
通过专利检索能够发现,HET-0016出自大正制药的专利WO2004024677,大正在02-04年间共申请了四篇20-HETE抑制剂专利。顺着这条线,找到了大正最新的相关专利WO2019031618,部分化合物结构如下。生物学活性上,部分化合物也具有纳摩尔活性,但从结构上看这类化合物成药性堪忧。
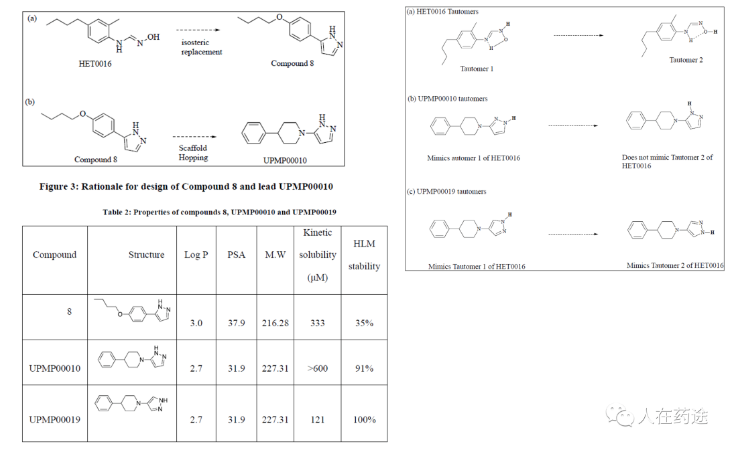
在此基础上迈出一大步的事匹兹堡大学的McDermott lab,通过对HET-0016进行生物电子等排得到了Compound 8,并进一步通过骨架跃迁得到了UPMP00010与UPMP00019两个化合物,在代谢稳定性方面得到了极大的提升(https://d-scholarship.pitt.edu/35025/)。详细改造思路见引用。可以看到McDermott的改造与大正制药有异曲同工之妙,但从其他信息可知这类改造可追溯到早于2018年,远早于大正制药专利公开时间,因此更能代表首创性。
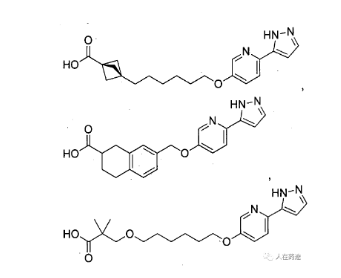
在权利要求上,必贝特可谓是花了很大的心思。从马库什上也能看出来,必贝特给圈了个很大的权利要求保护范围(只限定了芳香环母核)。代表性化合物结构如下。
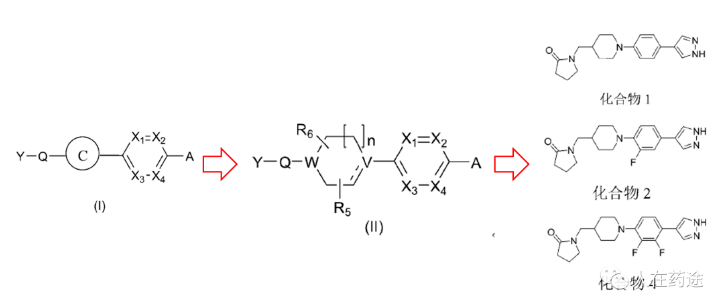
生物学评价上,必贝特还在专利中指明了与其最接近的现有技术,即为匹兹堡大学的WO2020163689,对照化合物便是专利中的Cpd.83。
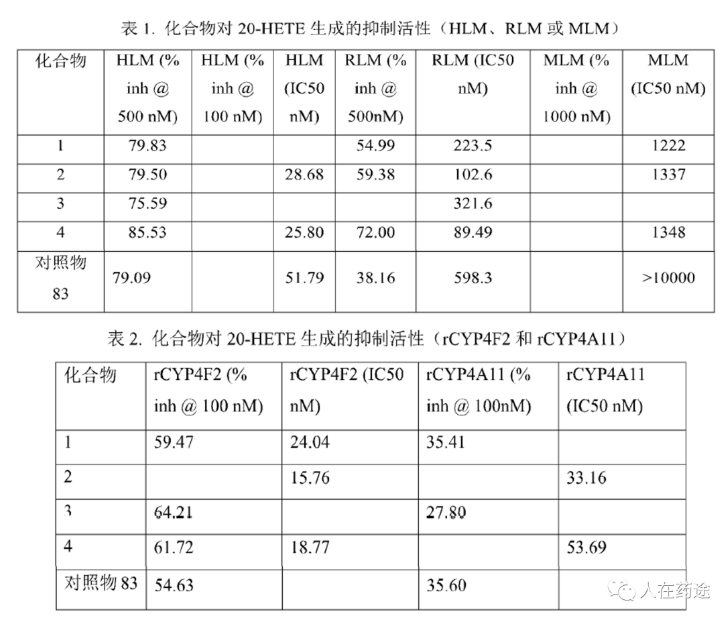
抑制 20-HETE 生成活性是通过测试化合物对人肝微粒体(HLM)或大鼠肝微粒体(RLM)或小鼠肝微粒体(MLM)以及CYP4亚型酶特异性底物(CYP4F2)的抑制活性来评价的(存在种属差异性)。其中Cpd.2与Cpd.4均具有不错的活性,且优于对照Cpd.83。
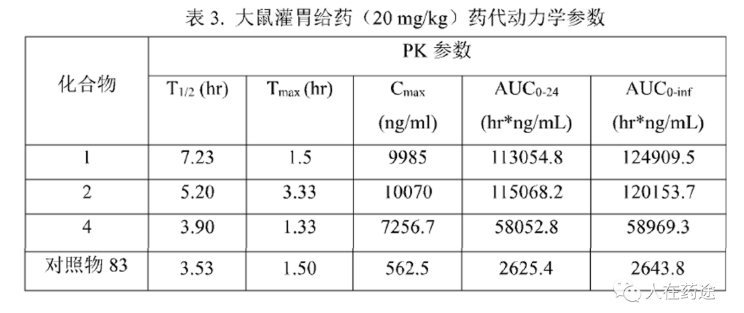
在成药性评价上,必贝特选择大鼠灌胃给药(20mg/kg)评价其PK参数。结构对比能发现,Cpd.1与对照Cpd.83仅是母核调换的差异,但在药代上却存在显著的优异效果(>2倍的半衰期,18倍的Cmax,43倍的AUC)。不可谓不是预料不到的技术效果。Cpd.2与Cpd.1的差异仅在苯环上多一个F,药代参数也相近。
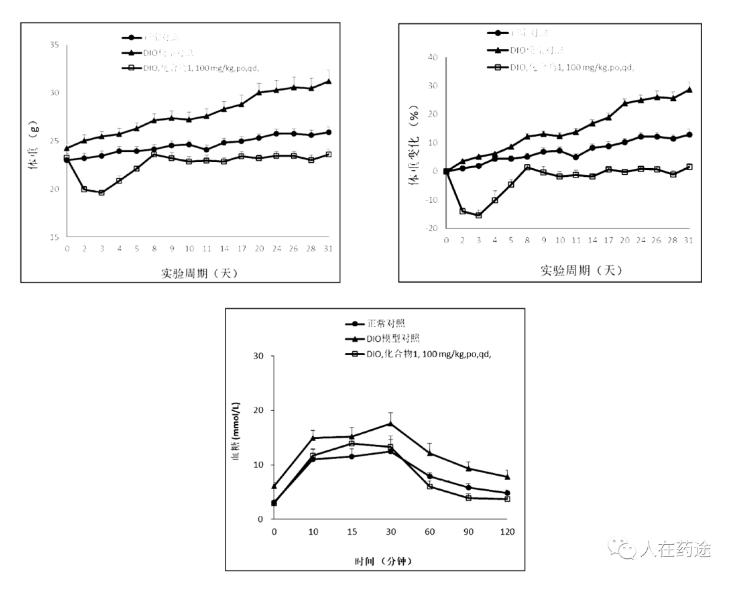
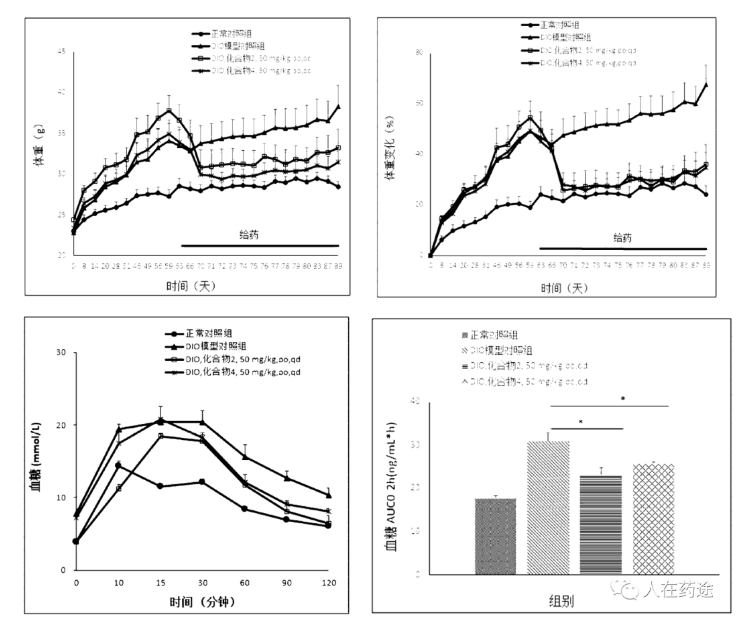
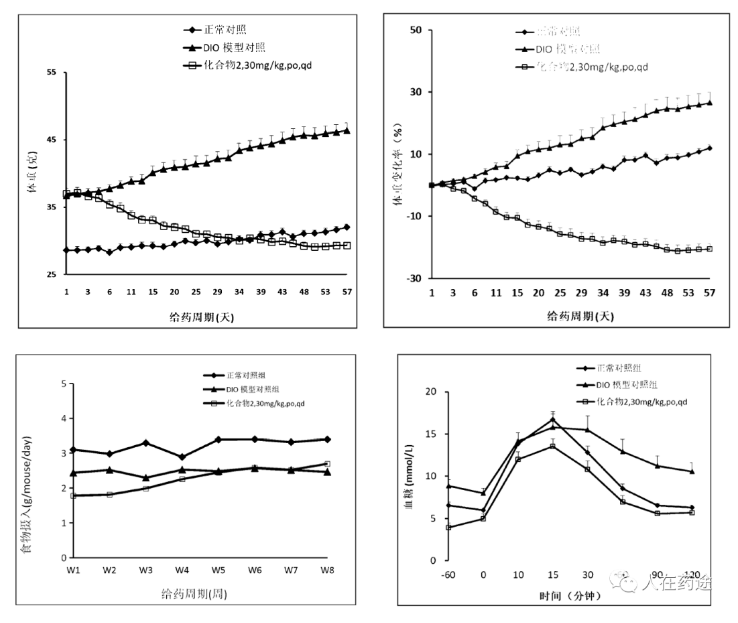
接着是Cpd.2与Cpd.4。50 mpk, po, qd给药前各组动物体重持续上涨,DIO小鼠增长幅度明显大于正常饮食小鼠,在第63天开始给药,给药的第一周两给药组动物体重快速下降达到给药前的12%-16%,第二周开始动物体重趋于稳定并一直维持;化合物2和化合物4长期给药能抑制DIO小鼠的空腹血糖升高,Cpd.2和Cpd.4长期给药能增强对葡萄糖的代谢。且Cpd.2略优于Cpd.4。

Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 南京市江宁区科学园乾德路5号