前言
目前临床上所使用的小分子药物大部分以蛋白为靶标, 小分子药物通过与靶标蛋白上的特定位点结合而发挥药效,然而可成药的蛋白在总蛋白数中占据较少部分。“不可成药”蛋白占人体总蛋白的80%。因为大部分的蛋白并没有合适的药物结合位点。在中心法则中, RNA处于蛋白质的上游, 控制着蛋白质的翻译, 靶向RNA的小分子药物研究在一定程度上可以解决蛋白“不可成药”的难题。本综述文章总结了近年来靶向RNA小分子药物研究领域的代表性研究成果, 以及靶向RNA小分子药物的筛选方法, 并着重分析了靶向新冠病毒RNA的小分子药物的最新进展。
小分子药物一直是当前药物研发的主流方向。在2005~2020年FDA批准的新药中,小分子药物的占比在70%~90%。在2020年FDA批准的53个新药中, 小分子药物有38个。相比于大分子抗体药物, 小分子药物具有许多优点: 给药方便、可口服、存储运输方便、药物进入细胞后可以很好地作用于细胞内与细胞外的靶点。除此之外, 小分子药物能透过血脑屏障且几乎不具有免疫原性, 具有较好的广谱适应性。小分子药物在体内与特定的靶点结合后才能发挥药效, 现有的小分子药物靶标主要是蛋白质, 但人体内有超过80%蛋白不能成为小分子的作用靶标(如转录因子、支架蛋白等), 这些蛋白被称为“不可成药”蛋白(undruggable protein), 这导致了与这些蛋白相关联的疾病很难通过小分子靶向策略进行干预治疗。
在中心法则中, 核糖核酸(ribonucleic acid, RNA)处于蛋白质的上游, 控制着蛋白质的翻译, 对RNA进行干预可以调控蛋白质的翻译, 进而间接实现治疗疾病的效果, 使一些蛋白“不可成药”的难题得以解决。RNA是体内的一类大分子物质, 种类繁多, 在遗传编码、翻译、调控和基因表达等多种过程中有重要作用。从脱氧核糖核酸(deoxyribonucleic acid, DNA)转录后, RNA会折叠成不同的二级(碱基配对)和三级(3D)结构。通过与核糖体上的蛋白形成氢键, RNA会形成不同的结构包括螺旋、发夹环、凸起和假结, 这些结构之间相互作用, 形成更高阶的三级结构。这些具有复杂结构的RNA发挥着基因表达调控、催化等许多重要的生物学功能, 这些结构也使得RNA的表面或口袋具有一定的成药性。
RNA在人类基因组中占比很高, 其中非编码RNA的序列占到了基因组的70%, 比编码蛋白质的序列高一个数量级, 这些丰富的RNA结构为小分子药物提供了丰富的靶标。发展可靶向RNA的小分子药物是以蛋白为靶标的药物开发策略的重要补充, 具有更广阔的应用前景。现有的靶向RNA的疗法主要是通过核酸等大分子药物对编码RNA进行干扰实现的, 现已批准的该类药物包括Ionis Pharmaceuticals公司的反义寡核苷酸疗法(antisense oligonucleotide, ASO):Spinraza(nusinersen)和Tegesedi(inotersen), 以及Alnylam Pharmaceuticals公司的小干扰RNA(small interfering RNA, siRNA)疗法: Onpattro(patisiran)。除此之外, CRISPR-Cas系统在RNA靶向应用中也取得了一定的研究进展, 比如CRISPR-Cas13d系统。虽然这些疗法的特异性较高, 但存在较大的递送难题, 并且核酸酶敏感, 同时不易在体内分布,在治疗过程中也存在较大的安全性和效力的难题。例如, 已获批用于治疗脊髓性肌萎缩症(spinal muscular atrophy, SMA)的反义寡核苷酸药物Spinraza(nusinersen)必须通过直接注射到脊柱中, 而传统的小分子药物则不存在这种障碍, 因此发展可直接靶向RNA的小分子药物具有很好的前景。另一方面, 随着新型冠状病毒的大流行, 目前缺乏有效的治疗新冠的药物, 通过直接靶向新冠病毒RNA阻断该病毒在体内的复制来开发抗病毒药物, 成为一种新型药物研发策略, 受到了不少科学家的关注。
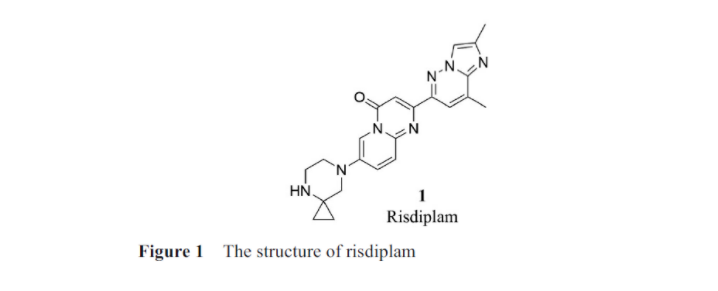
蛋白质由20种不同的氨基酸构成, 具有很高的特异性和辨识度, 但RNA仅由4种核苷酸构成, 因此它们三维结构的复杂度比蛋白质的要低很多, 导致RNA结构没有很高的特异性。这使得找到一种仅结合单一RNA且无广泛不良反应的药物变得困难。同时, RNA的动态结构不断摇摆, 鉴定其三维结构也具有一定的难度, 这也为基于结构的RNA靶向药物设计带来了困难。因此, 以RNA作为靶标的小分子药物研发仍然是一个难点。2020年8月, Evrysdi(risdiplam,1, 图1)获FDA批准上市, 成为第一个获批上市的靶向RNA的小分子, 随后Evrysdi在SMA治疗市场的份额不断增加, 2020年第三季度累计销售额达890万美元。Evrysdi是由PTC Therapeutics、SMA基金会和罗氏联合开发, 其获批具有里程碑意义。该药物通过直接靶向RNA或RNA-蛋白质复合物起作用, 而不是仅仅靶向与疾病有关的蛋白质。随后, 多家公司建立了以RNA作为靶标的小分子药物筛选平台, 以RNA作为靶点的小分子药物研发逐渐走进人们的视野, 吸引了越来越多的药物化学家的青睐。本综述将会对近年来靶向RNA小分子药物的筛选方法及其领域的代表性研究成果进行介绍。
靶向RNA小分子药物的筛选方法
目前用于发现可与RNA结合的小分子药物的方法有很多, 其中筛选是以RNA为靶标的小分子药物研发的最常见的技术。传统上, 有两种方法可以用于筛选小分子: 第一种是基于靶标的筛选, 它是通过评估各类小分子对疾病相关的特定靶标(如酶、受体或RNA)的结合力来确定先导小分子的结构; 第二种是表型筛选, 即通过小分子对细胞或生物体的影响进行评估, 筛选出能产生所需表型的小分子药物。目前, 以RNA为靶标的小分子药物筛选多采用第一种策略, 基于片段的靶向RNA的小分子药物筛选方法已经与各种生物物理技术协同实施。比如, 用小分子微阵列(small molecule microarray, SMM)筛选平台以RNA为靶标的小分子库筛选, 还有许多高通量筛选方法, 包括基于质谱、荧光的方法已经被开发出来, 用于评价RNA与小分子的相互作用。虽然高通量筛选方法仍然很受欢迎, 但新开发的筛选方法, 如基于碎片的筛选、核磁共振(nuclear magnetic resonance, NMR), 均可促进发现新的靶向RNA小分子药物和新的RNA靶点。NMR可以根据化学位移变化定性地鉴定小分子在核酸中结合位点。通过将这些方法与基因组中RNA二级结构预测研究相结合, 人们可以针对基因组序列中各种未开发的RNA结构快速设计小分子。
除此之外, 信息学的方法也有助于RNA药物的发现。例如, Disney课题组开发了通过统计不同结构小分子与不同折叠RNA序列之间的相互作用信息, 来寻找特异性靶向某致病RNA的小分子的方法(Inforna)。通过这种方法, 他们在癌细胞的RNAs中挖掘信息, 结合药物-RNA序列相互作用的数据库, 发现了能够靶microRNA-96的抗肿瘤小分子。基于结构的药物设计和虚拟筛选策略也已被用于RNA配体对接分析。Aguilar等通过自动配体识别系统(ALIS, 一种基于亲和选择质谱的无偏筛选方式), 鉴定发现了特异性结合Xist的小分子。
靶向RNA小分子药物的分类
目前, 靶向RNA的小分子药物已经在抗病毒、抗菌、RNA剪切体及RNA重复片段有着广泛的应用, 本文将以每个应用类型中的代表性例子进行阐述。
■ 靶向病毒RNA小分子药物
病毒核糖核酸基因组的翻译是通过核糖体结合到高度结构化的核糖核酸元件即内部核糖体进入位点(internal ribosome entry site, IRES)开始的, 这为治疗病毒类疾病提供了一个新的靶点。这一结构通常存在于病毒基因组的非翻译区(untranslated region, UTR)。丙型肝炎病毒(hepatitis C virus, HCV)核糖核酸的5′-UTR含有一个大的结构域, 作为IRES,丙型肝炎病毒复制需要IRES介导的翻译。赫尔曼实验室多年来一直在研究以IRES为靶点的丙肝药物, 在靶向RNA的小分子文库的筛选中, 他们发现了化合物2(图2), 该化合物可以与IRES区域结合减少病毒复制。Ibis Therapeutics公司通过将小分子库与质谱筛选方法联用, 发现了丙型肝炎病毒IRES核糖核酸的功能抑制剂: 化合物3和4, 这两个小分子可以结合在HCV RNA IRES IIA亚结构域, 影响病毒复制和翻译。
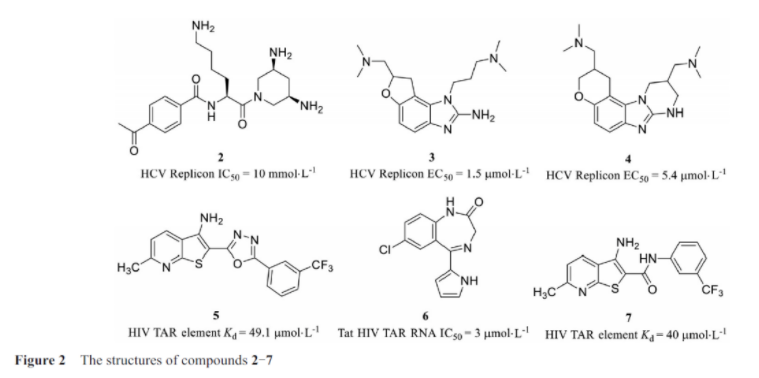
人类免疫缺陷病毒1型(human imrnunedeficiercy virus type 1, HIV-1)是最常见的获得性免疫缺陷病毒类型, 也是致死性极高的传染病。目前还没有能够治愈艾滋病(acquired immune deficiency syndrome, AIDS)的药物, 以HIV病毒的RNA为靶标是很有潜力的药物开发策略。反式激活应答(transactivation response, TAR)RNA, 是一种位于病毒基因组5′-UTR中的核苷酸茎环RNA, 通过与反式激活蛋白(transactivator, Tat)结合, 促进病毒基因组的转录, HIV-1的TAR RNA是研究小分子RNA拮抗剂的一个良好的靶标。Tat是一种病毒编码的蛋白质, 可以通过招募宿主转录机制来促进病毒DNA的有效转录, 而TAR RNA则通过与Tat的相互作用在艾滋病毒复制中起着关键性作用。Abulwerdi等发现噻吩并吡啶类化合物可以与HIV-1 TAR RNA发夹结构结合并破坏Tat-TAR的相互作用。筛选发现对TAR发夹结合亲和力最好的化合物5的Kd值49.1 μmol·L-1。Parke-Davis的研究人员使用各种常见的高通量筛选技术筛选出了干扰Tat蛋白与TAR结合的小分子化合物6, 研究中发现该化合物可以选择性地抑制细胞中艾滋病毒对巨细胞病毒Tat的反式激活。Schneekloth小组在对一个空间排列的小分子文库进行结构筛选时, 发现了可以结合并抑制艾滋病毒TAR功能的小分子化合物7。
■ 靶向细菌RNA的小分子药物
在细菌中, 小分子通常结合在细菌基因组的5′-UTR区域含有核糖核酸的调节元件上, 从而来控制mRNA相关蛋白的翻译水平。这些调节元件被称为核糖体开关, 而这些小分子通常为代谢产物。核糖体开关包括可以识别并结合配体的保守序列适配体区(aptamer domain, AD), 以及结构多变、可以调控下游编码基因的表达平台区(expression platform, EP)。迄今为止, 许多发现的抗生素均是以核糖体RNA(ribosomal RNA, rRNA)为靶点, 发挥抑制细菌的生长的作用。目前已有多种靶向核糖体开关的药物被发现。吡啶硫胺(pyrithiamine, PT)是一种具有抗菌作用的硫胺素类似物, 其靶点是硫胺素焦磷酸(thiamine pyrophosphate, TPP)核糖开关, TPP是丙酮酸脱氢酶(pyruvate dehydrogenase complex, PDH)、α-酮戊二酸脱羧酶(oxoglutarate dehydrogenase complex, OGDH)、转酮醇酶(transketolase, TK)、乙酰羟基酸合成酶(acetohydroxyacid synthase, AHAS)等酶类的重要辅酶。TPP核糖开关负责调控硫胺素合成或转运相关基因的表达, 当TPP核糖开关被结合时形成转录终止子, 硫胺素合成和转运相关基因的转录终止, 信使RNA(messenger RNA, mRNA)生成受到抑制。PT与TPP核糖开关结合抑制细菌硫胺素的合成和转运, 破坏细菌代谢途径, 从而起到杀菌作用。天然产物玫瑰黄色素结构与核黄素类似, 能够与枯草芽孢杆菌的黄素单核苷酸(flavin mononucleotide, FMN)核糖开关结合而抑制细菌生长。Breaker小组(耶鲁大学)的实验室在研究中发现了玫瑰黄酮化合物8(图3), 一种天然抗菌物质, 它可以和FMN核糖开关结合, 发挥抗菌作用。除此之外, 这个研究团队还发现了鸟嘌呤、赖氨酸和TPP核糖开关的类似物9~11, 这些小分子均通过与核糖开关结合而抑制其原有的作用过程。Maciagiewicz等在研究中发现恶唑烷酮小分子化合物12, 可以作为T盒核糖开关(T-box riboswitch)的配体使用。默克公司(Kenilworth, NJ)报道了一种可以选择性地抑制FMN的表达的小分子化合物13(ribocil-B)。这个小分子选择性抑制FMN的表达, 通过结合并抑制FMN核糖开关起作用, 从而干扰mRNA翻译。Ribocil是第一个合成的小分子的抗生素, 其具有选择性, 在结构上与天然配体存在不同。
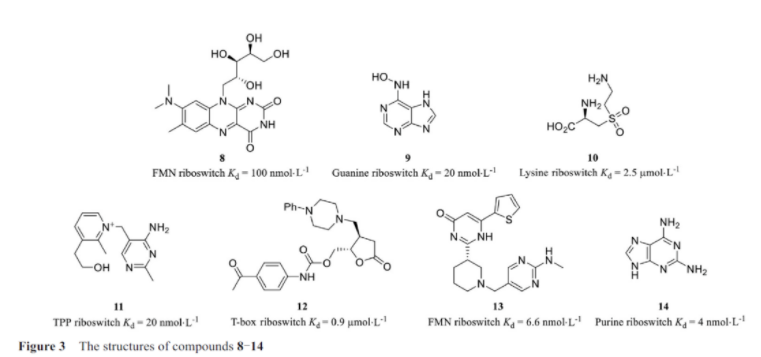
Blount等研究证明了C4位修饰的赖氨酸类似物L-氨乙基半胱氨酸和L-4-氧代赖氨酸都与枯草芽孢杆菌的赖氨酸核糖开关结合而抑制细菌生长。Kim等在实验中发现了鸟嘌呤类似物6-N-羟基氨基嘌呤可以作用于鸟嘌呤核糖开关抑制细菌的生长。Mulhbacher等发现6-羟基-2, 4, 5-三氨基嘧啶是通过在鸟嘌呤核糖开关上发挥作用而抑制金葡菌的生长。Batey小组在研究中也报道了嘌呤核糖开关类似物小分子14的合成孔径雷达(synthetic aperture radar, SAR)。
SMA是由于运动神经元存活基因1(SMN1)功能丧失和运动神经元存活基因2(SMN2)在人体内的低效剪接导致的SMN蛋白缺乏引起的。小分子化合物口服后可透过血脑屏障, 避免了反复腰椎穿刺鞘内注射的不便。目前进入早期临床试验阶段的口服小分子药物包括两种, 即branaplam(15,图4)和risdiplam(1)。Branaplam为Novartis公司研发的调节SMN2基因剪接的口服小分子药物, 在早期动物实验中证实了该化合物结合导致SMN2基因更有效的剪接, 从而提高动物体内功能性SMN蛋白的表达水平, 延长了动物存活时间。在研究中发现该小分子药物通过稳定由SMN2前体mRNA和小核糖核蛋白复合体U1 snRNP形成的瞬时双链RNA结构发挥作用。这一研究结果显示了小分子介导序列选择性剪接调节的可行性, 以及在其他剪接疾病中利用这一策略的潜力。
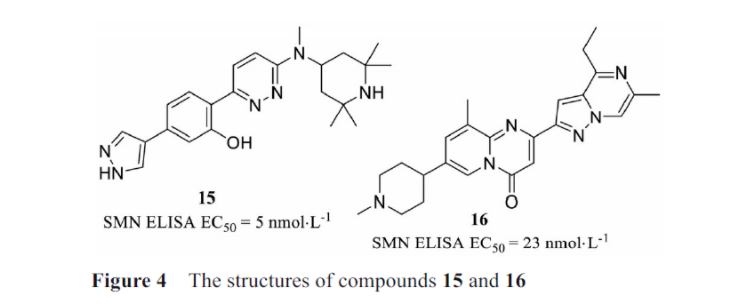
口服的小分子药物risdiplam是SMN2的剪接修饰剂,该药能促进SMN2产生全长和功能性的蛋白, 对1型、2型、3型SMA患者的运动功能均有改善效果, 已经在2020年成功上市。而在SMN2相关疾病的其他研究中, 也发现了一些小分子可以发挥一定的效果。如美国公司PTC Therapeutics发现了一种小分子16, 研究发现该类小分子增加了低效剪接的SMN2的产生, 该小分子是第一个进入临床试验的小分子剪接修饰物。该药物正在SMA患者中进行临床1b/2a期试验, 但其在长期的动物治疗研究中出现了安全性问题。
■ 作用于RNA的重复元件的小分子药物
RNA重复元件是指重复的非编码RNA序列的短链模式, 通常情况会出现数千次的重复。由于这些核糖核酸重复元件的出现, 会使得体内的蛋白质表达受到影响, 可能会导致机体发生病变。
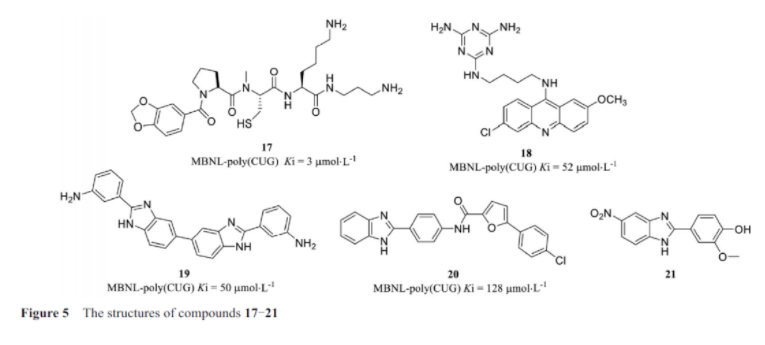
在米勒实验室的研究中, 通过动态组合选择筛选出了小分子17(图5), 并发现它可以抑制1型肌强直性营养不良症(myotonic dystrophy type 1, DM1)相关的聚(CUG)RNA重复元件与蛋白MBNL1的结合。齐默曼实验室也发现了另外一个小分子18, 可以抑制蛋白质与聚(CUG)核糖核酸重复序列的结合。Disney实验室在RNA靶向文库中发现了可以选择性抑制DM1中聚(CUG)RNA重复元件的小分子19, 并在Inforna设计平台的帮助下优化了该小分子的细胞活性, 得到了类似分子在细胞中具有功能活性的小分子20。
肌萎缩性侧索硬化症(amyotrophic lateral sclerosis, ALS)和额颞叶痴呆(frontotemporal lobe dementia, FTD)是进行性神经退行性疾病, 表现为运动障碍以及认知、行为和语言缺陷。ALS和FTD最常见的遗传原因是基因RNA的poly端中(GGGGCC)重复扩增, 非AUG(RAN)重复扩增翻译成有毒二肽重复蛋白(toxic dipeptide repeat proteins, DPRs)与核糖核酸病灶的形成以及该疾病的病症具有直接的相关性。Ursu等研究中, 在一个包含3 271种具有药物样特性的富氮杂环化合物的分子库中, 通过高通量筛选将苯并咪唑衍生物小分子21识别为特异性r(G4C2)8黏结剂, NMR结构研究表明, 该小分子可以选择性地结合到重复的GG内部环结构5′CGG G/3′GGC上。且该小分子选择性抑制C9ALS/FTD HEK293T细胞模型RAN翻译和减少聚(GP)DPRs的产生而不影响r(G4C2)66mRNA水平。
■ G-四链体结构
G-四链体(G-quadruplex)是由富含串联重复鸟嘌呤(G)的DNA或RNA折叠形成的高级结构。G-四分体(G-quartet)是四链体的结构单元, 由Hoogsteen氢键连接4个G形成环状平面, 两层或以上的四分体通过π-π堆积形成四链体。除了人体中RNA G-四链体还存在于一些细菌和病毒中, 包括HIV、单纯疱疹病毒(herpes simplex virus, HSV)、人乳头状瘤病毒(human papillomavirus, HPV)、EB病毒(Epstein-Barr virus, EBV)和HCV。一些G-四链体特异性化合物通过靶向G-quadruplex结构显示出强大的抗病毒活性, 因此, G-四链体特异性化合物可能是潜在的抗病毒药物。
由此可见, G-quadruplex具有很好的靶标开发潜力, 虽然已有数千个内源性RNA序列被证实可以在体外折叠成G-quadruplex, 但这些结构能否在细胞中折叠成为G-quadruplex, 尚需在细胞中进行表征。Schneekloth实验室使用了一个亲和选择筛选平台, 筛选了与MYC原癌基因的启动子中特征明确的DNA G4基序结合的小分子。对这些分子进行了优化, 得到了能够选择性抑制细胞中MYC表达的小分子22(图6)。虽然该分子靶向DNA G4结构, 但这些研究结果也有望应用到结构相似的RNA G-quadruplex。
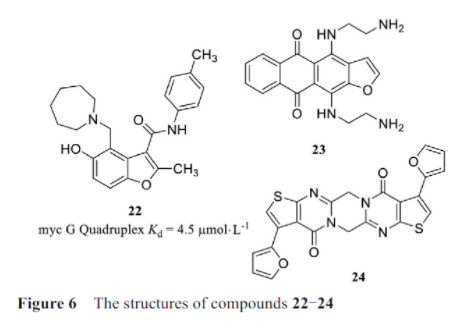
Miglietta等研究中, RAS癌基因在许多人类癌症中过度表达, 而目前还没有抗RAS药物到达临床。在报告中介绍了一种通过小分子与mRNA的5′-UTR中的RG4s结合来抑制胰腺癌细胞中kirsten大鼠肉瘤病毒癌基因同源物(kirsten rat sarcoma viral oncogene homolog, KRAS)癌基因的策略。利用G-quadruplex预测软件, 在5′-UTR区域鉴定了一个假定的G-quadruplex基序, 该基序与茎环结构平衡存在, 并且发现小分子23可以改变这种平衡, 从而抑制了KRAS翻译。当给予胰腺癌细胞时, 该分子降低KRAS蛋白水平, 并抑制细胞生长和集落形成。在Katsuda及其同事的一项研究中, 确定了一种小分子24, 其可以靶向NRAS原癌基因中的5′-UTR G-quadruplex。在乳腺癌细胞系中, 使用该小分子治疗可以使NRAS蛋白表达显著降低。
■ RNA靶向降解嵌合体(ribonuclease targeting chimeras, RIBOTAC)技术
基于泛素化-蛋白酶体系统降解途径的蛋白质靶向降解嵌合体(proteolysis targeting chimera, PROTAC)作为新颖的诱导蛋白降解方式已成为一种全新的药物发现策略。细胞内除了有能够降解蛋白质的蛋白酶体外, 也有可降解RNA的核糖核酸酶, 与PROTAC类似, RIBOTAC技术慢慢发展起来。RIBOTAC局部招募内源性核糖核酸酶(recombinant ribonuclease L, RNase L)到特定结构化的目标RNA位点上, 组装形成二聚体, 活化的RNase L选择性降解RNA靶点。这为靶向RNA的小分子药物提供了新的开发策略, 这种策略允许小分子药物不必像传统的RNA靶向药物那样必须结合到RNA的功能位点才能实现对靶标的抑制。
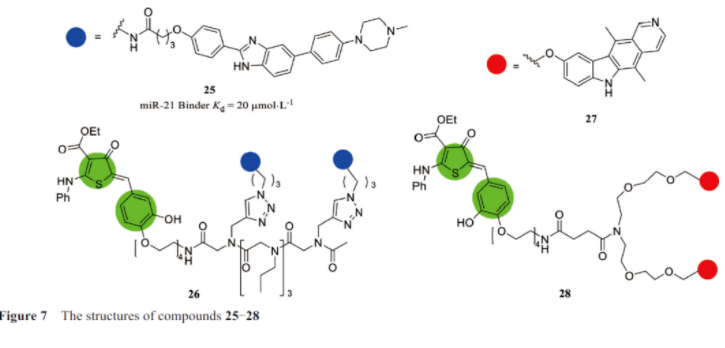
Disney课题组在研究中, 利用自己开发的基于序列的设计方法Inforna设计小分子, 以microRNA-21的3D折叠结构为靶标, 从小分子文库中进行确定了一个小分子25(图7), 它选择性地与miR-21 Disher位点结合, Kd值为20 µmol·L-1, 并抑制了体外核糖核酸内切酶Dicer酶加工。通过不断优化, 最终确定了RIBOTAC小分子26。研究中发现, 该化合物特异性靶向致癌microRNA-21(pre-miR-21)的前体, 含有的杂环招募并激活核糖核酸酶(绿色), 以诱导前microRNA-21的酶解。随后在小鼠模型中验证了该化合物可以阻碍乳腺癌向肺的转移, 转录组学和蛋白质组学分析也表明该化合物的有效性和选择性, 可以特异性调节致癌途径。实验中发现, 核酸酶招募剂的功能是局部激活RNase L, 其GC值为0.84(GC为0表示非选择性化合物, 而完全选择性的GC为1.0), 表明其具有很强的选择性。除此之外, 还通过实验验证了该化合物可以抑制miR-21所刺激的MDA-MB-231细胞侵袭现象的发生, 可以广泛降低表达miR-21的黑色素瘤和肺癌细胞系的侵袭性。在ALS和FTD等进行性神经退行性疾病研究中, 为了开发更好的治疗方法, Bush等研究发现了小分子27, 该小分子可以结合在RNA靶标上, 并在此基础上表征了一种具有双重功能的小分子28, 不但可以选择性地结合RNA的poly端中(GGGGCC)扩增片段, 还可以利用RIBOTAC技术招募RNase L(绿色部分)去除天然RNA的扩增。在患者源性脊髓神经元和ALS小鼠模型中, RIBOTAC分子成功诱导致病性mRNA降解并减少相关病理学特征。该小分子在几种患者衍生模型中治疗了体外ALS/FTD的典型细胞, 并在小鼠模型中改善了ALS/FTD病理学特征。使用该小分子去除病理性GC扩增可能是治疗ALS/FTD的有效方法。
■ 近期以RNA为靶标的抗新型冠状病毒(COVID-19)的小分子药物研究
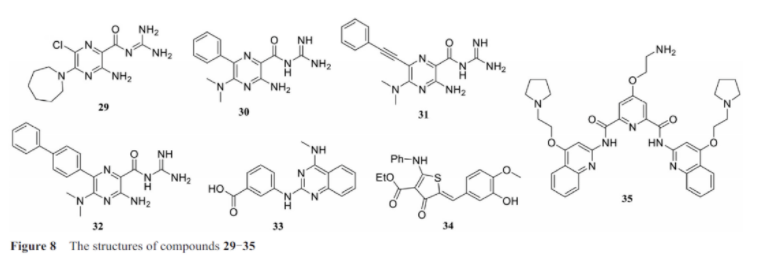
2019年末, 新冠肺炎暴发, 对国家的医疗保健系统、经济和百姓日常生活造成了严重破坏。至今为止, 仍然处于一个严峻的情况, 对于新冠肺炎的治疗刻不容缓。阿米洛利(amilorides, 29, 图8)是一种已知的RNA结合配体, 该分子已证实可以作用于一系列的RNA二级结构。最近研究发现amilorides可以作为治疗肠道病毒71型(enterovirus 71)先导化合物, 具体为: amilorides可以结合在该病毒RNA的5′-UTR区域, 干扰RNA与宿主蛋白的相互作用进而抑制病毒的复制。SARS-CoV-2同样具有一个高度保守的5′末端, 该病毒的5′末端在病毒复制中非常关键, 能够劫持宿主细胞的转录通路。新冠病毒RNA的5′-UTR及相邻的SL6区域具有多种突起(bulges)和内环(internal loops)结构, 这些结构可以作为小分子药物筛选的理想靶标, 同时也是amilorides的高效结合位点。Zafferani等以冠状病毒OC43感染的Vero E6细胞为模型,测试前期合成的55个amiloride类似物的抗病毒活性, 发现了化合物30(DMA-132)、31(DMA-135)和32(DMA-155)可以显著降低病毒滴度, 类似的测试也证实这3个化合物可以降低SARS-CoV-2的病毒滴度。荧光素酶检测实验证实病毒的5′-UTR和近端区域(proximal region)是小分子化合物发挥转录抑制作用的必需区域。DMA-155是抗新冠病毒活性最强的化合物, 作者通过NMR实验进一步证实该化合物的作用位点位于5′末端的SL6区域。这项研究为靶向新冠病毒RNA的药物开发开辟出一条新路径。
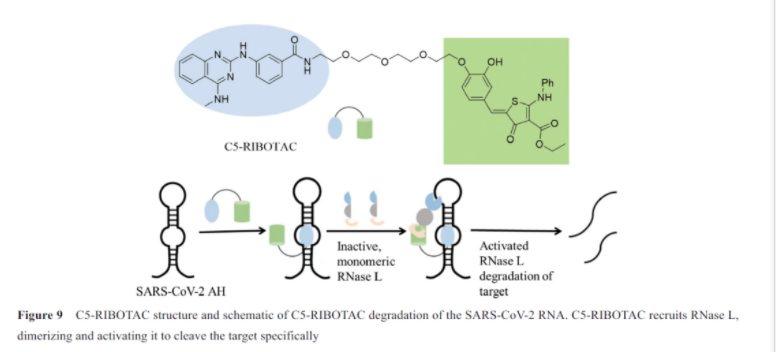
SARS-CoV-2移码RNA元件(frameshifting element, FSE)控制着pp1a和pp1ab两种聚合蛋白(pp1a and pp1ab polyproteins)的转录, 而这两种聚合蛋白是病毒复制及发病历程中的关键蛋白, 因此FSE是新冠肺炎治疗干预的良好靶点。有趣的是, 增强FSE热稳定性可以损害移码效率,寻找可结合FSE的配体是实现其稳定的可行策略。Haniff等通过两种方法抑制SARS-CoV-2移码, 一种是简单的结合, 另一种是RIBOTAC技术。为了发现可靶向该区域的小分子, 作者从一个靶向RNA的包含3 271个化合物的分子库进行筛选。经过几轮的筛选确定了小分子33(C5)作为唯一的一个先导化合物, 研究发现C5可以选择性地结合在FSE的UU内环(UU internal loop), Kd=11 nmol·L-1, 并且可以提高FSE的热稳定性。获得对SARS-CoV-2 RNA具有亲和性的C5之后, 他们通过将C5连接靶向核糖核酸酶的调控子34, 设计出了C5-RIBOTAC。核糖核酸酶调控子可以与RNase L的单体结合, 并使两个单体二聚化为活性的核酸酶。通过C5-RIBOTAC实现靶向切割和降解整个SARS-CoV-2 RNA的目的(图9)。通过生物测定, 他们发现C5-RIBOTAC可以剂量依赖地降低SARS-CoV-2 RNA的水平, 并且证明了这种效应依赖于RNase L。
Zhao等用G-quadruplex预测软件预测了SARS-CoV-2基因组中存在4个假定的G4序列(putative G4-forming sequences, PQSs)RG-1、RG-2、RG-3和RG-4(表 1), 这4个G4序列分别位于核衣壳蛋白(nucleocapsid protein)、非结构蛋白10(non-structural protein 10, Nsp10)及S蛋白(spike glycoprotein), 这几个蛋白都是SARS-CoV-2的功能蛋白。随后他们通过分别构建这4个G4序列, 经过荧光激活测定(fluorescence turn-on assay)、聚丙烯酰胺凝胶电泳(PAGE)及NMR等实验鉴定出只有RG-1可以形成稳定的G-quadruplex。并发现G-quadruplex的特异性配体PDP(35)可以增强RG-1的热稳定性, 用凝胶电泳实验证实了PDP与RG-1具有很强的亲和力。随后,他们发现RG-1 G-四链体能在细胞中形成, 也能在包含RG-1的核衣壳蛋白完整序列中形成, 在细胞中加入PDP可以剂量依赖地抑制核衣壳蛋白mRNA的转录, 并能降低核衣壳蛋白的表达量。SARS-CoV-2核衣壳蛋白通过与病毒基因组以及膜蛋白(M蛋白)的相互作用, 在病毒组装过程中扮演重要角色。此外, 核衣壳蛋白对于病毒RNA转录和病毒复制的效率至关重要。鉴于核衣壳蛋白在病毒组装及复制中的重要角色, G4s有望成为开发COVID-19治疗药物的新靶点, 为寻找有效的抗新冠病毒药物提供了新思路。

总结
与大分子药物相比, 小分子药物具有许多优势, 仍是一个具有前景的研发方向。在小分子药物开发过程中, 接近99%的药物的作用靶标是致病蛋白,但因近80%的蛋白质存在不可成药的问题。在中心法则中, RNA处于蛋白质的上游, 许多疾病的发生也都存在着RNA的参与和介导, 靶向RNA的药物开发越来越受到重视。以RNA为靶标的小分子药物的研发还存在诸多的挑战。受RNA自身结构性质的影响, 其作为靶标时往往面临成药性不好及特异性不足的问题。RNA靶标高度灵活, 存在多种构象, 现有技术对RNA结合腔的理解也远不如蛋白, 以RNA为靶标的筛选分子库如何建立仍缺乏方向。由于缺少系统性高通量的小分子筛选平台, 目前已有的可靶向RNA的药物多为寡核苷酸[反义核酸、RNA干扰、微小核糖核酸(microRNA)]。内源性小分子有调控RNA功能的也不多, 这进一步限制了先导物的来源。基于以上原因, 靶向RNA的小分子药物的研究一直停滞不前, 进展缓慢。同时, 已报道的靶向RNA的药物大多处于临床前阶段, 在人体中的药效也需在临床试验中进一步验证。
尽管如此, 随着一些靶向RNA的小分子药物批准上市, 以及一些已知药物被发现是通过与RNA结合而发挥作用, 为科学家研发以RNA为靶标的小分子药物带来了新希望。未来以RNA为靶标的小分子药物开发中, 对RNA的结构进行更加深入的研究显得尤为迫切, 建立更多的针对RNA靶标的化合物库也很有必要。同时, 通过靶向RNA-蛋白复合体或者间接靶向RNA的小分子药物, 如靶向RNA剪接体等, 也是以RNA为靶标的药物开发的新策略。相信随着越来越多的科研工作者投身于这一研究, 对小分子靶向RNA治疗人类疾病方面的认识、理解和挖掘将会更加的深入, 也会有更多的靶向RNA的小分子药物被发现。
原文:
1、杜晓利, 陈慧慧, 叶向阳, 谢恬, 何兴瑞.以RNA为靶标的小分子药物的研究进展[J].药学学报,2022, 57(10): 2902-2913.
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 南京市江宁区科学园乾德路5号