靶向蛋白质降解(TPD)主要通过泛素-蛋白酶体和溶酶体降解靶蛋白,根据具体作用原理又可细分为近10个不同技术路线,其中发展最快的是分子胶和PROTAC技术。
BMS的分子胶来那度胺年销售额已达128.91亿美元,Arvinas的PROTAC分子ARV-471已经启动III期临床,基于溶酶体的靶向降解发展时间较短,目前仍处于临床前阶段。在常规靶点开发殆尽、新靶点发现难度高的药物开发现状下,TPD技术为药物开发提供了新路径,大大拓宽了可靶向的蛋白范围,将是未来最具发展潜力的技术之一。接下来我们就来重点介绍一下 PROTAC 和 分子胶。
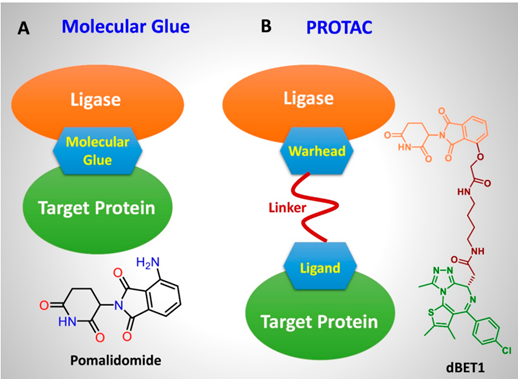
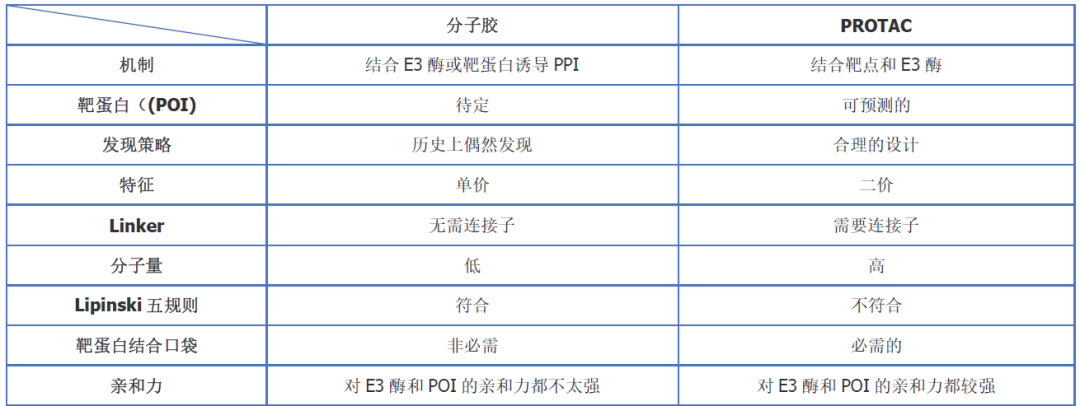
蛋白降解靶向嵌合体(Proteolysis Targeting Chimeras,PROTACs)与分子胶是近年来发展迅速的两种靶向蛋白降解技术,它们通过不同的机制实现疾病治疗中的蛋白质降解,这两种技术都有潜力改变传统的药物研发方式。①结构不同:PROTACs一般由三部分组成:靶蛋白配体、连接链(Linker)和E3泛素连接酶配体。这样的结构设计使得PROTAC分子可以同时与目标蛋白和E3连接。分子胶则通常是单一的小分子,它们通过改变靶蛋白或E3泛素连接酶的构象,促进它们之间的互动,而不需要特定的连接链或靶向蛋白的高亲和配体(图1)。②机制不同:PROTACs与分子胶主要区别在于它们的作用机制。PROTACs诱导靶蛋白降解,通过连接靶蛋白与E3连接酶配体,使靶蛋白附着的泛素进入蛋白酶体降解。这种方式可以彻底清除病理蛋白,从而抵消其疾病活性。然而,分子胶通过稳定和病理蛋白的亲和作用,形成稳定的复合物,从而抑制其活性或降解目的蛋白。③效率不同:PROTAC可以实现对靶蛋白的选择性降解,其作用效率取决于PROTAC与靶蛋白和E3 连接酶之间的亲和力。与传统的酶抑制剂或受体阻断剂不同,PROTAC不但抑制蛋白功能,还能减少蛋白的数量。分子胶同样可以促使靶蛋白的降解,由于是通过使靶蛋白与E3连接酶直接结合,故其效率取决于分子胶与靶蛋白和E3 连接酶之间的亲和力(表1)。
图1:分子胶与PROTAC的作用方式和特点
表1:分子胶和PROTAC的区别
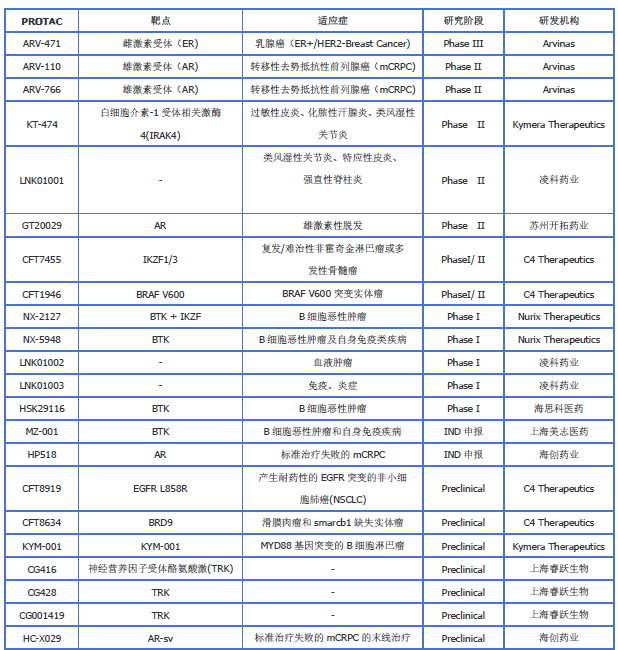
至今PROTACs已经成功地被用于多种类型的蛋白相关疾病的研究,在临床试验阶段表现出强大的治疗效果。如靶向雌激素受体的ARV-471、靶向BTK的MT-802等。然而,PROTAC 药物在全球暂无相关产品获批。国外相对进展较快的公司有Arvinas、C4 Therapeutics、Kymera Therapeutics、Nurix等。随着Arvinas的两款候选分子ARV-110和ARV-471率先斩获积极的临床数据,这一领域在近两年迎来蓬勃发展,目前,多个PROTAC药物已经进入临床阶段,靶点包括AR,ER,BCL-XL,IKZF1/3,STAT3, BTK, TRK,BRD9等。另外对于Kymera Therapeutics、C4 Therapeutics和Nurix Therapeutics,他们各有分子处于临床阶段。除此之外,一些国内的药企比如凌科药业、开拓药业、海思科、美志医药、睿跃生物、海创药业和万春医药子公司Seed Therapeutics等均已在PROTAC领域布局。其中,凌科药业、开拓药业、海思科均有PROTAC分子进入临床阶段(表2)
表2:目前处于临床阶段的PROTAC
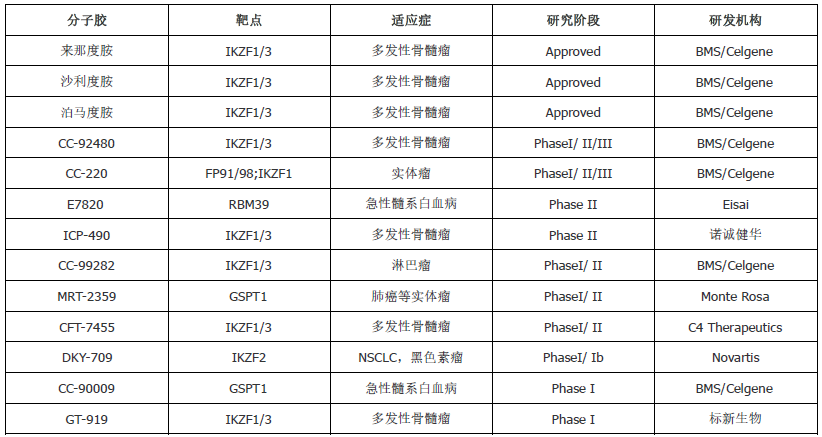
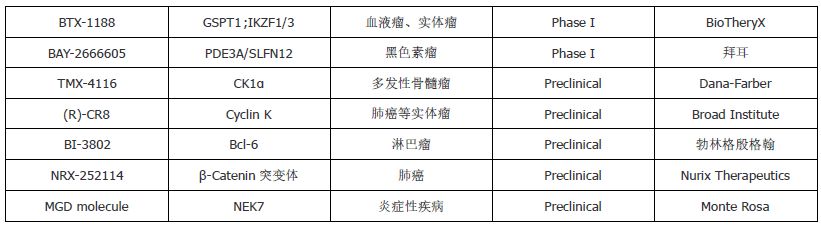
相比之下,分子胶作为一种较新的疗法,在研究和开发中还相对较少,但也已经在某些特定的案例中展现出了治疗潜力,目前已获批在临床应用的分子胶主要是免疫调节剂,即沙利度胺、来那度胺 和泊马度胺 ,用于治疗多发性骨髓瘤、骨髓增生异常综合征等。这三个分子胶降解剂的分子量均在300 Da以下,均通过募集E3泛素连接酶CRBN以降解包括转录因子IKZF1/3在内的目标蛋白。此外,沙利度胺的类似物也是许多PROTAC分子常用的E3泛素连接酶CRBN的配体,比如上述进入III期临床的ARV-471的E3连接酶配体便是采用的(R)-沙利度胺。除了已获批准的3个以外,目前还有超过二十几个分子胶降解剂药物进入了临床或者临床前阶段,国外相对进展较快的公司有BMS、C4 Therapeutics、Nurix、Monte Rosa Therapeutics等,BMS毫无疑问处于该领域的领导地位,其分子胶管线主要来自于2019年对新基产品的收购,收获了来那度胺、CC-92480、CC-99282、CC-220等在研管线。Nurix 、C4 Therapeutics也均有分子胶降解剂药物进入临床试验。临床前的分子胶开发公司包括Monte Rosa Therapeutics, 靶向降解固有无序蛋白的Ambagon Therapeutics以及第一个报道BRD4降解剂的Ranok Therapeutics。分子胶降解剂的靶点包括IKZF1/2/3、 RBM39、GSPT1、CK1ɑ、BCL6、Cyclin K、NEK7等,针对的适应症主要为血液瘤,也包括部分实体瘤。国内的诺成健华及标新生物也开展了分子胶的临床研究,诺成健华的ICP-490更是已进入多发性骨髓瘤的II期临床(表3)。
表3:目前在研的分子胶降解剂
虽然目前PROTAC并没有上市药物,但已经有多个药物有初步人体临床数据,已经验证可以大幅降解细胞内蛋白,也有不错的治疗效果,但验证效果是个缓慢的过程,还需要更大样本的数据来确证。PROTAC技术由于其独特的作用机制吸引着越来越多的生物医药创新者和创业者在这个全新的赛道上竞相角逐。在20多年的发展中,PROTAC突破了一直以来大家认可的成药规则,在不断的探索与前进中为新药开发打开了新篇章。预计PROTAC技术在未来的药物研发中将有更广泛的应用。同时,随着技术的进步,PROTAC的设计和制备过程也将更加精准和可控。目前已报道了超过600种E3连接酶,但只有5种被用于分子胶介导的降解,分别是CRBN、DDB1、β-TrCP、DCAF15和SIAH1,E3连接酶库仍然蕴藏着巨大的潜力有待开发,识别出新的E3连接酶配体有助于扩大我们可降解的目标蛋白。此外,分子胶药物分子的化学空间也值得更多的探索,目前报导的多数分子胶仍然和沙利度胺及其衍生物有较高相似度,当然,这对药物开发工作者确实是一个不小的挑战,我们需要加深对蛋白质-蛋白质相互作用界面的洞察及理解,并基于此做出更为合理的结构导向分子胶设计,以真正的将分子胶推上临床应用,帮助治疗更多的疾病。[1]Dong G, Ding Y, He S, Sheng C. Molecular Glues for Targeted Protein Degradation: From Serendipity to Rational Discovery. J Med Chem. 2021 Aug 12;64(15):10606-10620. doi: 10.1021/acs.jmedchem.1c00895
[2]Zhao L, Zhao J, Zhong K, Tong A, Jia
D. Targeted protein degradation: mechanisms, strategies and application. Signal
Transduct Target Ther. 2022 Apr 4;7(1):113. doi: 10.1038/s41392-022-00966-4
[3]Targeted Protein Degradation and
Induced Proximity: Molecular Glues Landscape in Drug Discovery
[4]药渡数据库
[5]公司官网