引言
近年来,HER2 ADC研发赛道火热,国内多家各大药企争相布局,荣昌生物的RC48一马当先,已获得NMPA的审批,十余家公司紧随其后申请新药临床试验。
HER-2 是一种跨膜生长因子受体,由人类的HER2/neu基因编码,与 HER1 (EGFR)、HER3 和 HER4 一起属于 HER 家族蛋白。EGF 相关的生长因子中的任何一个与 HER1、HER3 或 HER4 结合会诱导HER受体二聚化,随后激活酪氨酸激酶胞内结构域,从而触发许多不同的下游途径。[1]
HER2成为致癌基因主要与基因过表达有关,基因过表达会增加细胞表面HER2异源二聚体的数量。[2].HER2扩增和过表达已在许多人类肿瘤中报道,包括18-25%的人类乳腺癌,以及卵巢癌患者的亚群、胃癌、和唾液腺肿瘤。
自2013年恩美曲妥珠单抗上市以来,国内外针对HER2靶点研究 ADC药物的热情被极大点燃,国内研究并进入临床试验期的有十余种。
目前在国内已经上市的HER2 ADC药物
恩美曲妥珠单抗
DM1是第一个在实体瘤中被批准的ADC。通过高度稳定的硫醚接头(SMCC)将曲妥珠单抗(抗HER2 IgG1 mAb)与4个依坦辛(DM1)(一种微管极化的抑制剂)相连。
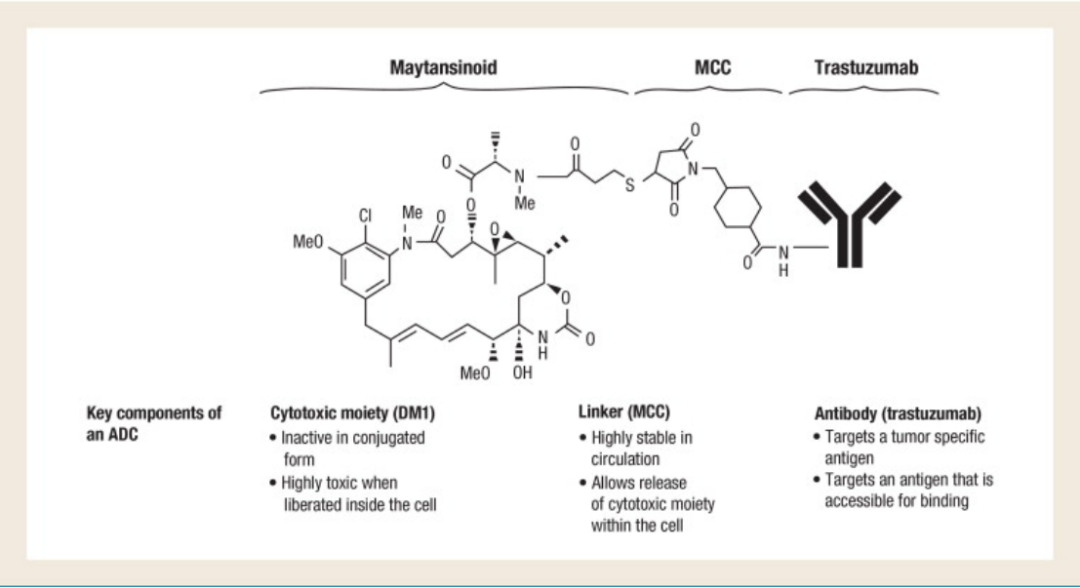
T-DM1药物结构,来源:Trastuzumab emtansine (T-DM1): a novel agent for targeting HER2+ breast cancer.
I期临床试验确定了推荐剂量为3.6mg/kg,在II期临床中入选110位受试者,ORR为34.5%。中位PFS为6.9个月,中位缓解持续时间为7.2个月。如果纳入病情稳定至少6个月的患者,总体CBR为48.2%。
T-DM1在转移性乳腺癌(mBC)中的批准依赖于3期EMILIA试验的证据,该试验在基于曲妥珠单抗的一线治疗后研究了T-DM1与拉帕替尼加卡培他滨的比较,以及TH3RESA试验,比较了T-DM1与医生选择治疗(TPC)在更多预处理人群中的比较。两项研究都显示,无进展生存期(PFS)和总生存期(OS)均有显著改善,安全性良好。根据KATHERINE试验的结果,T-DM1也被批准用于新辅助治疗后残留侵袭性BC患者的新辅助治疗。
RC48-ADC
RC48-ADC通过可切割接头Cysteine-maleimide将微管蛋白抑制剂单甲基 auristatin E (MMAE) 与赫妥珠单抗(一种新型抗 HER2 mAB)偶联。
I期临床显示,RC48的最大耐受剂量为3mg/kg,推荐使用剂量(RP2D)为2.5mg/kg,总体的ORR和DCR分别为21.0% (12/57)和49.1% (28/57)。[3]
II期临床针对43名局部晚期或转移性尿路上皮癌(mUC)her 2阳性患者,有9名患者的中值PFS为7.8个月。总体的ORR为51.2%,中位PFS和OS分别为6.9个月和13.9个月。[4]
安全性方面,3级及以上TRAE反应率为58%,最常见的治疗相关不良事件(TRAE)为感觉减退(60.5%)、脱发(55.8%)和白细胞减少症(55.8%)。25名(58%)患者经历了3级TRAEs,包括感觉减退(23.3%)和中性粒细胞减少症(14.0%)。
已经在国内申请上市的,目前正在审查期的是DX-8951f(Enhertu、T-DXd),第一三共公司
T-DXd的抗体部分是人源化IgG1单克隆抗体(mAb),参照了曲妥珠单抗相同的氨基酸序列;T-DXd的连接子是可切割的四肽接头,在血液中表现出良好的稳定性;偶联药物是第一三共创新合成的,具有专利技术的一种新型拓扑异构酶I抑制剂(DX-8951f)的衍生物(DXd)。
T-DXd每个抗体上能结合7-8个细胞毒性药物,DAR是T-DM1的2倍;其接头对肿瘤微环境中常见的组织蛋白酶(cathepsin)高度敏感;偶联药物的活性是常见化疗药物伊利替康的10倍。并且T-DXd可渗透到细胞膜中,并且可以扩散到相邻的细胞中产生“旁观者效应”,这对使其对正式的HER2阴性细胞也有效。(第一三共官网)

图源:第一三共官网
T-DXd的I期临床试验(NCT02564900)中,评估了晚期HER2表达乳腺和胃食管交界肿瘤患者T-DXd的安全性、耐受性和疗效。募集了24名受试者,每3周接受一次T-DXd,从0.8到8.0mg/kg。T-DXd显示出很好的抗肿瘤活性,疾病控制率(DCR)达91%,即使在低HER2表达的肿瘤中效果也不错,而T-DM1没有这种效果。
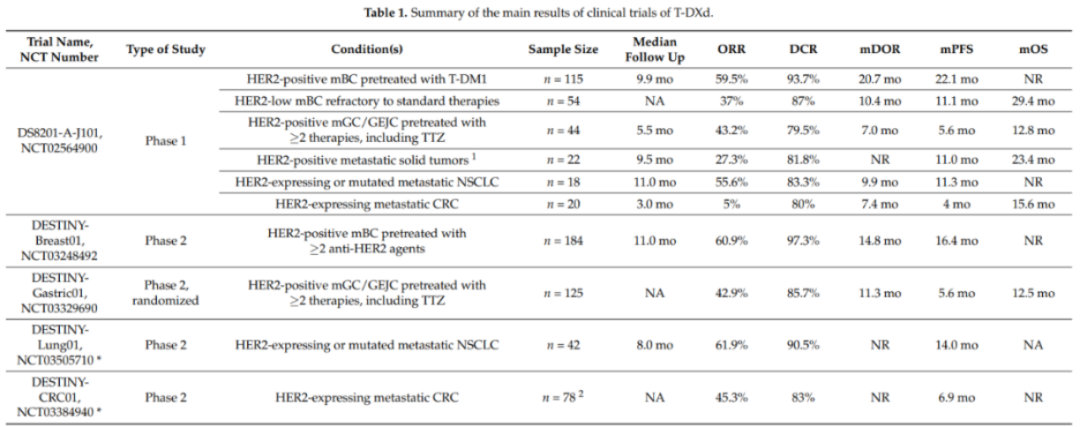
T-DXd I、II期临床试验结果
在II期DESTINY-Breast01试验中(NCT03248492),对HER2阳性转移性乳腺癌患者进行了T-DXd活性评估,这些患者曾接受过≥2种抗HER2药物治疗,包括TDM-1。试验结果显示, ORR为60.9%,DCR为97.3%。中位DOR为14.8个月,中位PFS持续时间为16.4个月。中位OS未达到,但6个月时估计OS为93.9%,12个月时为86.2%。48.4%-52.7%的患者发生了3级或更高级别的不良事件(AE)。
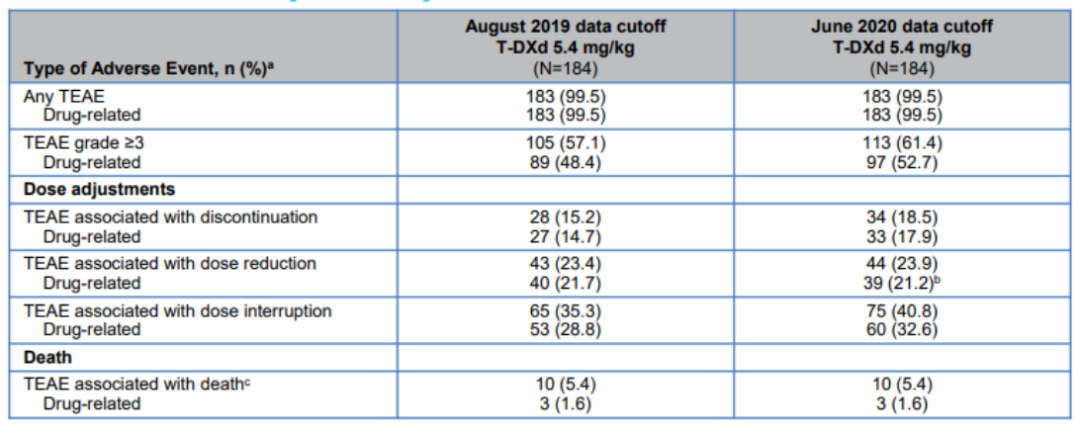
处于临床试验期的HER2 ADC药物
BAT8001 百奥泰生物制药股份有限公司
采用不可切割的硫醚键接头与毒素-连接子微管蛋白抑制剂Batansine(一种美登素衍生物)进行共价连接而成
在I期临床试验中,患者在21天的周期内静脉注射BAT8001,剂量分5组递增:1.2、2.4、3.6、4.8和6.0 mg/kg,此次试验29例HER2阳性乳腺癌患者入选,剂量限制性毒性为4级血小板减少症和3级转氨酶升高,最大耐受剂量为3.6mg/kg。48.3%的患者发生了3级或更高级别的不良事件(AE),ORR为41.4%(12/29)
BAT8001 的III 期临床终点事件数未达到方案规定可以进行统计分析的要求,主要疗效指标无进展生存期(PFS)与阳性对照组拉帕替尼联合卡培他滨比较未达到预设的优效目标,因此百奥泰决定终止该项目的临床试验。[5]
HS630 浙江海正药业股份有限公司
HS630 是由重组抗HER2人源化单克隆抗体偶联美登素衍生物DM1偶联而成。
根据《抗体 - 药物偶联药物(ADC)HS630 对大鼠中枢神经系统的安全性评价》 ,通过小鼠实验,将 40 只 SD 大鼠随机分为 4 组,分别单次尾静脉注射空白对照品,6 mg/kg、20 mg/kg及 40 mg/kg的HS630 ,注射4小时后20 mg/kg及 40 mg/kg均出现不同程度的降低动物唤醒唤起反应、手指接近反应、触摸头部反应,惊恐反应及出现震颤动物数明显多于空白对照组,随着给药时间的延长,上述症状逐渐恢复。说明HS630 一定剂量下可能会诱发神经毒性,但是可逐渐恢复。
A166 科伦药业
A166由一种微管蛋白抑制剂(单甲基auristatin F衍生物)组成,通过稳定的蛋白酶可切割缬氨酸瓜氨酸接头与曲妥珠单抗(transtuzumab)序列进行位点特异性缀合。
目前A166已完成I期临床试验,正在开展2期临床。A166在中国开展了局部晚期或转移性实体瘤患者中的单组、开放标记、剂量递增和剂量扩大I期研究(CTR20181301)。受试者接受剂量为0.1、0.3、0.6、1.2、2.4、3.6、4.8和6.0毫克/千克的A166静脉注射,每三周一次。所有剂量组均未观察到DLT。96.5% (55/57)的受试者记录了任何级别的治疗相关AE(trae),其中31.6% (18/57)为3级或更高级别。
在有效剂量下,对36名患有可测量疾病的HER2阳性乳腺癌患者进行了疗效评估,4.8和6.0 mg/kg组的最佳客观缓解率(ORR)分别为59.1% (13/22)和71.4% (10/14)。未达到中位无进展生存期(PFS )。[6]
FS-1502(复星医药)
FS-1502是重组HER2人源化单克隆抗体与微管蛋白抑制剂单甲基奥瑞他汀F(MMAF)偶联而成的药物,是 tubulin 聚合的有效抑制剂。
目前此药物正在进行I期临床试验,涉及病症包括胃癌/胃食管结合部腺癌,RAS/BRAF 野生型HER2 阳性晚期结直肠癌,HER2阳性晚期实体瘤,非小细胞肺癌,HER2 阳性的晚期乳腺癌和/或晚期恶性实体瘤。
DP303c 石药集团
DP303c重组人源化抗HER2单抗与微管蛋白抑制剂一甲基澳瑞他汀(MMAE)偶联药物。
目前此药物正在进行I期临床试验,涉及病症不可切除的局部晚期、复发或转移性胃癌,HER2表达晚期卵巢癌,HER2 阳性晚期实体瘤,已经提报二期临床但还未开始招募受试者。
B003 上海交联药物研发有限公司
B003是上海交联药物研发有限公司研发的T-DM1药物,利用MCC将抗HER2人源化单克隆抗体和微管蛋白抑制剂DM1进行偶联。
在《抗HER2单抗-MCC-DM1的质量与结构表征研究》这篇文章中发现B003 与原研药 Kadcyla®在完整分子水平分子量具有高度一致性,药物的负荷曲线也与原研药 Kadcyla®高度相似。这表明B003很有可能在药效上也和恩美曲妥珠单抗的效果接近。目前正在进行HER2阳性的乳腺癌适应症的I期临床。
ARX788 浙江新码生物医药有限公司
ARX788是由高效微管蛋白抑制剂 AS269 连接的抗 HER2 抗体组成,采用独特的非天然氨基酸结合技术和不可切割的接头。
I期试验的第一个结果显示HER2阳性BC的抗肿瘤活性,导致FDA在2021年1月批准快速通道指定。在48名可评估的患者中,ORR为56%(1.3毫克/千克),在1.5毫克/千克时进一步增加到63%。一项分为两部分的1期剂量递增试验目前正在HER2阳性实体瘤患者中进行(NCT03255070)。
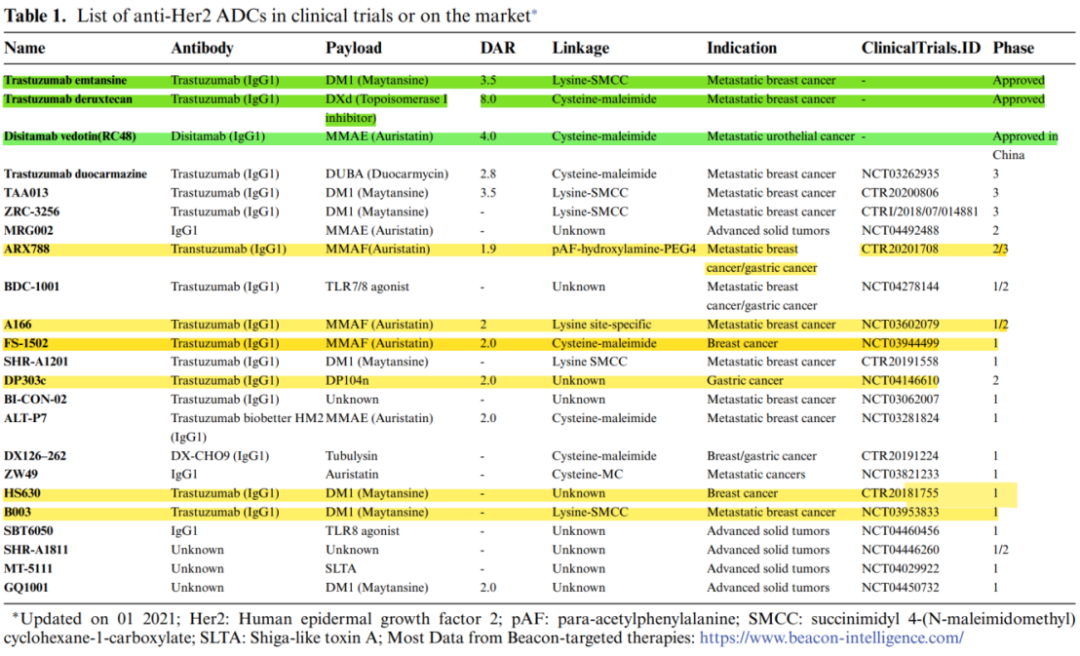
HER2 ADC类药物结构对比。绿色标识部分为已经上市的HER2 ADC药物,黄色标识部分为已经在国内申报临床的HER2 ADC药物
ADC类药物结构构成
HER2 ADC药物的研发离不开对结构以及药物与肿瘤细胞相互作用的深刻理解。
ADCs药物结构分为3个部分,特异性识别肿瘤靶点的抗体部分(Antibody),带有细胞毒性的药物(有效荷载/Cytotoxic drug)、将有效载荷与抗体连接的接头(Link)。
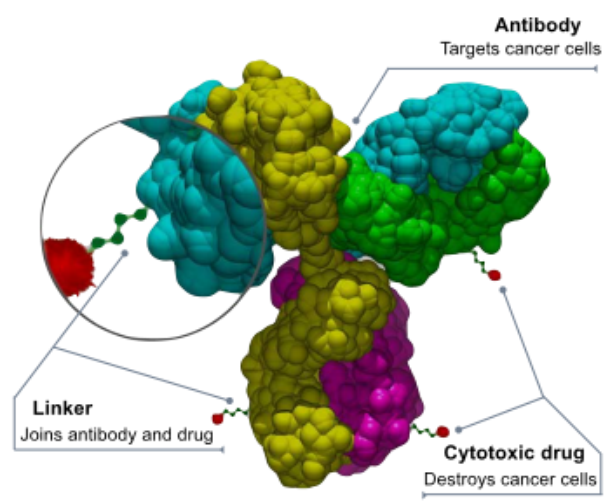
抗体
目前在用的 ADC 的抗体主要是人源化单克隆抗体,分为 IgG1,IgG2 和 IgG4。它们中的大多数基于 IgG1 同种型,比较容易制得并且还保留了更高的免疫原性功能,支持抗体依赖性细胞毒性 (ADCC) 和补体依赖性细胞毒性 (CDC) 反应。
IgG2 和 IgG4免疫原性略低,但也有一些公司更喜欢使用这两种的同型种。一些ADC 专门设计降低免疫原性特性,以减少其与有效荷载配对时的毒性。而其他公司则使用 IgG1 同种型的 Fc 突变变体 。
张新玲等提到双特异性抗体(bsAb)和纳米抗体(Nbs)也可能是之后ADC类药物抗体选择的方向。双特异性抗体(bsAb ),设计用于识别和结合两种不同的表位或抗原,并实现迄今为止传统抗体形式无法实现的治疗功能,为ADC以及抗Her2 ADCs(如ZW49和MEDI4267)的发展提供了新的有前途的策略。纳米抗体(Nbs)以其高亲和力、坚固的结构、高亲水性、低脱靶聚集和深组织穿透性的特点,在生物制药领域引起了极大的关注。
接头及接头策略
接头是将抗体连接到有效载荷的生化化合物。ADC 药理学的所有方面都可能受到接头的特定设计的影响,如药物在循环中的稳定性、肿瘤细胞的渗透性、药物与抗体的比率(DAR),即每个抗体携带的有效负载分子的数量)和作用范围、旁观者效应,因此选择一个合适的接头至关重要。
按有效载荷的释放机制接头通常分为可裂解和不可裂解两种,不可裂解接头的稳定性相对可裂解接头较好,但氨基酸附属物的渗透性差,旁观者效应有限,因此主要用于治疗具有高抗原表达的血液癌症或肿瘤的ADC中。可裂解接头的稳定性差,容易产生脱靶毒性,但是旁观者效应较好。
目前,临床试验中抗Her2 ADCs的普遍缀合策略是半胱氨酸缀合,如RC-48和SYD985,然后是赖氨酸缀合。近年来,基于工程氨基酸或天然氨基酸的位点特异性结合成为提供同质ADC的趋势,分别以ARX788和A166为例。
有效载荷
ADC药物中负责杀死癌细胞的药物叫有效荷载,成为有效荷载的药物在缀合形式中必须是无活性和无毒的,以避免全身毒性。
微管蛋白抑制剂
具有良好的生化特性,代表了迄今为止开发的绝大多数有效荷载。主要包括从天然抗有丝分裂药物 dolastatin 10 中提取的合成化合物Auristatins 家族,包括单甲基 auristatin E (MMAE) 和 F (MMAF) ,美登素合成衍生物家族包括DM1 和 DM4。DM1 是曲妥珠单抗 emtansine (T-DM1) 携带的弹头,这是第一个批准用于实体瘤的 ADC。
DNA 损伤剂
包括刺孢霉素、多卡霉素和吡咯并二氮杂卓(PBDs)等,但刺孢霉素治疗指数狭窄限制了其在ADC中的使用。
拓扑异构酶 I (TOP1) 抑制剂:
Deruxtecan (DX-d)为喜树碱类TOP1抑制剂。另外一款Sacituzumab govitecan的有效荷载SN-38(伊立替康的一种活性代谢物)也是其中一员,其活性是伊立替康的1000倍,但是由于其毒性和溶解性差,不能作为非结合药物给药。
在过去的几年中,大量的研究表明,拓扑异构酶1参与了肿瘤的关键调控途径,可能成为多种恶性肿瘤的抗癌靶点。
其他新型有效载荷
志贺毒素(一种核糖体抑制剂),是新型Her2靶向工程毒素体MT-5111的有效荷载。
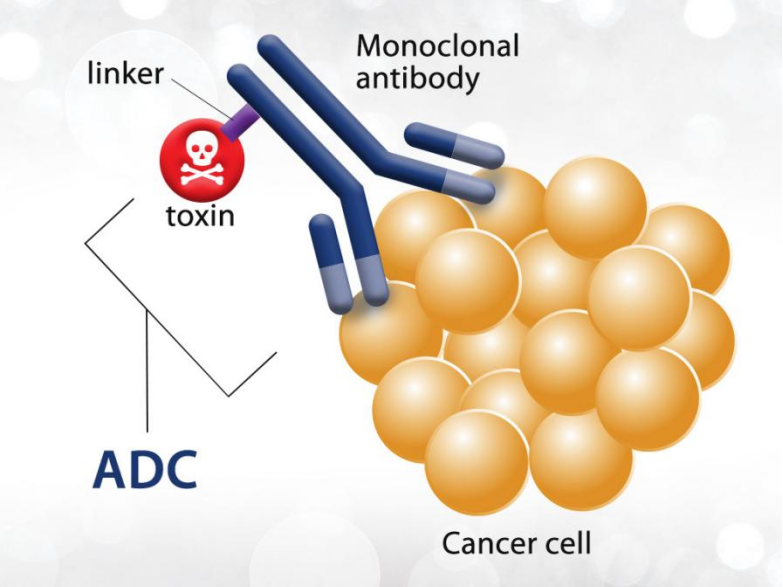
ADC 药物的作用机制
当抗体与肿瘤靶点结合后,ADCs 进入肿瘤细胞,在细胞内裂解、释放效应分子(细胞毒物)并引起细胞的凋亡。[8]
讨论
目前HER2 ADC药物研发赛道竞争激烈,同质化也比较严重,想要脱颖而出离不开强大的研发实力,平衡药物各部分结构以及性能。抗体方面,除了mAb,还可以选择双特异性抗体和Nbs。有效载荷不限于细胞毒素,还包括蛋白质毒素、蛋白质、酶、放射性核素、核糖体抑制剂、siRNA和免疫刺激剂。连接器除了最常见的随机赖氨酸或胱氨酸缀合,还有各种位点特异性缀合,包括通过工程半胱氨酸残基、非天然氨基酸、特异性赖氨酸、糖基和酶介导的缀合。DAR值可以低至2,也可以高达12。
[2]Ferraro E, Drago JZ, Modi S. Implementing antibody-drug conjugates (ADCs) in HER2-positive breast cancer: state of the art and future directions. Breast Cancer Res. 2021 Aug 11;23(1):84. doi: 10.1186/s13058-021-01459-y. PMID: 34380530; PMCID: PMC8356386
[3]Phase I study of the recombinant humanized anti-HER2 monoclonal antibody-MMAE conjugate RC48-ADC in patients with HER2-positive advanced solid tumors
[4]Open-label, Multicenter, Phase II Study of RC48-ADC, a HER2-Targeting Antibody–Drug Conjugate, in Patients with Locally Advanced or Metastatic Urothelial Carcinoma
[5]Safety, tolerability, and pharmacokinetics of BAT8001 in patients with HER2-positive breast cancer: An open-label, dose-escalation, phase I study
[6]Phase I study of A166 in patients with HER2-expressing locally advanced or metastatic solid tumors.
[7]Novel development strategies and challenges for anti-Her2 antibody-drug conjugates.
[8]基于 HER2 靶标的抗体偶联药物内吞机制研究
本文摘自---有机化学网
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 南京市江宁区科学园乾德路5号