一、市场应用

器官芯片市场包括用于毒性测试、药物研发和精准医疗(药敏试验)。2022年,全球器官芯片市场规模为4017万美元。预计到2031年将达到4.4892亿美元,在预测期间(2023-2031年)的复合年增长率为30.76%;
区域市场:2022年6月,美国国会通过FDA修订法案,北美地区去动物化趋势明确,已成为器官芯片全球最大市场;欧盟计划在2023年立法,将从2027年开始全面禁止在新药研发中使用动物试验,将成为继北美地区后最大的增量市场;
器官种类:肺芯片仿生度高,能够很好地模拟微生物病原体引起的炎症反应,以及进行其他研究,预计年增长率将达到33.63%;肝芯片发展成熟,与药物代谢高度相关,普遍用于测试肝毒性;心脏芯片也占据较高市场份额;
具体应用:药物研发占据最高的份额,器官芯片已经被证实能够有效预测药物安全性和有效性,能够导向更有效的人体试验,大幅减少临床支出。毒理研究的应用也非常广泛。
器官芯片常和类器官放在一起讨论,实际上两者并不相同,但也有交叉的部分。
类器官(Organoids)指利用成体干细胞或多能干细胞(PSC/iPSC)进行体外三维(3D)培养而形成的具有一定空间结构的组织类似物。在结构和功能上模拟真实器官,最大程度模拟体内组织结构及功能并长期稳定传代培养。
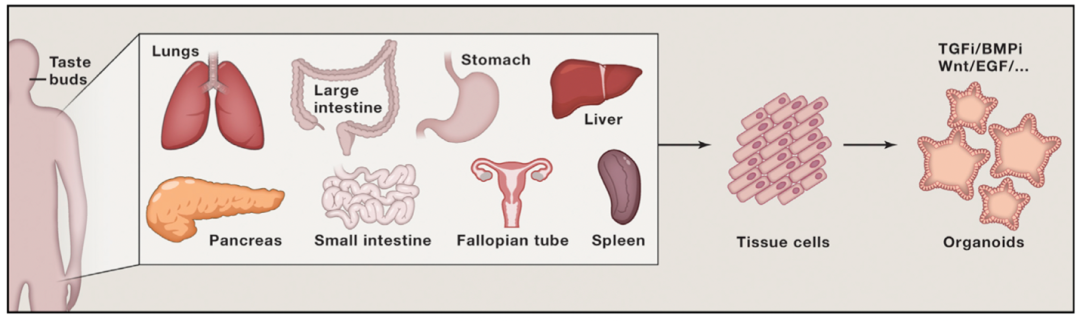
类器官,来源:2016 Modeling Development and Disease with Organoids
器官芯片(Organ-on-a-chip)指为设计用于体外模拟人体器官功能单位的微制造细胞培养设备,是基于将目标器官简化分析的设计原则构建的微系统,属于微生理系统的子集。器官芯片又可以根据细胞来源分为普通器官芯片、类器官芯片,根据器官数量分为单器官芯片、多器官芯片,根据构建用途分为生理模型芯片、病理模型芯片等。
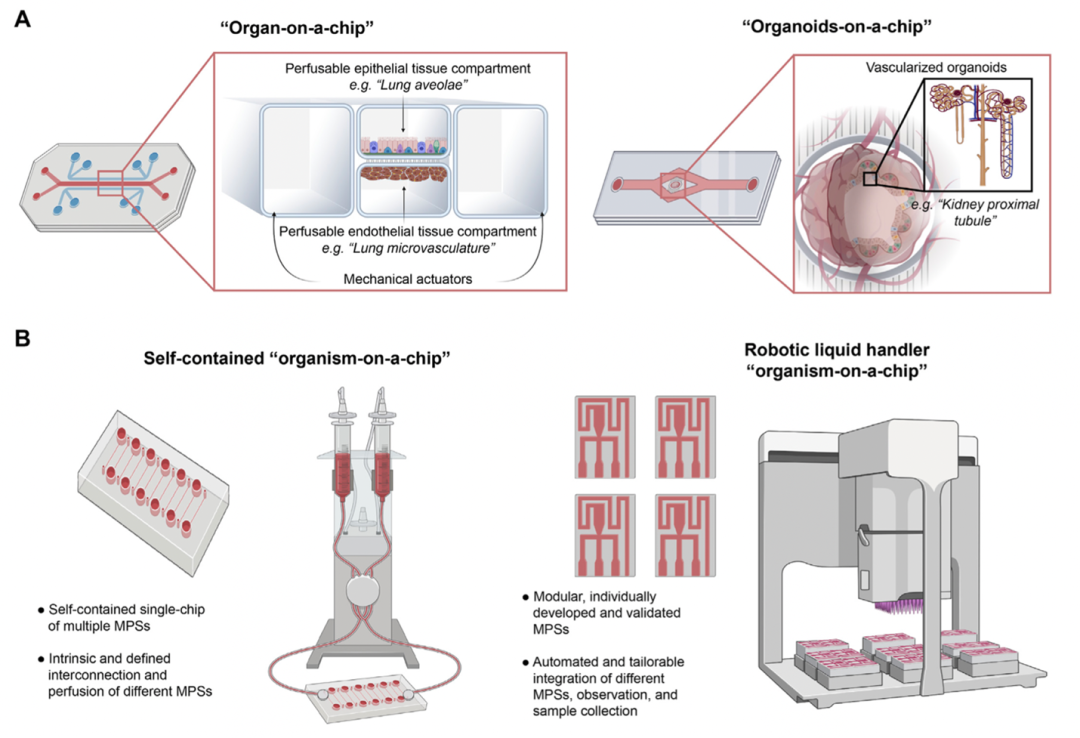
器官芯片,来源:2020 Engineered tissues and strategies to overcome challenges in drug development
目前,主要在研、投入应用的器官芯片有如下:
1)肝脏芯片
肝脏是人体重要的毒素、药物代谢器官,由具有复杂多细胞组织和管道结构的肝小叶构成。肝芯片研究主要集中于建立多种细胞组成的功能化肝组织生理学模型,如胆小管、肝小叶和肝血窦等,更好地实现肝组织功能化并集成高通量分析。白蛋白、尿素等的表达量都是测定肝功能的重要指标。
肝脏芯片是最成熟的器官芯片之一。2017年4月,美国食品药品监督管理局(FDA)已开展了与Emulate公司的合作,通过Emulate的肝器官芯片,着手在食品安全和应用营养领域的测试。目前,FDA已开始对肝脏芯片进行测试评估,期望未来审批某些被证明有毒的化合物时(如食品添加剂、药品)可以利用芯片来代替动物毒理学实验。
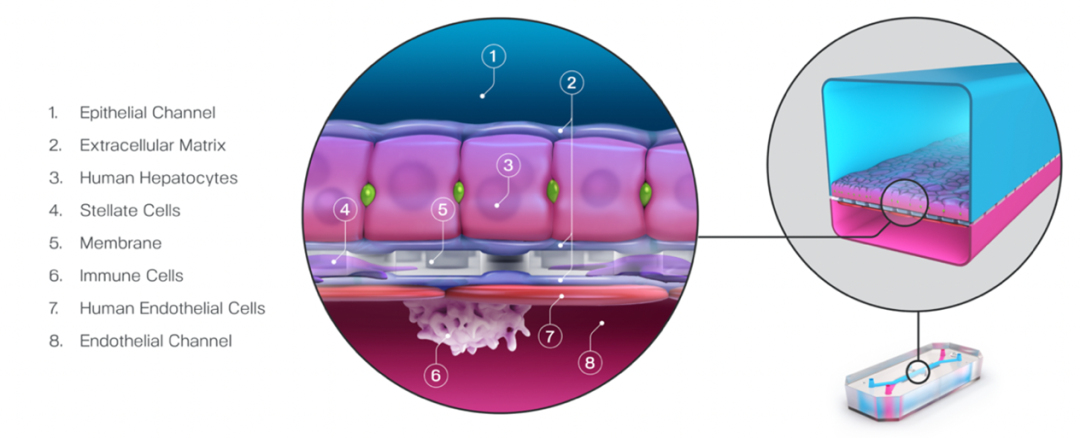
来源:Emulate官网
2)肺芯片
肺是很多进行空气呼吸的动物的呼吸系统中的重要器官,将氧气从空气运输到血液中,并将二氧化碳从血液中排出至大气中。肺芯片需要模拟气体交换的过程,通过肺泡屏障和模拟呼吸的循环拉伸结构模拟呼吸过程和肺泡运动,以实现传统培养皿不可能实现的呼吸功能。肺芯片模型通常分为上下两层,中间被生物膜所分开,上层铺设肺细胞、流通空气,下层铺设肺毛细血管细胞、流通培养液。两边为真空侧室,抽真空时侧室收缩,拉伸中央薄膜及其上组织,模仿肺细胞呼吸时的状态。
肺芯片模型研究了周期性应力对气血屏障渗透性的影像。进一步引入IL-2,成功建立了肺水肿病理学模型。2020年,FDA与Emulate尝试合作将肺芯片用于评估COVID-19疫苗和疗法的安全性。
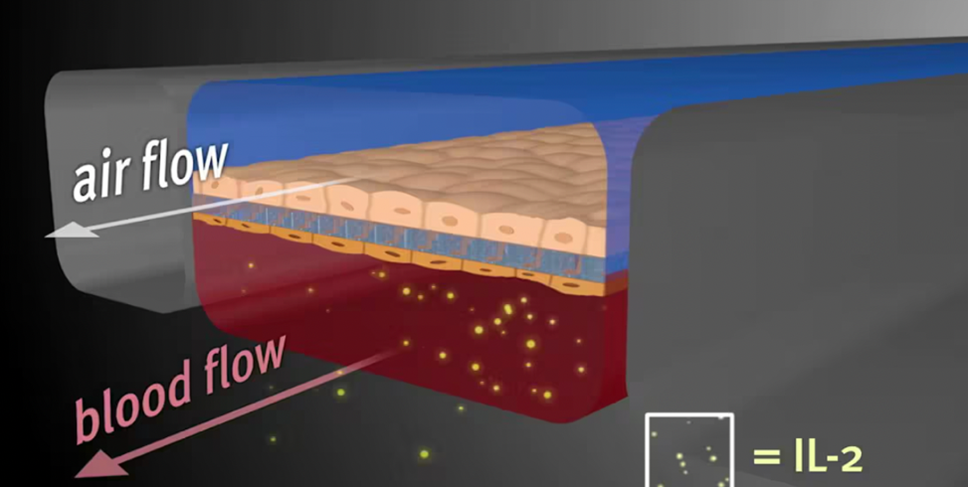 来源:Harvard Wyss Institute官网
来源:Harvard Wyss Institute官网
3)心脏芯片
心脏是人体循环系统中的重要器官,为血液流动提供压力将血液运行至身体各个部分。心脏芯片研究主要集中在建立可收缩的心脏组织结构,如心肌球、心肌束、心肌片层,模拟体外心脏组织的收缩性和电生理反应,以用于心衰模型、心律失常模型、心肌缺氧模型的研究。收缩、钙信号、电生理等指标都是测定心脏功能的重要指标。
心脏芯片也是较成熟的器官芯片之一,目前大多数疾病模型都是由患者来源的心室心肌细胞生成的,药物发现领域主要用于检测心脏毒性。2022年,美国研究团队在芯片上模拟出了心肌梗塞的一些关键特征,可能为新疗法的开发提供疾病模型。
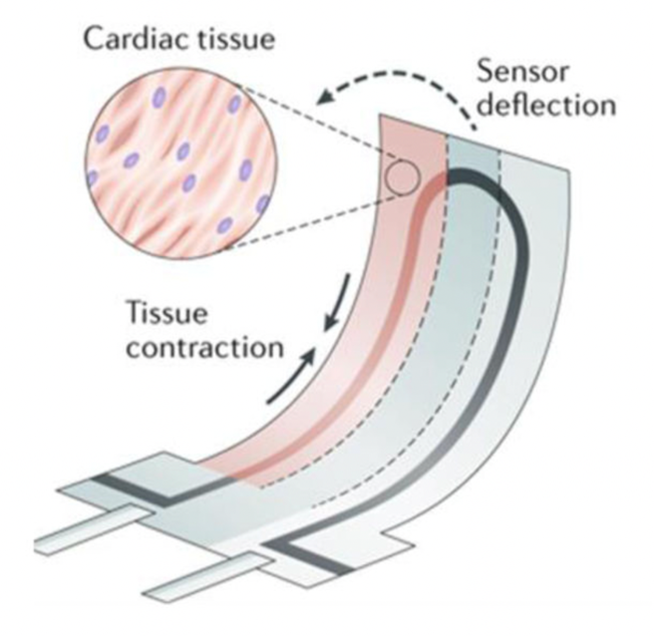
来源:2020 Towards chamber specific heart-on-a-chip for drug testing applications
4)肾脏芯片
肾脏属于泌尿系统,负责过滤血液中的杂质、维持体液和电解质的平衡,对维持体内渗透压与自稳态有重要的作用,也是药物代谢的主要器官。肾脏的结构单位由肾小球、肾小囊和肾小管共同构成,是肾脏发挥滤过与重吸收功能的基础。肾脏芯片主要模拟肾脏结构单位的过滤与重吸收功能,在此基础上进行肾病病理微环境模拟、疾病机制研究、药物作用及代谢研究。
FDA自2013年以来一直在与美国国家卫生研究院(NIH)合作推动肾脏芯片技术的发展。FDA还发布了一系列关于肾脏芯片应用的指南和政策文件,鼓励医药企业使用肾脏芯片开展新药评价。
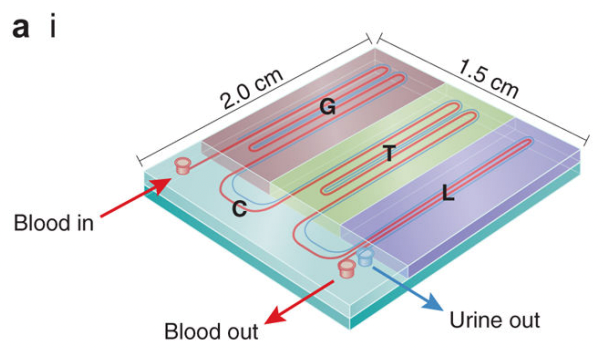
来源:2018 Kidney-on-a-chip: untapped opportunities
5)肠道芯片
肠道是人体重要的消化器官,包括小肠、大肠、直肠。小肠主要承担消化和吸收的作用,大肠形成粪便,通过蠕动经直肠和肛门排出体外。同时,肠道也是人体最复杂的器官之一,内部充满了各类微生物种群。肠道芯片模型主要由肠上皮细胞、微血管内皮细胞、共生微生物、免疫细胞等组成,并施加机械力模拟肠道蠕动,以此构建肠道环境并模拟氧气水平、pH值、营养水平等特征。
肠道是最早被构建成类器官的人体器官,目前领域内不少公司都已经构建起肠道芯片。但是,在肠道芯片的构建中,对微生物组进行建模尤其困难。相较于类器官,器官芯片的动态3D模型能够培养出更接近真实情况的菌群。
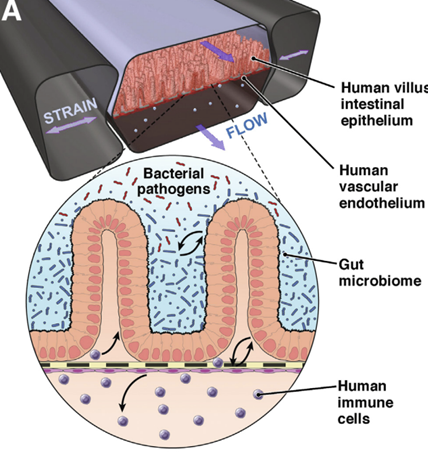
来源:2018 Microfluidic Organ-on-a-Chip Models of Human Intestine
6) 血脑屏障芯片(BBB)
血脑屏障是大脑毛细血管壁与神经胶质细胞形成的血浆与脑细胞之间的屏障,以及由脉络丛形成的血浆和脑脊液之间的屏障。血脑屏障具有高度选择透过性,从而保护大脑免受毒素和病原体的侵害,但也阻碍了诸多药物分子进入脑组织,一定程度上限制了针对中枢神经系统疾病(帕金森、阿尔兹海默证)药物的研究与开发。血脑屏障芯片主要模拟神经血管单位和脑组织细胞,同时仿真控制血液流体等要素来模拟BBB。通过在血管通道中加入待测物质,检测另一侧浓度或其他变化,开展细胞与细胞之间的物质交换和信号传递、药物传递、药物对细胞的影响等研究。
血脑屏障芯片近年来发展快速,为神经疾病机制研究提供了有效的临床前模型,目前主要应用于研究领域。
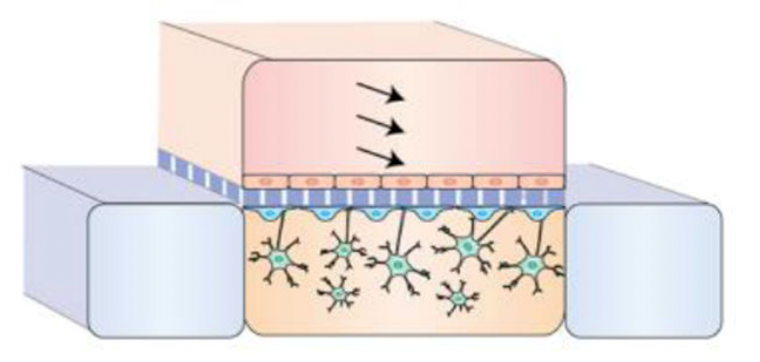
来源:2021 Advanced Human BBB-on-a-chip: a New Platform for Alzheimer’s Disease Study
7)肿瘤芯片
传统的肿瘤模型多为单一肿瘤2D细胞系, 不足以模拟体内肿瘤的真实情况。3D培养的细胞组织相较于传统2D细胞系更优,但仍然缺乏组织-组织界面、器官水平结构、流体流动和机械信号。器官芯片可重建肿瘤微环境,观察肿瘤细胞的增殖和迁移行为,以及与周围组织的相互作用,理论上可显著提高对肿瘤患者抗癌药物临床疗效预测的准确性和效率。
目前,已经有一些公司尝试构建肿瘤类器官、器官芯片用于药物筛选和药物研发。如果只是用患者肿瘤样本做药物筛选测试,类器官基本已经可以满足需求;而如果要做新药研发,器官芯片和基因编辑的肿瘤类器官优势可能更明显。但是,由于肿瘤的结构高度复杂、肿瘤微环境具有高度异质性等因素,构建肿瘤芯片需要高度稳定、标准化的人类肿瘤样本库作为基础。除此之外,构建用于药物研发的肿瘤疾病模型也需要对底层的肿瘤发生机制和生物学通路有深入的理解和认识。

来源:2023 Cancer models on chip: paving the way to large scale trial applications
8)多器官芯片
人体内的生理功能是多个器官的相互作用的结果, 器官芯片的另一发展方向是在同一张芯片上集成多个器官模型,并彼此沟通, 即多器官芯片或称人体集成芯片(human-on-a-chip)。多器官芯片在芯片上不同区域构建不同组织器官,并通过芯片管道(模拟人体血管)相连接,模拟人体对特定物质的吸收、代谢、转化和排泄过程,以构建 ADME 模型和其它疾病模型,更真实反映人体药物反应,并最终勘察出药物对不同器官或整个系统的药理和毒性作用。
多器官芯片模型近几年来受到科研人员的重点关注,目前已经实现了肠-肾芯片、肝-肠芯片、心-肝芯片、神经-肌肉芯片、肠-肝-肿瘤芯片等多器官芯片的构建。

来源:Hesperosinc官网
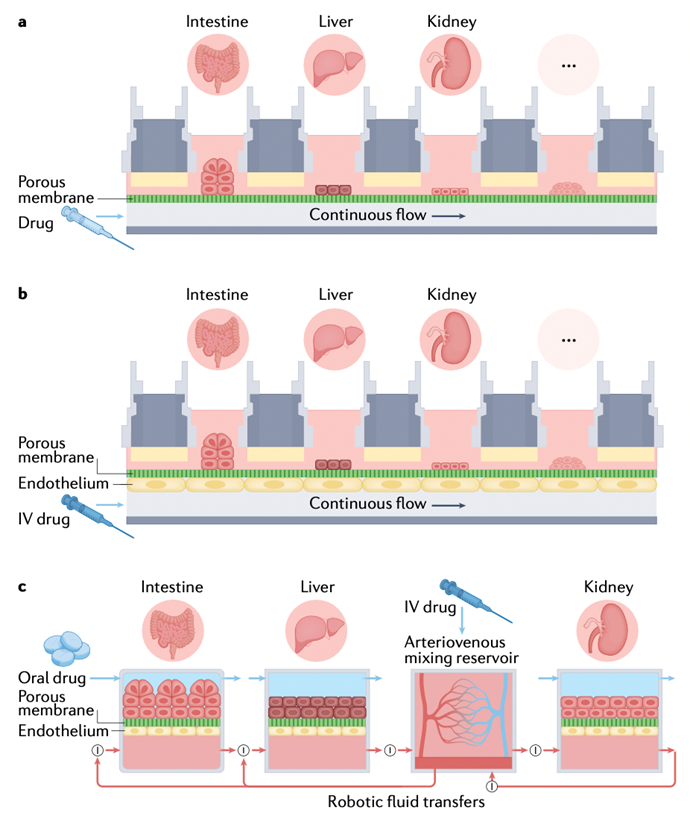
来源:2022 Human organs-on-chips for disease modelling, drug development and personalized medicine
目前,动物试验,尤其是非人灵长类动物模型(例如实验猴)以及异种异植到免疫缺陷的动物模型(PDX),仍是很多药物进行临床前体外试验的金标准。但是,这些模型有诸多不足:
1)很多病理模型难以构建(肿瘤扩散、肠道菌群等);
2)越来越多免疫细胞成为新靶点,动物模型存在种间差异;
3)全球临床前研究去动物化趋势明确;
……
器官芯片是一个新兴领域,目前,业内有通用的指标,但总体缺乏成熟的行业标准。行业标准尚未完全建立,是阻碍行业发展的因素之一。随着2022年相关行业标准的出台和建设推进,器官芯片行业预计将在未来几年逐步走向规范。
2022年,总部位于美国的国际微生理系统学会(iMPSS)成立,制定器官芯片相关的行业规范和标准。同年,中国首个类器官和器官芯片学会和联盟成立,国内陆续发布团体标准《人肠癌类器官》、国家推荐性标准《皮肤芯片通用技术要求》、《类器官药物敏感性检测指导肿瘤精准治疗临床应用专家共识(2022年版)》等行业标准和共识。
行业共识认为,器官芯片可能会在短期内辅助、长期替代临床前动物试验,但对于行业拐点何时到来业内人士持有不同观点。需要关注FDA对于行业的态度、大规模商业化时机等影响行业的因素。
二、技术平台

1.作用原理
器官芯片是多学科高度交叉的前沿技术,最初采用的微系统制造方法是由计算机微芯片制造方法改进而成,涵盖了物理、化学、生物学、材料学、工程学和微机电等多个学科。器官芯片本身是精密仪器,能够为两种或两种以上的细胞培养提供环境,且通过灌流方案实现细胞在动态受力状态下的长期培养,为实现器官功能提供必要的支持。
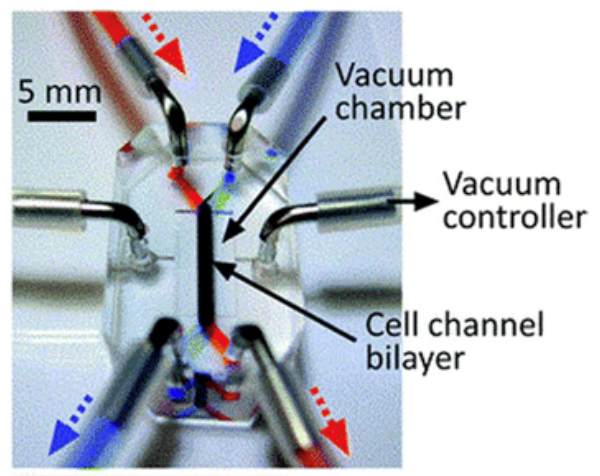
来源:网络图片
器官芯片根据系统结构可以分为:通道系统、培养腔室系统、多孔膜系统等;根据驱动方式可以分为:重力驱动、蠕动泵驱动、注射泵驱动、气泵驱动、微泵驱动等。有些器官芯片由于实验设计的需要,会在芯片内同时集成两种及两种以上的结构,模拟不同的器官,构建生理模型、代谢模型或疾病模型等。器官芯片的细胞来源可以有原代细胞(Primary cells)、细胞系(Cell lines)、多能干细胞(iPSCs)、类器官(Organoids)等。
2.技术发展历程
1990年,最初由瑞士Ciba-Geigy公司的Manz和Widmer等人,首次提出微型全分析系统概念。
1907年,Ross Harrison教授发明了2D细胞培养。
2009年,Hans Clever实验室首次培育肠类器官,他成立的Hubrecht Organoid Technology(HUB)是类器官最早的研发中心。
2010年,哈佛大学Wyss Institute的Donald E Ingber教授在Science上发文称开发出了一片能够自由呼吸的人工肺,首次在芯片中模拟了器官表皮细胞的微环境。该器官芯片技术旨在大幅度降低药物的开发成本。
2012年,美国国家层面对器官芯片技术加大支持,美国国家卫生研究院(NIH)、美国国家药监局(FDA)和美国国家促进转化科学中心(NCATS)共同资助了数十个相关项目,并与美国国防高级研究计划局(DARPA)合作支持两个大型项目,联合发起“organs-on-chips”挑战项目,致力于开发一套模拟人体器官的芯片用于食物、药品安全检测,投入资金为7500万美元。美国十余所顶级高校参与到该项目中,最终哈佛大学Wyss Institute获得投资,对这一项目进行研究。接下来的两年里,研究人员开发出基于芯片器官技术的人体仿鉴系统(Human Emulation System)。
2013年,类器官被Science杂志评为年度十大技术。
2014年,Human Emulation System研究队伍从Wyss Institution独立出来,成立器官芯片行业标杆Emulation公司。
2015年,类器官被MIT科技评论评为十大科技突破。同年,Emulate研究人员将器官芯片与细胞结合在一起,并与40多家MNC发起药物测试合作。
2017年,类器官被Nature Method评为年度技术,行业加速发展,但尚未有公司占据市场主导地位。研究人员成功构建多种疾病模型,用于药物筛选。
2018年,FDA发布毒理评价指导材料《FDA's Predictive Toxicology Roadmap》,积极鼓励发展包括器官芯片在内的新型方法用于预测药品毒性。
2019年,类器官被NEJM评为优良的临床前疾病模型。同年,类器官行业泰斗Hans Clevers作为联合创始人成立Xilis,专注开发精准的肿瘤类器官平台以指导癌症患者的精准治疗。
2020年10月,FDA与Emulate签订了技术合作协议。与此同时,FDA公布了使用肺器官芯片的三大技术目标:
1. 评价新冠感染过程中的自体免疫相应;
2. 评估中和抗体的产生、效用及免疫微环境;
3. 研究抗体依赖增强,并借此评价新冠疫苗的安全性。
2021年,器官芯片行业标杆Emulate公司任命行业泰斗Donald E Ingber为董事会成员。
2022年,由艾伯维、默克、诺华等20余家MNC药企共同成立的非营利组织IQ联盟(InnovationandQualityConsortium)着力推动器官芯片的标准化应用,以加速药物研发进程。以肝、肺、肾等器官为首的生理模型,以及以肿瘤为代表的病理模型发展较为成熟。
2022年2月,Cantex Pharmaceuticals Inc.基于哈佛大学Wyss Institute/Emulate研发的人类肺泡芯片发现一款处于临床阶段的小分子药物Azeliragon(TTP488,用于治疗阿尔兹海默症,并且已经在超过2000名患者身上验证了安全性)可以显著阻断引起炎症的细胞因子的产生,可能对严重的COVID-19、COPD以及类固醇难治性哮喘等适应症有效。FDA认可了Azeliragon基于器官芯片的临床前数据,批准其开展用于治疗COVID-19级其他肺部炎症相关疾病的临床II期研究,成为首个基于器官芯片数据获得FDA批准进入临床的案例。2023年1月,Azeliragon获得FDA授予孤儿药资格用于治疗胶质母细胞瘤。
2022年7月, Sanofi和Hesperos合作,利用iPSC分化形成的神经元和Schwann cell生成了模拟两种罕见自身免疫脱髓鞘疾病的器官芯片模型(缺乏有效的动物疾病模型),并基于该器官芯片发现一款已获批的人源化单克隆抗体药物Enjaymo(Sutimlimab,用于治疗罕见的自身免疫性溶血性贫血,已经有充分的安全性数据)可以恢复神经功能,可能对慢性炎症性脱髓鞘性多发性神经病(CIDP)和多灶性运动神经病(MMN)有效。FDA认可了Enjaymo拓展新适应症的临床前数据,并许可开展相关临床实验。目前,该研究已启动患者招募。Enjaymo于2022年2月获得FDA批准,作为首个也是唯一一个用于治疗罕见病冷凝集素病成年患者的溶血性贫血。
以上两个事件预示着器官芯片应用的里程碑,体现出FDA对基于器官芯片产生的临床前数据展现出谨慎拥抱的态度——对于已拥有临床安全性数据的“老药”,支持仅依靠器官芯片模型提供临床前数据拓展新适应症。
2022年6月,美国众议员通过《2022年食品和药品修正案(H.R.7667-Food and Drug Amendments of2022)》,首次将器官芯片和微生理系统作为独立的药物非临床试验评估体系纳入法案。当年12月,拜登总统签署立法,预示着未来新药可能无需在动物身上测试即可获得FDA的批准。
2022年9月,美国参议院无异地一致通过了FDA现代化法案(FDA Modernization Act 2021),该法案的目标是取消联邦对新药进行动物实验的强制要求,可能在未来几年大幅减少对实验动物的使用。
2022年,总部位于美国的国际微生理系统学会(iMPSS)成立,制定器官芯片相关的行业规范和标准。中国首个类器官和器官芯片学会和联盟成立,国内陆续发布团体标准《人肠癌类器官》、国家推荐性标准《皮肤芯片通用技术要求》、《类器官药物敏感性检测指导肿瘤精准治疗临床应用专家共识(2022年版)》等行业标准和共识。
2023年5月,Roche宣布建立人类生物学研究所(IHB),专注于推进类器官等人类模型系统领域的研究,以加速药物研发。早在2022年2月,Roche就聘请了类器官行业泰斗Hans Clevers,这是他首次全职来到工业界。
3.开发流程
1)了解目标器官的解剖结构,将其简化为生理或病理功能所必需的基本要素;
2)对这些功能单元进行检查,确定关键特征,如不同的细胞类型、结构组织以及器官特定的生化和物理微环境;
3)设计一个3D细胞培养装置来复制已识别的特征(通常包含多个流通微腔用以生长多种不同细胞),并以不同细胞依赖的方式控制培养环境(可加入通过机械、化学、电磁或光学方式驱动的附加组件);
4)对细胞培养装置进行工程化迭代和验证,将优化后的系统集成到芯片大小的微系统上;
5)使用软光刻、注塑成型、3D打印等微加工技术生产所设计的芯片。
微流控( microfluidics) 指的是使用数十至数百微米的微管道来处理或操纵体积为纳升到微升的流体。
聚二甲基硅氧烷(PDMS)是一种高分子材料,具有可塑性强、疏水透气、透光率高、生物相容性好、成本低、柔性等优点。
微流控系统结合PDMS材料是较为普遍的制作器官芯片的方式。不仅能够在细胞培养的特定时空中加入不同的生长因子来模拟体内动态生长环境,达到培养过程可视化的目的,还能够实现体外管腔系统对流体参数的控制,包括浓度梯度变化、生物流体剪切力、功能组织界面等。
虽然PDMS会非特异性地吸收某些小分子药物,但并不是一个严重的问题。首先,只有在高疏水性的小分子药物中会出现比较严重的吸收问题,而现在在研的新药有40%以上都是生物制剂。其次,现有一些校正策略能够解决这类问题,仅有很小一部分高疏水性的化合物真的会被这类问题限制。最后,即使真的仍遇到瓶颈,也可以通过给PDMS包上非吸收材料制成的外膜来解决问题。
长期以来,半导体行业的软光刻技术一直被用来开发含有PDMS的芯片原型。
4.核心评价指标
对于已有行业标准的器官芯片模型,主要关注其是否符合规定标准;对于尚无行业标准的器官芯片模型,主要关注其是否符合行业通用指标;对于其他新兴模型,需要提供更充分的验证性数据。
1)器官芯片种类
关注器官芯片能够覆盖的适应症和市场规模,模型是否有差异化、是否具有持续开发模型的能力。
2)高质量的细胞来源
目前,器官芯片广泛使用的细胞是通过商业途径购买的人类捐献者原代细胞、永久细胞株,也有一些采用患者来源的类器官、iPSC(可能无法表现出完全的分化表型)。细胞样本的采集和运输非常重要,直接决定细胞培养成功与否。
在美国,购买人类原代细胞和永久细胞株的商业渠道较为成熟,细胞获取相对方便。在中国,获取上述细胞的来源主要有以下几个途径:
医院内部生物样本库(医院积极搭建,但由于经费有限、储存成本高,可能存在样本质量差的问题)
科研院所与医院共建样本库(由政府主导,以科研为目的建立的技术联盟,但可能组织样本数量和种类有限)
第三方样本库(通常具有国家背景,能够获得人遗办审批的第三方样本库只有少数几家,且监管还在不断加强)
3)安全性
通过检查植入细胞的存活率、健康状态和增殖能力,评估器官芯片中的细胞能否在芯片环境下保持存活和维持功能。
4)功能性
关注细胞的生长、分化、代谢和信号传递等,评估器官芯片是否能够模拟目标器官的结构和功能,包括生理生化、细胞组成、功能指标、组织学特征、代谢组、转录组、影像等。
5)稳定性
评估器官芯片是否能够保持稳定的生理状态,避免出现变异、失活等问题,保证实验数据的准确性和可靠性。
6)重复性
评估器官芯片是否能够重复制备,能否在多次实验中保持一致的实验结果。
7)可操作性
评估器官芯片的使用难度、实验操作流程等方面,以及是否符合实验室标准操作规程等要求。
8)高通量的系统
精细化、自动化、高通量、体外实时检测、系统化是器官芯片行业发展的趋势,提高通量对于器官芯片降低成本、由科研应用推向产业化应用非常关键。
5.器官芯片优势
o 高仿生的微环境——器官芯片的3D动态培养方式能够控制细胞和特定组织结构,动态模拟化学梯度和生物力学,从而能够精确控制生化微环境和养分供给,模拟在体内的环境和反应。
o 标准化的培养体系——相较于类器官,器官芯片更容易实现标准化培养,能够支持大规模和自动化的应用,从而实现高通量。便于控制实验条件,探究不同的药物浓度、作用时间、药物组合对疾病的治疗效果。
o 模拟多器官相互作用——通过串联不同的器官芯片模型,能够探究药物在不同器官之间的循环过程和器官之间的相互作用。
o 有效的临床前研究——动物实验和人类研究之间频繁出现不一致性,由于种间差异推上临床的候选药物可能在后期失败,使得临床研究成本高昂。相比动物试验,目前已经验证了一些器官芯片模型与人类的临床研究结构一致性更高。
6.器官芯片挑战
o 细胞来源——尽管与动物试验相比采用人类原代细胞构建的器官芯片能够避免种间差异,但也面临着细胞来源稀缺、不统一等问题。长期保持标准化细胞来源的稳定性是一大挑战。
o 细胞培养——构建器官芯片需要培养大量细胞,保持细胞培养的稳定性和重复性,对不同批次间的细胞培养材料的一致性,以及复苏、扩增、分化技术的稳定性提出了很高的要求。
o 芯片性能评估——要对器官芯片的功能进行有效评估,首先需要对其开展大量对照试验以确定模型结果和早期临床试验结果之间的相关性,并确立统一的标准。此外,还要开发和统一相应的评估技术和方法。
o 芯片设计——器官芯片涉及多学科交叉领域,结构复杂、设计和集成难度高,可能会给细胞成像和分析带来挑战。
o 芯片制造——器官芯片需要在微米级别上精确制造,需要掌握精密的微纳加工技术,对生产的精度提出很高的要求。
器官芯片常见的应用领域包括毒性评估、新药研究、药物筛选等。
o 毒性评估:器官芯片可以模拟真实人体生理反应,对化学药品、毒素、营养物质等进行毒性评价,减少动物实验的使用,降低研究成本和伦理风险。常用的模型包括肝脏芯片、心脏芯片、肾脏芯片等。
o 新药研究:器官芯片可以模拟生理机制和疾病特征,构建以往难以建立的生理和疾病模型,例如慢性肺阻塞、心肌梗死、肿瘤扩散、肠道菌群、NASH等,从而辅助新药的临床前研发,降低药物开发的时间和成本。
o 药物筛选:采用患者自身细胞构建的疾病模型,尤其是肿瘤模型,与患者一致性较高,能够为个性化精准用药提供技术支持。此外,器官芯片还能够在某些情况下作为0期临床对药效评估进行补充,例如可能导致人类患者死亡的临床研究(COVID-19、致命的辐射暴露等)、招募患者风险较高的研究(孕妇人群、儿童人群等)、无法识别非人物种的生物制剂(人类特异性单克隆抗体、人类细胞源生物制剂等)等。
三、行业情况

目前,全球专注于器官芯片业务的企业目前尚未有一家上市。资本化最快的是Hesperos,于2022年7月递交申请纳斯达克上市申请(NASDAQ:HESP),目前尚处于上市审核阶段。此外,器官芯片行业标杆公司Emulate于2021年完成了E轮融资,累计融资总额接近2.25亿美元。行业内一些公司,如心脏芯片公司TARA Biosystems(2022年被Valo Health收购)、肝脏芯片Hurel(2021年被BICO收购)等则以被收购的形式实现了下一阶段的发展。
应用上,欧美企业处于领先地位,但由于政策原因无法在中国触碰临床样本,给中国企业留下充分的潜在机会。
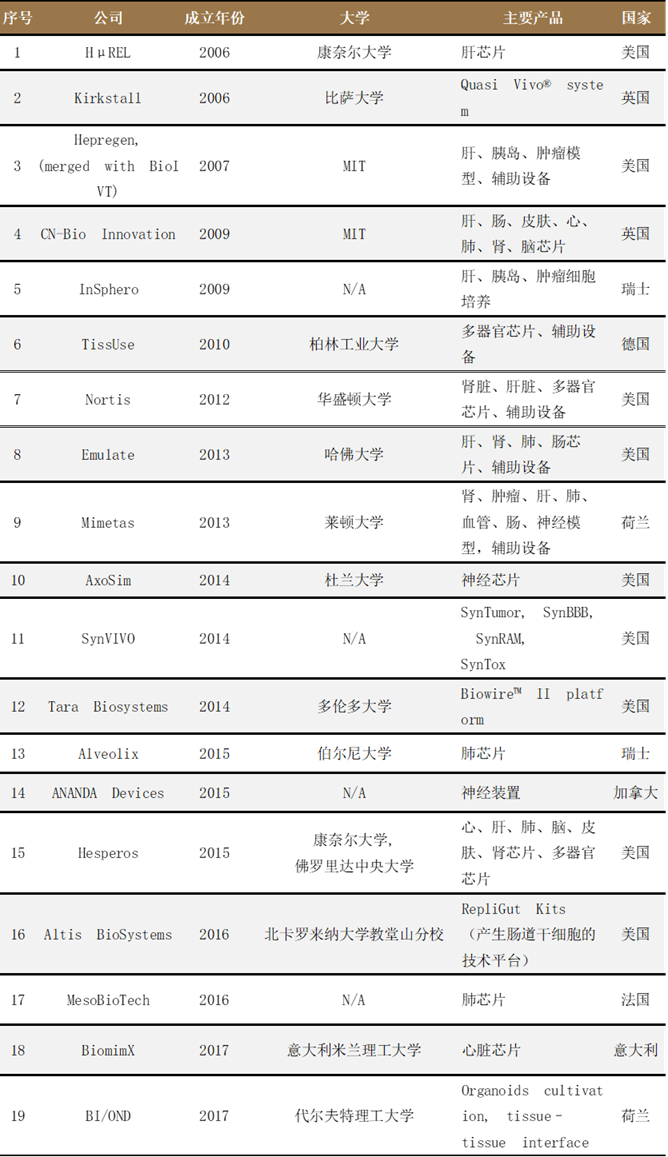
全球部分器官芯片公司,来源:公开信息
器官芯片上游主要包括仪器设备研(自动化高通量设备、高内涵成像设备等)、试剂耗材(试剂盒、芯片耗材、培养板等)、细胞培养材料(水凝胶、基质胶、合成支架等),中游主要包括提供器官芯片及其配套技术服务和分析的企业,下游主要包括制药公司、生物科技公司、科研院所等。

器官芯片公司主要商业模式,来源:公开信息
2.商业合作
2015年,J&J首次购买了Emulate的血栓芯片,用以检测其在已上市或正在开发的药物中的凝血性能。
2016年,Merk与Emulate达成合作协议,共同利用Emulate的器官芯片技术进行药物研发和毒性评估。
2018年,AstraZeneca将Emulate类器官芯片技术纳入其IMED药物安全实验室,是首家将类器官芯片技术整合进内部实验室的国际大药企。同年,Takeda将Emulate的肠芯片用于胃肠疾病的研究和开发;Roche采用Emulate的人体集成芯片研发新药,并利用患者衍生细胞和相应芯片测试患者或患者群体对药物的反应,从而促进个体治疗。另外,Pfizer也与HUB合作开发人类肠道类器官平台,用来研究克罗恩肠病、溃疡性结肠炎等疾病。
除了商业合作,Emulate还接到各种政府订单。例如,NASA与Emulate合作,将基于人体组织的模拟器芯片送往外太空,在国际空间站进行一系列实验,并与留在地球上的同类器官芯片进行比较,以观察重力或空间微重力对脑细胞及其认知功能的影响。
2019年,Roche与Emulate合作,旨在利用Emulate的器官芯片技术来改进其药物研发流程。同年,Abbott与CN Bio签订合作协议,开发肝脏和肾脏芯片用于药物研发和毒性评估。
2020年,FDA与Emulate合作,使用其肺芯片评估新冠感染过程中的自体免疫效应和新冠疫苗的安全性。FDA还计划与Emulate开展其他合作项目,包括使用脑芯片模拟阿尔茨海默病、使用肝芯片预测患者对药物的适应性等。美国陆军也与Emulate合作,研究病毒如何与肺细胞相互作用。
2021年,Pfizer与Emulate宣布建立战略合作伙伴关系,以利用Emulate的器官芯片技术改进其药物研发和评估方式。J&J与Hesperos签订合作协议,以使用Hesperos的肝脏和心脏芯片来评估药物的肝毒性和心脏安全性。Sanofi也与Hesperos合作,共同进行Enjaymo治疗罕见自身免疫脱髓鞘疾病的临床前研究(NCT04658472),并于2022年获得FDA认可,成为第二个基于器官芯片数据获得FDA批准开展适应症拓展临床的项目。
2022年,BMS与Prellis 达成合作,基于其人体淋巴结类器官平台创建针对人类蛋白质的高亲和力人类抗体。Sanofi也与Prellis达成合作,利用其平台在体外重建免疫反应以提供有显著遗传多样性的抗体等。
Emulate
总部位于美国马赛诸塞州波士顿,是一家私人控股公司。诞生于哈佛大学Wyss Institute,2014年从研究所独立,拥有哈佛大学的独家授权,并且与FDA合作密切。
1)技术平台
Emulate的人体仿真系统(HumanEmulationSystem)由器官芯片(耗材)、Pod模块设备(营养和药物剂量控制)、Zoë-CM2模块设备(细胞培养)、Orb中心模块设备(性能监控)、和软件(分析)组成。通过控制器官芯片上的气体环境、液流速度、机械拉力等,来模拟不同人体器官内的微环境,以实现疾病建模、靶点验证、候选药物的安全性和有效性评价等应用,最终提供一个比细胞培养或基于动物的测试方法更加精确、可控、高效的临床前模型。
Pod 每次仅能够灌注1个芯片,Zoë-CM2可同时运行12个芯片,Orb可以同时运行48个芯片。由于通量较小,目前主要供研究人员进行药物的早期研发。

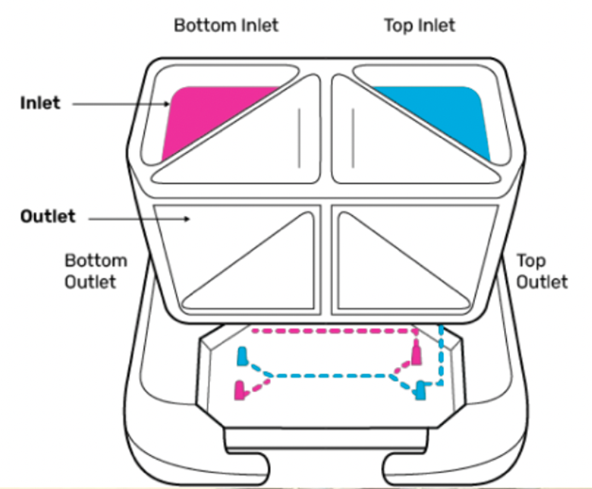

来源:Emulate官网
2)产品详情
目前,Emulate已经开发了多种器官模型,包括肝脏芯片、结肠芯片、十二指肠芯片、肾脏芯片、肺部芯片、大脑芯片(当前重点开发产品)、人体集成芯片等。
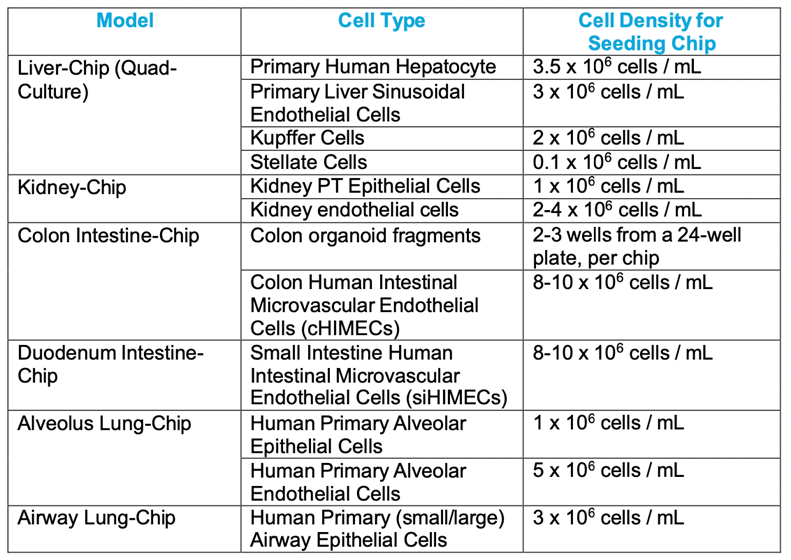
各种器官模型所用细胞类型及最佳接种密度,来源:Emulate官网
3)合作方&客户
2022年5月,Emulate与莱德伯特正式签约,授权在2022年3月至2025年3月期间,莱德伯特(北京)生物科技有限公司将全权负责Emulate人体仿真系统设备、耗材、试剂和软件在中国大陆市场的销售、推广、服务等工作。
全球排行前20的药企中,有18家使用Emulate器官芯片技术开展体外研究数据收集及测试,包括Pfizer、Roche、AstraZeneca、J&J、Takeda等。
4)营收情况
Emulate主要向客户通过销售设备、芯片耗材,并提供技术服务获得营收。2022年营收约2200万美元。
5)融资情况
Emulate还未上市,2021年完成E轮融资(估值不详),累计融资额接近2.25亿美元,是器官芯片细分领域中融资最多的公司。投资方包括Founders Fund、Northpond Ventures、Cedar Sinai Medical Center等海外知名机构。
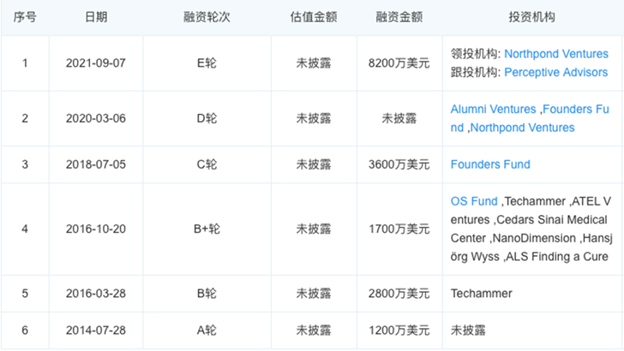
来源:公开信息
Hesperos(NASDAQ:HESP)
总部位于美国佛罗里达,是一家成立于2015年的体外人体集成芯片(Human-on-Chip)的先驱公司,与康奈尔大学和佛罗里达大学合作密切。目前,人类发现超过7000种罕见病,但由于缺少动物模型,仅有400种罕见病在研究进程中。Hesperos致力于通过器官芯片构建以往难以构建的疾病模型,让每一种疾病都能有对应的治疗方式。
1)技术平台
Hesperos的多器官平台使用患者捐赠的原代细胞或iPSC衍生细胞构建,由多达六种不同的器官类型组成,并且能够将这些器官模拟器与循环免疫细胞在同一无血清循环介质(血液替代品)中循环长达28天。
随着给药和系统循环发生,采用微电极阵列(MEA)和微悬臂来监测细胞的力、电活动等实时功能,在没有细胞死亡的情况下非侵入性地监测器官健康(对心率、呼吸、基本认知功能、肌肉和神经的反射测试、排泄以及肝脏、肾脏和造血功能的化学筛查),以模拟非侵入性的临床功能观察。
这些非侵入性的组织功能读数是细胞健康的直接指标,减少了对依赖于细胞死亡的生物标志物的依赖。如果在这些简单、信息量大的功能评估中观察到任何异常情况,就会对其他生物标志物进行检测评估,就像对病人进行血液测试一样。如果一个芯片停止运作,就会完成对组织的 "死后"检查。这种方法使该平台不仅可用于急性评估,还可用于对药物进行非侵入式的慢性评估,每次评估时间可长达数月。
2)产品详情
Hesperos的核心产品是Human-on-a-Chip® 多器官人体集成芯片。除此之外,还提供四种基本的多器官芯片模型,包括心-肝2器官模型,神经-肌肉交界2器官模型,心-肝-癌症3器官模型和心-肝-骨骼肌-神经元4器官模型。
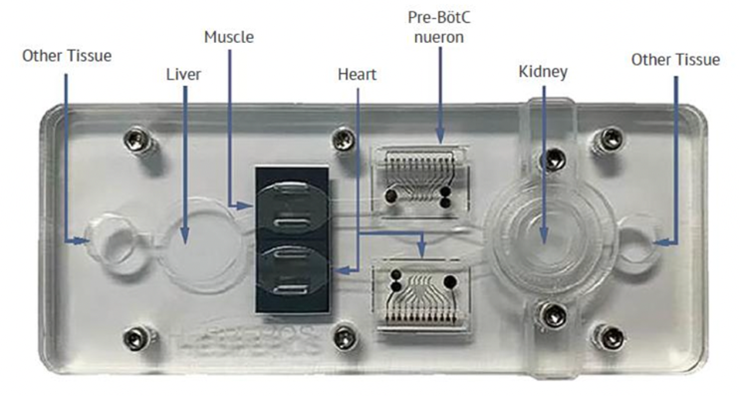
来源:Hesperos官网
Hesperos还提供血脑屏障、胃肠道模型、肾-肾近端小管等屏障组织模型,能够很容易与其基本模型的外壳设计相结合。将这些屏障组织模块添加到基本模块上可以帮助确定新型化合物的运输特性,并评估毒性反应等。
3)合作方&客户
包括L’Oreal、Sanofi、AstraZeneca、Roche在内的15家公司合作,除L’Oreal之外其他都是制药公司。
4)营收情况
Hesperos以CRO模式为客户提供服务。运营资金主要来自NIH拨款。除此之外,还有创始人Dr. James Hickman的资金支持,以及为化妆品和制药行业的客户提供服务所产生的收入。
2020年度,营收520万美元,净收入10万美元。2021年度,营收520万美元,净亏损50万美元。2022 Q1,营收110万美元,净亏损30万美元
5)上市发行
2022年7月递交纳斯达克上市申请,目前处于审核阶段(市值不详)。迄今没有开放过重大的外部投资。
小 结

器官芯片领域前景可期,近两年里程碑事件频出。但是,行业标准尚不完善,大规模商业化时机与FDA和CDE的监管政策密切相关。
头部公司Hesperos处于上市关键时期,对后来公司的业务和市值具有参考意义;Emulate占据最大市场份额,但缺少营收和利润的公开信息。
总体来说,器官芯片处于行业发展早期,欧美相对成熟,国内相关标的少,需要对器官芯片模型和商业模式做详细评估。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 南京市江宁区科学园乾德路5号