药融圈(药融云数据www.pharnexcloud.com)监测显示:近期,恒瑞医药研发的HRS9531片的临床试验申请/IND获得国家药品监督管理局(NMPA)药品审评中心/CDE受理(盛迪医药申报)。

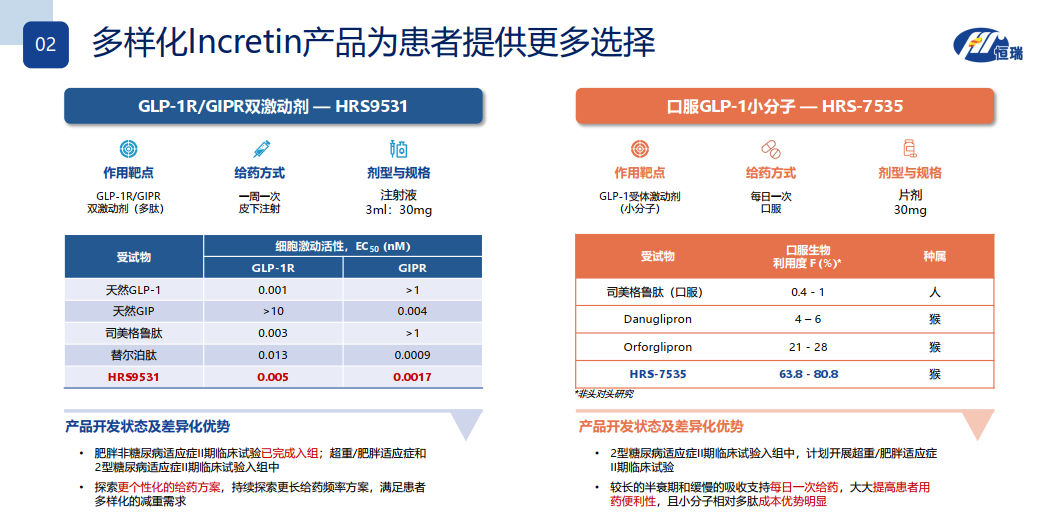
本品HRS9531,是恒瑞自主研发的新型GLP-1和GIP双重受体激动剂,可通过同时激动GLP-1和GIP受体,发挥葡萄糖依赖性的促胰岛素分泌、抑制食欲和改善胰岛素敏感性等作用,潜在帮助降低血糖和减轻体重。
此前,本品的其他剂型如HRS9531注射液,已经在开展减重以及2型糖尿病适应症临床试验。

早在2023年12月IDF大会披露数据:HRS9531-102为一项随机、双盲、安慰剂对照、开放阳性对照的Ib期临床试验(NCT05516966),旨在评估HRS9531注射液在2型糖尿病患者中多次皮下注射的安全性、耐受性、PK及药效学特性。
方法 研究纳入经单纯生活方式干预或二甲双胍治疗至少8周的2型糖尿病患者。 受试者随机分配接受HRS9531注射液0.3 mg、1.5 mg、4.5 mg(2.0/2.0/3.0/4.5 mg滴定)、度拉糖肽1.5 mg或安慰剂治疗,每周皮下注射给药一次,共4周。主要研究终点为HRS9531的安全性和耐受性。 结果 共63例受试者接受了至少一次给药,其中HRS9531组、度拉糖肽组和安慰剂组分别为43、8和12例。 安全性 不良事件均为轻度到中度(大多数为轻度),未发生严重、导致永久停药和死亡的不良事件。 PK HRS9531的暴露量Cmax和AUC在0.3~4.5 mg范围内随剂量增加而增加,末端消除半衰期约1周。 单次给药后的中位Tmax为72.0~94.8 h,4次给药后的中位Tmax为48.0~71.8 h。 PD 给药4周后,HRS9531的1.5 mg组和4.5 mg组FPG达标率(<7 mmol/L)分别为64.3%和84.6%,而度拉糖肽和安慰剂分别为25.0%和16.7%;餐后2小时血浆葡萄糖达标率( <10 mmol/L)分别为57.1%和100.0%,而度拉糖肽和安慰剂分别为25.0%和0.0%,均明显高于度拉糖肽组和安慰剂组。 空腹血浆葡萄糖(FPG)在给药后呈剂量依赖性下降,混合餐后0到3小时血浆葡萄糖曲线下面积、体重、HbA1c、低密度脂蛋白胆固醇等指标也均呈剂量依赖性下降。4.5mg组第29天时的FPG、体重降低幅度最大,分别为2.9 mmol/L、2.2 kg。
药融云数据www.pharnexcloud.com显示:恒瑞医药,布局的GLP-1靶点药物有:GCGR抗体/GLP-1融合蛋白的SHR-1816、口服小分子HRS-7535片、HRS9531(GLP-1/GIP双受体激动剂多种剂型)、HR17031、SHR-2042、诺利糖肽等等。
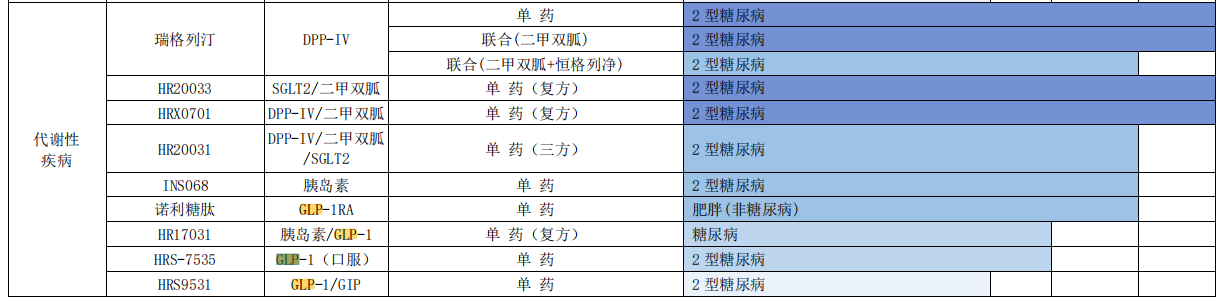

恒瑞医药2022年财报图片
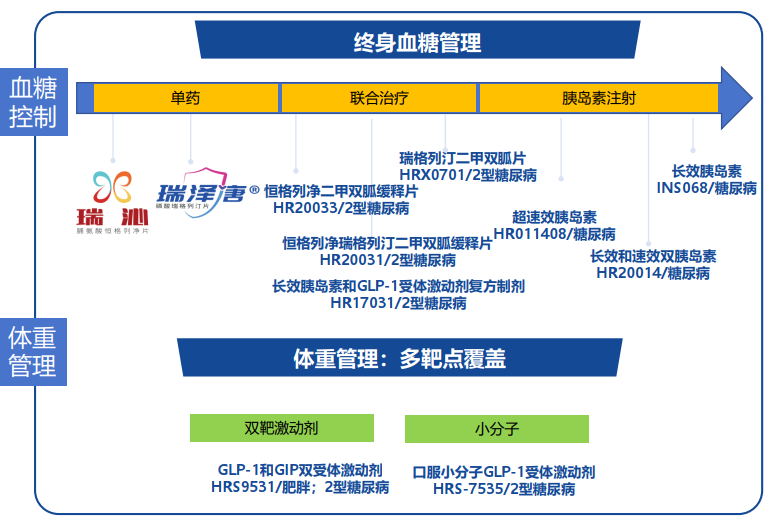
恒瑞医药研发日,2023年11月图片
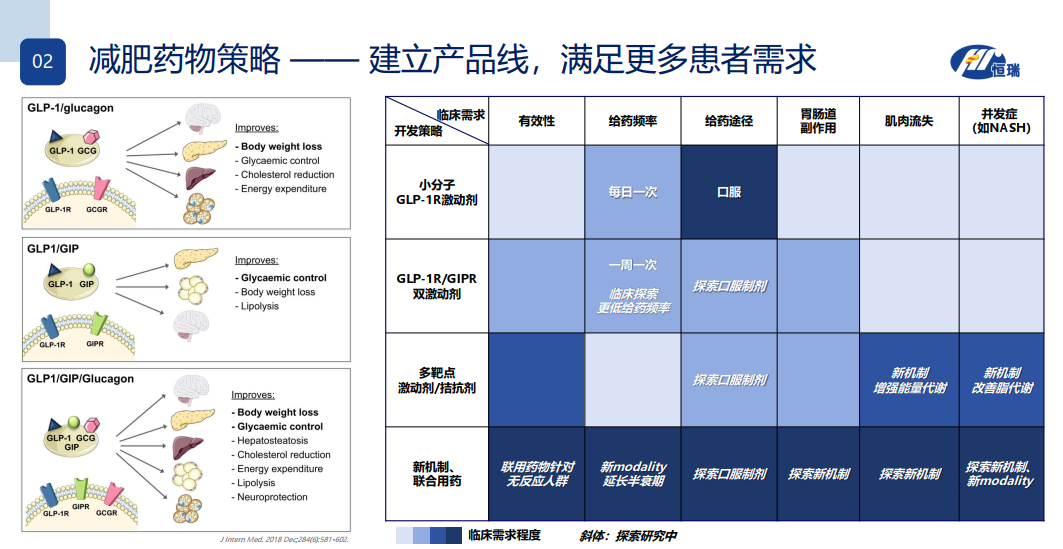
恒瑞减肥药物策略
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 南京市江宁区科学园乾德路5号