2023年10月17日,美国制药公司Ardelyx(NASDAQ:ARDX)宣布其First-in-class口服肠道钠/氢交换体3(NHE3)抑制剂Tenapanor片(盐酸替纳帕诺片,商品名XPHOZAH)用于成人慢性肾脏病(CKD)透析患者的血清磷控制的上市申请已获得美国FDA批准。XPHOZAH(Tenapanor)是一种磷酸盐吸收抑制剂(PAI),具有差异化的作用机制,通过局部抑制胃肠道中的NHE3,引起上皮细胞连接的收紧,从而显著减少细胞旁途径对磷酸盐的摄取,这是磷酸盐吸收的主要途径,进而降低血清磷水平。
此次批准结束了Ardelyx与FDA长达两年的“拉锯战”,这两年时间里,该公司的股价也随着XPHOZAH(Tenapanor)的监管进展“跌宕起伏”。2021年,Ardelyx市值一度跌到仅剩1.2亿美元,到2023年底市值已达14.3亿美元,两年内翻了10多倍。截止4月25日,收盘市值为14.68亿美元,每股6.31美元。
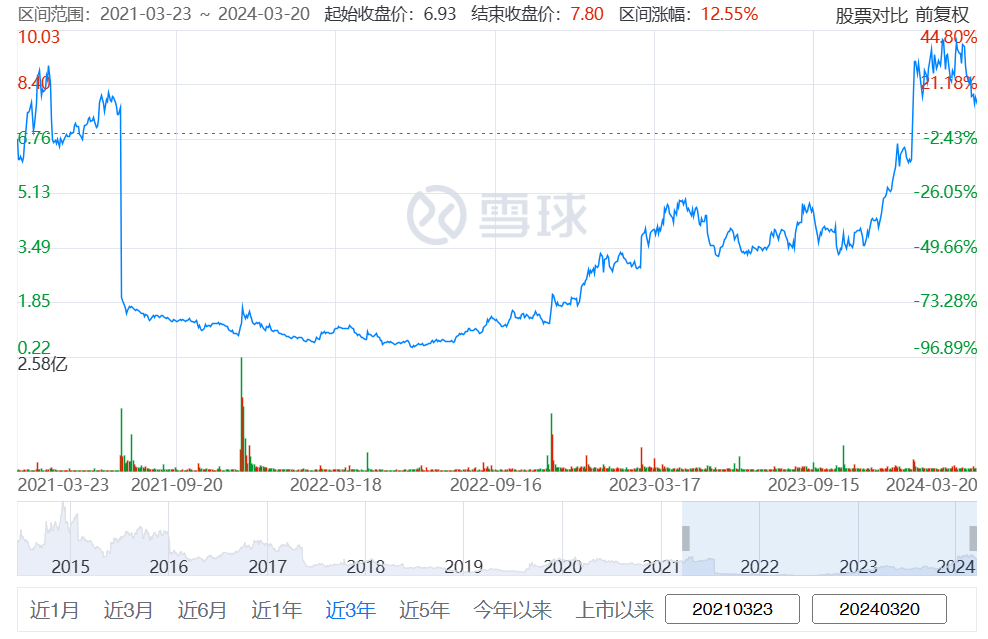
药融云数据www.pharnexcloud.com显示:2020年6月,Ardelyx首次向美国FDA递交XPHOZAH(Tenapanor)用于成人CKD透析患者的血清磷控制的NDA申请,此次递交基于三项共涉及1000多名患者的3期试验,三项研究均达到关键疗效终点。据估计,在美国有超过55万名成年慢性肾脏病(CKD)患者正在接受透析治疗,其中大约80%的患者需要接受高磷酸盐血症的治疗。

2021年7月,Ardelyx收到FDA的完整回复函(CRL)。根据CRL的说法,FDA认为该药的治疗效果“小且临床意义不明确”,并指出Ardelyx需要进行一项额外的试验以证明XPHOZAH(Tenapanor)对降低血清磷水平或CKD透析患者高磷血症的治疗效果。受此负面影响,Ardelyx当月股价暴跌77%,后续该公司又实施了重组计划,大幅裁员。
不过Ardelyx并不认可FDA在CRL中提出的要求,并于2021年11月宣布提出上诉。
关于这一争议,业界推测,可能是因为国际公认的KDIGO(全球改善肾脏病预后组织)治疗指南建议将患者的血清磷酸盐水平降至正常范围(2.5-4.5 mg/d),虽然XPHOZAH(Tenapanor)的三项临床试验均达到关键试验终点,但却未达到指南中建议的降至正常范围。而Ardelyx认为目前广泛使用的磷酸盐结合剂药物无法维持长期的效果,70%的患者无法在6个月的时间内维持<=5.5 mg/dL的血磷水平,XPHOZAH(Tenapanor)虽说未使大部分患者血清磷酸盐降至正常水平,但其显示出长期的治疗效果,而且与透析患者平均每日需要服用十几粒药物(大约一半是磷酸盐结合剂)相比,XPHOZAH(Tenapanor)仅需每次服用一片30mg的剂量,每日两次。
2022年11月,XPHOZAH(Tenapanor)迎来了转机,美国FDA心血管和肾脏药物咨询委员会(CRDAC)会议上,CRDAC以9:4的投票结果支持XPHOZAH(Tenapanor)单药治疗成人CKD透析患者高磷血症的益处大于风险,并以10:2(1票弃权)的投票结果支持XPHOZAH(Tenapanor)与磷酸盐结合剂联用的治疗益处大于风险。消息公布次日,Ardelyx股价大涨41%。2022年12月,FDA通过了Ardelyx的上诉。2023年4月,Ardelyx重新递交了XPHOZAH(Tenapanor)的NDA申请,在6个月后的10月17日官宣获批。
XPHOZAH(Tenapanor)的获批可以说是肾病学领域的一个里程碑,该药是第一种能够直接阻断磷酸盐吸收的高磷酸盐血症治疗药物,基于新的作用机制,提供了一个新的治疗选择。该药获批后次月便已在美国上市,Ardelyx还将该药整合到患者服务计划ArdelyxAssist™中,为患者提供可及性和可负担性支持。
药融云数据www.pharnexcloud.com显示,早在2019年,Tenapanor便已获得美国FDA批准治疗成人便秘型肠易激综合征(IBS-C),商品名为IBSRELA,每次服用一片50mg,每日两次。IBS-C是一种胃肠道(GI)疾病,其特征是腹痛和排便习惯的改变,77%接受治疗的IBS-C的患者依然有腹部和排便相关症状,其中腹胀是最常见的。Ardelyx基于独特的发现平台和对肠道中钠转运的主要机制的深入了解,开发了IBSRELA(Tenapanor),成为首个获美国FDA批准治疗成人IBS-C的NHE3抑制剂。
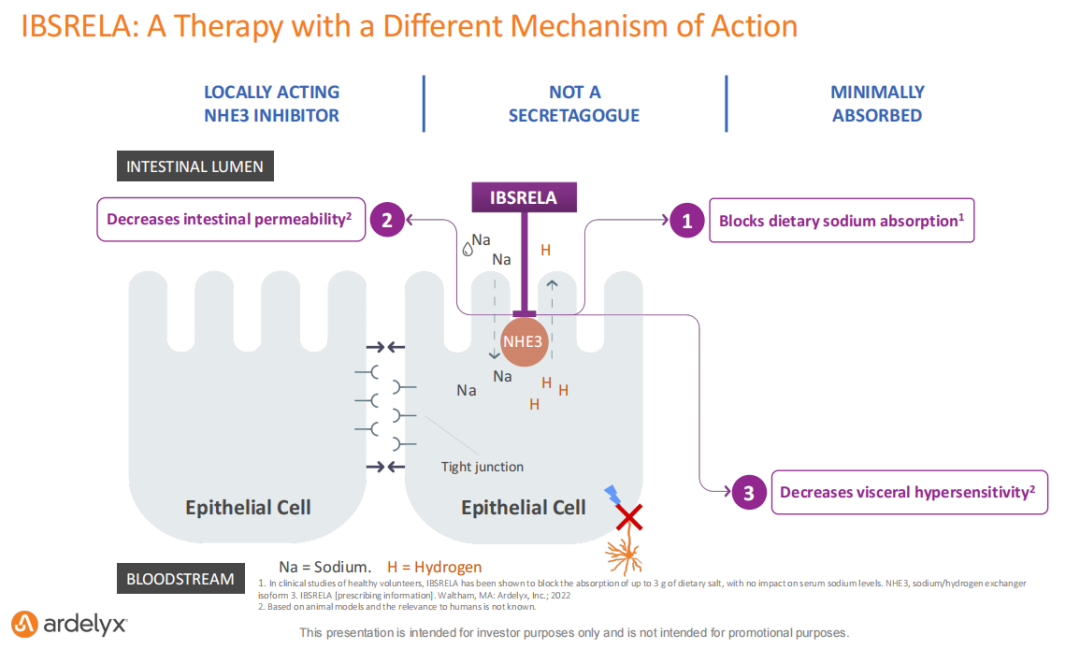
IBSRELA(Tenapanor)在肠道局部作用,阻断饮食中钠的吸收,降低肠道通透性,降低内脏过敏反应,且吸收率低,可增加患者排便次数,缓解腹痛。该药于2022年4月在美国市场推出,因此Ardelyx目前有两款商业化的产品,该公司预计IBSRELA(Tenapanor)的销售峰值有望超过10亿美元。
Ardelyx公司致力于发现、开发和商业化创新的first-in-class药物,以满足重大的未满足的医疗需求,自2007年成立以来一直专注于对离子运输生物学机制的深刻理解。该公司开发了一个独特和创新的平台,能够发现新的生物学机制和途径,最大限度地减少传统的系统吸收药物经常遇到的副作用和药物-药物相互作用。Ardelyx的管线中另有两款早期小分子项目。
RDX013是一款小分子排钾药物,可用于潜在地治疗高钾血症,或高血清钾水平。高钾血症是心脏和肾脏疾病患者的常见并发症,特别是在服用常用肾素-血管紧张素-醛固酮系统(RAAS)抑制剂的患者中。RDX013是一种创新机制的调节剂,旨在靶向钾的分泌并降低钾含量升高的潜在生物学机制。药融云数据www.pharnexcloud.com显示,RDX013已完成一项2期剂量探索试验,评估RDX013治疗未接受透析的CKD患者高钾血症的安全性和有效性。虽然该研究的结果证明了RDX013可接受的安全性和耐受性,并支持了其降低血清钾水平的概念证明,且经过8天的治疗后,患者血清钾水平与安慰剂组相比具有统计学意义的降低,但是该研究未达到治疗4周后显著降低血清钾水平的主要终点。
Ardelyx另有一项处于药物发现阶段的项目,RDX020是一种选择性的碳酸氢盐分泌抑制剂,有可能通过靶向肠道碳酸氢盐交换机制,为治疗代谢性酸中毒提供一种新的方法。代谢性酸中毒是CKD患者中非常普遍的合并症,与疾病进展和不良结局密切相关,目前尚无药物获批治疗该病。不过根据药融云数据www.pharnexcloud.com提供线索,该项目研发无后续进展报道,或已终止。
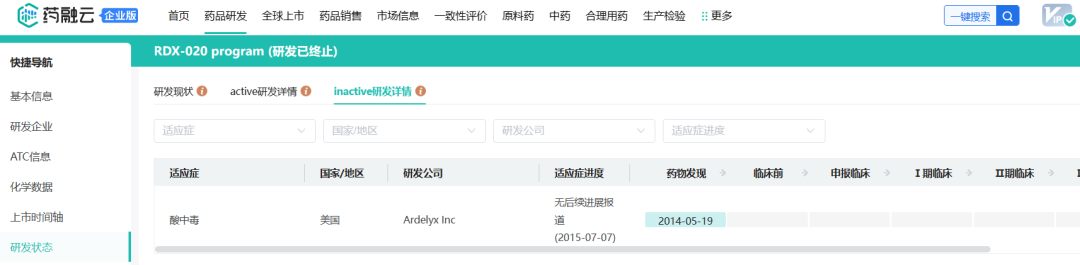
截图自药融云数据库
该公司年报中也提到,Ardelyx的资源将优先考虑支持IBSRELA(Tenapanor)和XPHOZAH(Tenapanor)商业化后的其他活动,在此之前,预期将不会大力推进这两项早期资产。
2024年3月25日,Ardelyx宣布任命Mike Kelliher为企业发展和战略执行副总裁,他在生物制药行业拥有20多年经验,曾任Horizon Therapeutics的并购和业务发展集团副总裁,Horizon在2023年10月被安进以278亿美元收购,Kelliher先生在该收购案中发挥了重要作用。所以我们有理由推测,Ardelyx公司或将开始更加积极地寻求BD合作并制定新的企业战略。
Ardelyx目前拥有IBSRELA(Tenapanor)和XPHOZAH(Tenapanor)在美国的专有权,并与日本的协和麒麟、中国的复星医药和加拿大的Knight Therapeutics在各自地区的特定适应症的开发和商业化达成了协议。
2017年11月,Ardelyx与协和麒麟株式会社签订了独家许可协议,协和麒麟将负责在日本开发和商业化Tenapanor,用于治疗心肾疾病及其相关病症,包括高磷血症。2023年9月,Tenapanor在日本被批准用于治疗成人慢性肾脏病(CKD)透析患者的高磷血症。在日本,该药以PHOZEVEL®为品牌名进行销售。
2017年12月,Ardelyx与复星医药签订独家许可协议,复星医药将负责在中国开发和商业化Tenapanor治疗便秘型肠易激综合征(IBS-C)和高磷血症。2023年7月,复星医药宣布,控股子公司复星医药产业获许可的创新药Tenapanor片(盐酸替纳帕诺片)用于控制正在接受血液透析治疗的慢性肾脏病(CKD)成人患者的高磷血症的药品注册申请已获国家药监局审评受理。该药已于2023年10月在香港获批治疗IBS-C。
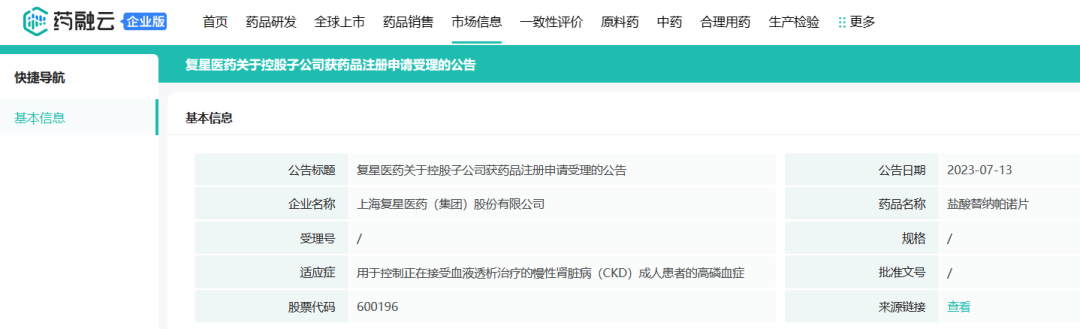
截图自药融云数据库
2018年3月,Ardelyx与Knight Therapeutics签订了独家许可协议,Knight Therapeutics将负责Tenapanor在加拿大的商业化,用于治疗IBS-C和高磷血症。IBSRELA(Tenapanor)于2021年3月在加拿大获批治疗IBS-C。
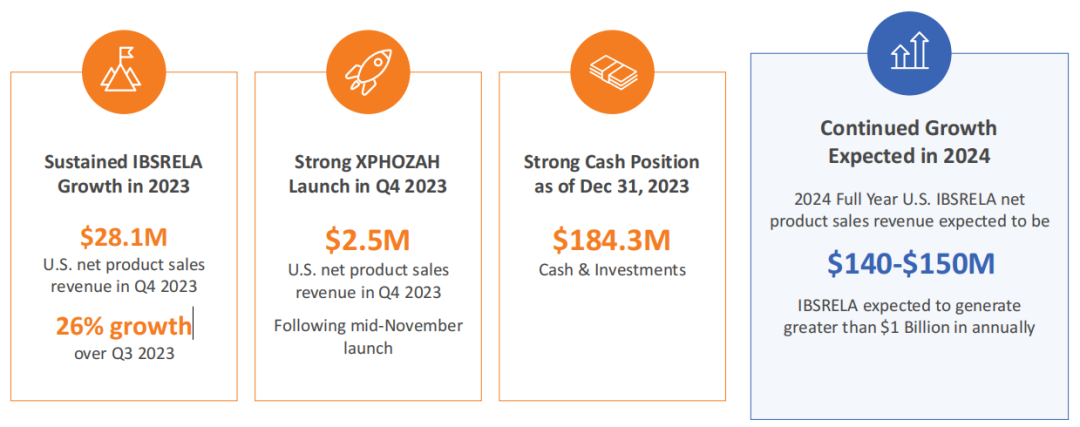
截至2023年12月31日,Ardelyx拥有现金、现金等价物和短期投资总额为1.843亿美元。自2007年10月开始运营以来,Ardelyx致力于研发活动,包括开发专有的药物发现和设计平台,以及商业化活动。截至2023年12月31日,该公司累计赤字为8.462亿美元。
2023年是IBSRELA(Tenapanor)第一个完整的销售年度,年销售业绩为8010万美元,2023年Q4业绩为2810万美元,与Q3相比,环比增长26%。Ardelyx在2024年1月份预计IBSRELA将有望在专利期满前,在美国便秘型肠易激综合征(IBS-C)处方市场中占有10%以上的份额,并在美国市场产生超过10亿美元业绩的销售峰值。该公司预计2024全年IBSRELA在美国的业绩将在1.4亿美元至1.5亿美元。
XPHOZAH(Tenapanor)自2023年11月在美国市场首次推出,2023年Q4销售额为250万美元。2024年2月,该公司宣布计划启动一项长期、前瞻性的观察性队列研究,旨在收集XPHOZAH的真实世界证据,研究目的是评估基于XPHOZAH的方案(XBR)在现实世界中对未接受磷酸盐结合剂治疗的维持透析的高磷血症患者的影响,该研究将对美国患者进行长达3年的随访。2023年11月,公司宣布XPHOZAH已被美国FDA授予孤儿药资格,用于治疗小儿高磷血症。
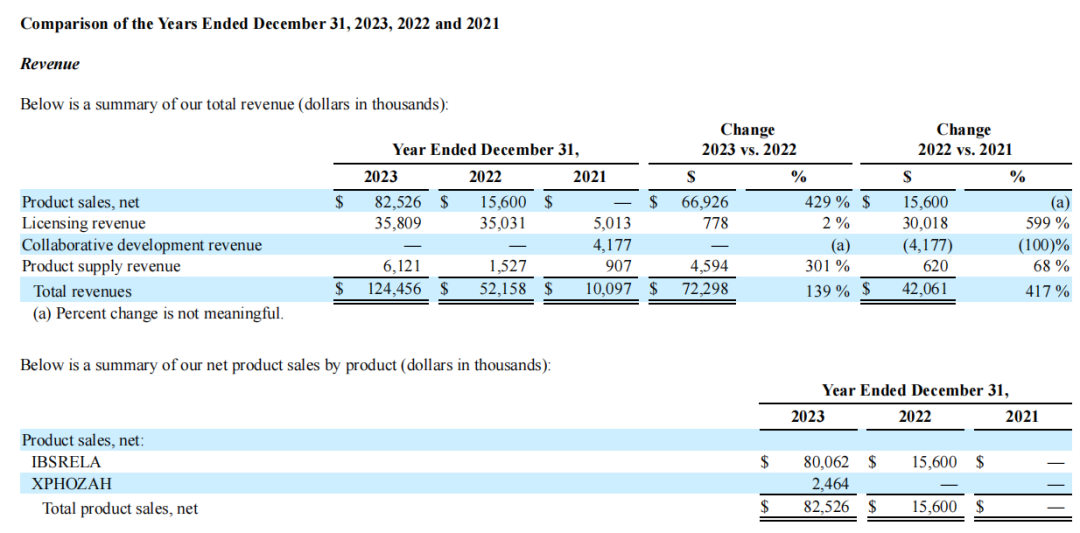
2023全年,Ardelyx公司总收入为1.245亿美元,同比增长139%,主要是由于净产品销售额、许可收入和产品供应收入的增加;全年研发费用为3550万美元,同比持平;销售、一般及行政费用为1.344亿美元,同比增长75%,主要是由于商业化活动相关费用增加;全年净亏损为6610万美元,或每股0.30美元。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 南京市江宁区科学园乾德路5号