根据美国FDA官网的公开信息[1],解读2023年第一季度获FDA药物评估和研究中心(CDER)批准上市的药物。以下文字内容大多参考自FDA官方的药物说明书,部分的数据除非特别引用,一般是参考维基百科和药企官方公告。
1/6/2023: Leqembi (lecanemab-irmb)
基本信息:Leqembi是由日本卫材和Biogen联合开发的靶向淀粉样蛋白β的单抗药物,用于治疗阿尔茨海默病。阿尔茨海默病是一种不可逆转的进行性脑部疾病,影响着超过650万美国人。阿尔茨海默氏症的具体病因目前尚不完全清楚,但它的特点包括淀粉样蛋白斑块和神经原纤维或tau蛋白缠结,从而导致神经元及其连接丢失。这些变化会影响一个人的记忆和思考能力。Leqembi通过从大脑中去除有害的淀粉样蛋白斑块来减缓神经退行性疾病进展。2021年6月,卫材和Biogen的Aduhelm单抗成为FDA自2003年以来的首款阿尔茨海默病,但其自上市以来就饱受争议,认为目前的临床证据并没有表明该药物可以减缓患者认知能力的下降。
临床表现:此前,研究人员在一项针对856名阿尔茨海默病患者的双盲、安慰剂对照研究中评估了Leqembi的疗效。在患有轻度认知障碍或轻度痴呆疾病阶段并确认存在淀粉样蛋白病理学的患者中开始治疗。与接受安慰剂组治疗的患者相比,接受批准剂量的Leqembi(每两周10 mg/kg)的患者从基线到第79周,脑淀粉样蛋白斑块在统计学上显著减少。Leqembi最常见的副作用是输液相关反应、头痛和ARIA(淀粉样蛋白相关成像异常,包括脑肿胀和脑出血风险)[2]。
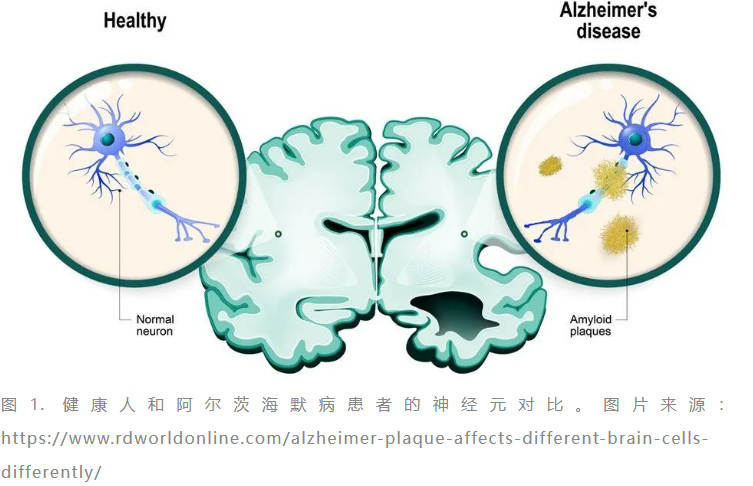
1/20/2023: Brenzavvy (bexagliflozin)基本信息:Bexagliflozin是TheracosBio研发的钠-葡萄糖协同转运蛋白 2 (SGLT2) 抑制剂,用于改善成人2型糖尿病患者的血糖控制。目前已经有多个SGLT2抑制剂上市,其中恩格列净(Empagliflozin)和达格列净(Dapagliflozin)占据的市场份额最高,2021年的销售额分别为58.29亿美元和32.74亿美元。SGLT2主要在肾脏表达,负责从肾小管腔重新吸收过滤后的葡萄糖和钠,当SGLT2被抑制后,肾脏对葡萄糖和钠的重吸收都会减少。Bexagliflozin还是第一个获FDA批准的猫用SGLT2抑制剂。
临床表现:FDA 的批准基于在5,000多名2型糖尿病患者进行的3期临床研究。无论是作为单一疗法,与二甲双胍联合使用,还是作为由多种方案(包括二甲双胍,磺脲类药物、胰岛素、DPP4 抑制剂)组成的标准护理治疗的补充,Bexagliflozin在24周后都显著降低了血红蛋白A1c和空腹血糖。尽管 Bexagliflozin未被批准用于降低体重或血压,但在临床中已观察到体重和收缩压的适度下降[3]。
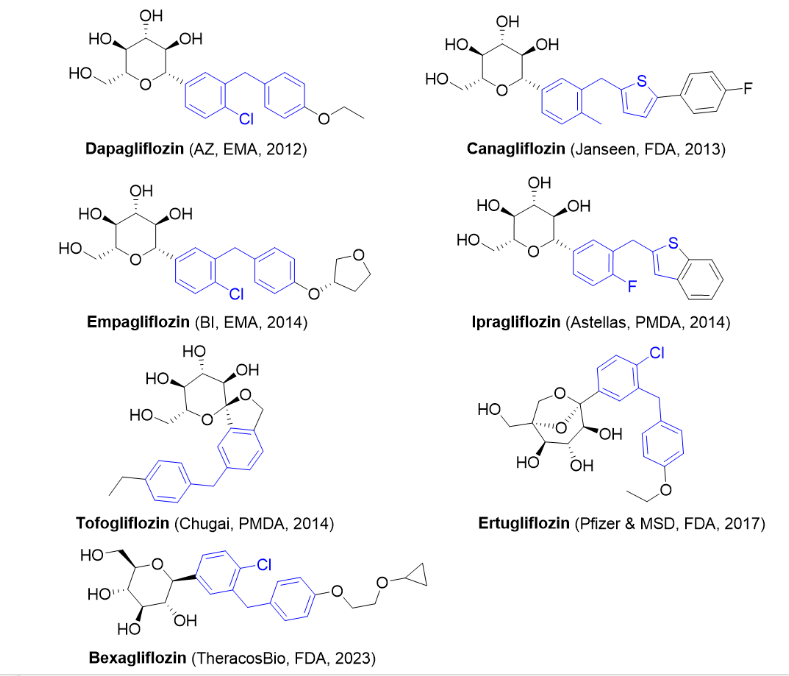
1/27/2023: Jayprica (Pirtobrutinib)基本信息:Pirtobrutinib是由Lilly公司开发(该药物最初由Redx Pharma研发,后续被Loxo Oncology以4000万美元收购,Lilly又于2019年以约80亿美元收购Loxo)的非共价BTK激酶抑制剂,用于治疗至少二线全身治疗(包括BTK抑制剂)后复发或难治性套细胞淋巴瘤(MCL)的成年患者。BTK是B细胞抗原受体 (BCR) 和细胞因子受体通路的信号蛋白。在B细胞中,BTK信号导致B细胞增殖、运输、趋化性和粘附所必需的通路激活。Pirtobrutinib与BTK野生型和C481突变体结合,从而抑制BTK激酶活性。在非临床研究中,Pirtobrutinib抑制BTK介导的B细胞CD69表达并抑制恶性B细胞增殖。临床表现:FDA的批准基于单臂的BRUIN试验中部分患者的数据,疗效评估基于120名MCL患者。其中,93%的患者接受过2次或以上治疗,所有患者均接受过一种或多种共价BTK抑制剂的既往治疗。接受治疗的MCL患者的总体缓解率(ORR)为50%,缓解持续时间(DOR)中位数为8.3个月[4]。
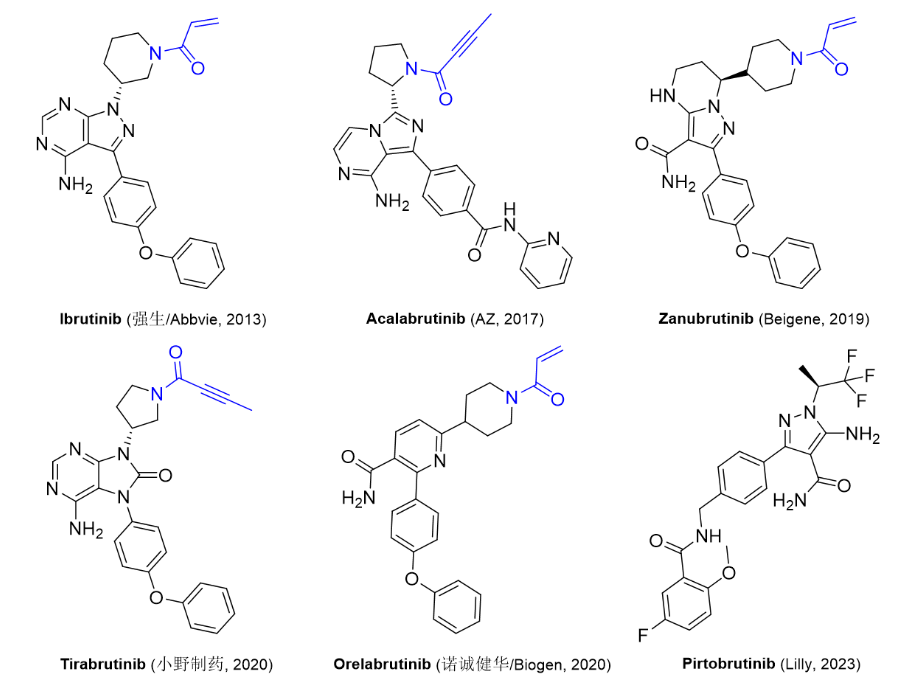
图3. 目前获批上市的BTK抑制剂。
1/27/2023: Orserdu (elacestrant )基本信息:Elacestrant是由Stemline Therapeutics(意大利药企Menarini Group子公司)开发的口服雌激素受体拮抗剂(Selective Estrogen Receptor Degrader,SERD),用于治疗在至少一种内分泌治疗后疾病进展的,ER+/HER2-、ESR1突变的晚期或转移性乳腺癌的绝经后女性或成年男性。在ER+/HER2-乳腺癌细胞中,Elacestrant在诱导通过蛋白酶体途径介导的ERα 蛋白降解的浓度下抑制17β-雌二醇介导的细胞增殖。Elacestrant在体外和体内均表现出抗肿瘤活性,包括对氟维司群、CDK4/6抑制剂耐药的ER+/HER2-乳腺癌模型以及具有雌激素受体1基因 (ESR1) 突变的模型。此前,SERD只有氟维司群于2002年上市,且需要肌肉注射给药。
临床表现:FDA的批准基于在EMERALD III期临床试验的的疗效,该试验招募了478名ER+/HER2-晚期或转移性乳腺癌的绝经后女性和男性,其中228 名患者具有ESR1突变。患者被随机分配 (1:1) 接受每天一次口服Elacestrant (n=239) 或研究者选择的内分泌治疗 (n=239),其中包括氟维司群 (n=166) 或芳香酶抑制剂 (n=73),主要疗效结果指标是无进展生存期(PFS)。在228名(48%)有ESR1突变的患者中,Elacestrant组的PFS中位数为3.8个月,氟维司群或芳香酶抑制剂组为1.9个月[5]。
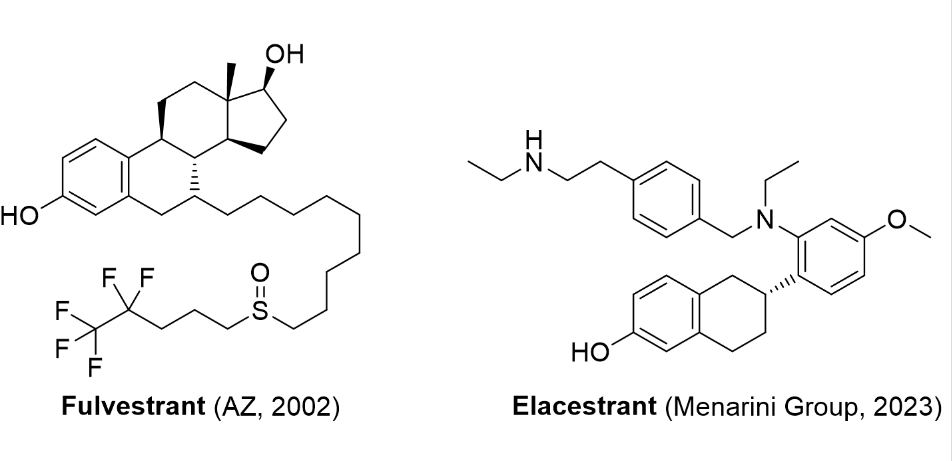
图4. 目前获批上市的选择性雌激素受体拮抗剂。
2/1/2023: Jesduvroq (daprodustat)
基本信息:Daprodustat是由GSK开发的口服HIF-PHI(缺氧诱导因子-脯氨酰羟化酶)抑制剂,用于每日一次治疗接受透析至少四个月的成人因慢性肾病 (CKD) 引起的贫血。抑制HIF-PHI可以稳定缺氧诱导因子,从而导致促红细胞生成素和其他参与纠正贫血的基因转录,类似于人体在高海拔地区发生的生理效应。CKD是一个日益增加的全球健康负担,影响着全世界7亿患者,据估计,1/7的患者还患有贫血。CKD在美国影响着大约3900万人,其中大约600万人患有贫血。美国大约有810,000名终末期肾病 (ESRD) 患者。其中,有558,000名患者接受透析。2021年8月,FDA批准了HIF-2α抑制剂Belzutifan,用于治疗希佩尔-林道综合征(VHL综合征,一种遗传病)相关的肾细胞癌、CNS血管母细胞瘤或胰腺神经内分泌肿瘤(pNET)成年患者。
临床表现:FDA的批准基于ASCEND-D试验的结果,该试验评估了daprodustat治疗透析患者CKD贫血的有效性和安全性。该计划招募了8,000多名接受长达4.26年治疗的患者。与标准护理促红细胞生成素刺激剂 (ESA)相比,daprodustat可改善和/或维持血红蛋白 (Hb) 在目标水平 (10-11.5 g/dL) 内,而不会增加意向治疗 (ITT) 人群的主要不良心血管事件[2]。
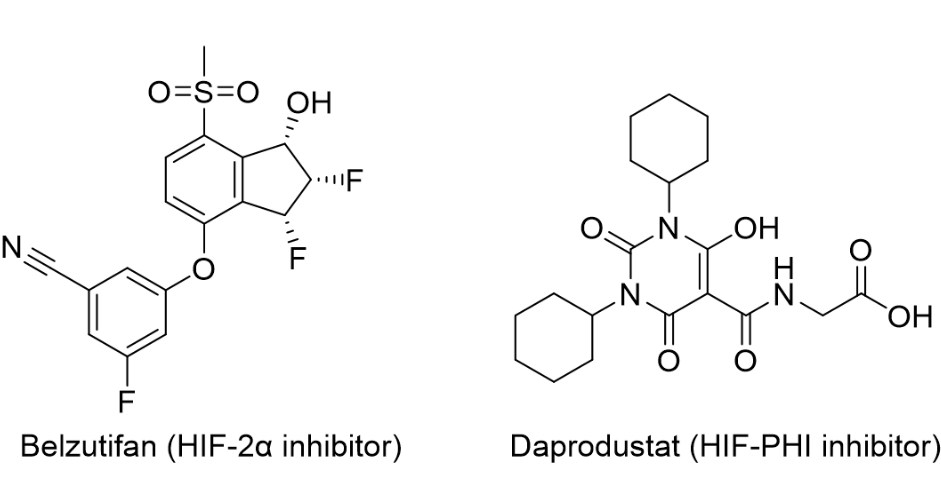
图1. HIF-2α抑制剂Belzutifan和HIF-PHI抑制剂daprodustat的分子结构。
2/16/2023: Lamzede (velmanase alfa-tycv)基本信息:Lamzede是意大利的凯西制药研发的用于治疗α-甘露糖苷贮积症(Alpha-mannosidosis, AM)患者的非中枢神经系统临床表现,是AM在美国批准的第一种酶替代疗法。Lamzede是一种重组形式的人类 α-甘露糖苷酶,旨在提供或补充天然 α-甘露糖苷酶,这种酶参与富含甘露糖的寡糖的降解,以防止它们在体内各种组织中积累。Lamzede的作用与人体内的α-甘露糖苷酶相同,从而恢复患者的正常细胞活性。患者每周接受一次10mg的Lamzede注射。
AM是一种极为罕见的遗传病,全世界每500,000人中就有1人患有AM。AM导致身体细胞无法正确分解某些复杂的糖类,糖的积累会影响身体的许多器官和系统,症状可能包括反复发作的胸部和耳部感染、听力丧失、独特的面部特征、肌肉无力、骨骼和关节异常、视觉异常和认知异常。2018年,Lamzede在欧洲上市,用于治疗轻度至中度AM患者的非神经系统临床表现[3]。2/17/2023: Filspari (sparsentan)基本信息:Sparsentan是由Travere Therapeutics公司开发的每日一次的口服药物,选择性靶向内皮素-1和血管紧张素 II(IgAN疾病进展中的两个关键途径),是第一个用于治疗IgAN疾病的非免疫抑制疗法。IgAN是一种罕见的进行性肾脏疾病 (RKD),也称为Berger病,其特征是IgA(一种帮助身体抵抗感染的免疫球蛋白)在肾脏中积聚。IgA的沉积导致肾脏正常过滤机制崩溃,尿液中出现血液(血尿)、蛋白质(蛋白尿),且肾功能逐渐丧失。IgAN的其他症状可能包括肿胀和高血压。IgAN是全球最常见的原发性肾小球肾炎类型,全球患者多达150,000人,也是肾小球疾病导致肾衰竭的主要原因。临床表现:FDA的批准基于3期PROTECT研究中,这是迄今为止在IgAN中最大的头对头研究。PROTECT研究是一项全球性、随机、多中心、双盲、主动对照临床试验,评估400 mg Sparsentan与300 mg厄贝沙坦在404名IgAN和顽固性IgAN成人患者中的安全性和有效性。在治疗36周后,接受Sparsentan治疗的患者的蛋白尿从基线平均减少了49.8%,相比之下,厄贝沙坦治疗组为15.1%[4]。
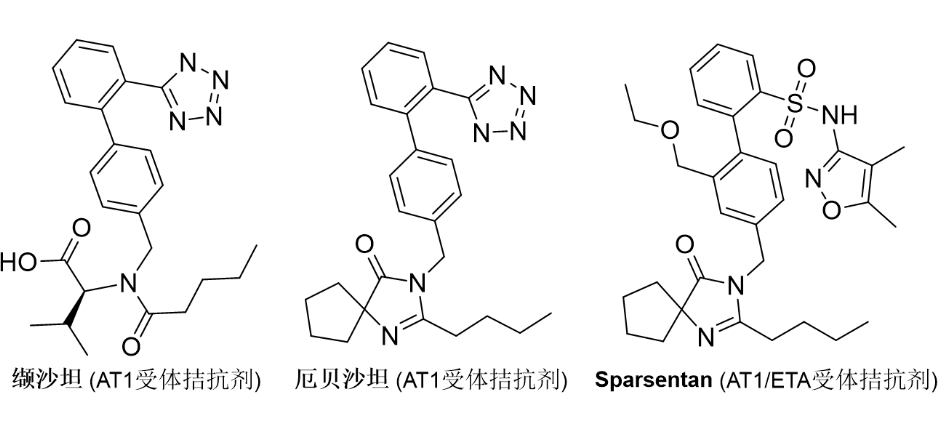
图2. 部分获批上市的AT1抑制剂。
2/28/2023: Skyclarys (omaveloxolone)
基本信息:Omaveloxolone是由Reata Pharmaceuticals开发的first-in-class口服药物,用于每天一次治疗16岁及以上的弗里德赖希共济失调(Friedreich’s ataxia)。Friedreich’s ataxia是由编码线粒体蛋白frataxin的基因突变引起的。功能性frataxin的丧失会破坏铁硫簇的生物合成,诱导线粒体功能障碍并增加对氧化应激的敏感性。该疾病会对脊髓、周围神经和大脑造成进行性损伤,导致肌肉运动不协调、平衡不良、行走困难、言语和吞咽能力改变以及寿命缩短。Omaveloxolone的治疗机制尚不清楚,一般认为Omaveloxolone属于NRF2激活剂(五环三萜类),通过激活抗氧化转录因子NRF2起作用。在美国,估计有5,000人患有弗里德赖希共济失调。
临床表现:FDA的批准基于II 期MOXIe试验的结果,该试验的主要终点是48周时在无严重高弓足患者(n=82)的完整分析人群中与安慰剂相比 mFARS 评分从基线的变化。在第48周时,与安慰剂相比,Omaveloxolone治疗组具有统计学意义的较低 mFARS 评分(损伤较小),治疗差异为–2.4分。omaveloxolone常见副作用包括丙氨酸转氨酶和天冬氨酸转氨酶升高、头痛、恶心、腹痛、疲劳、腹泻和肌肉骨骼疼痛[2]。
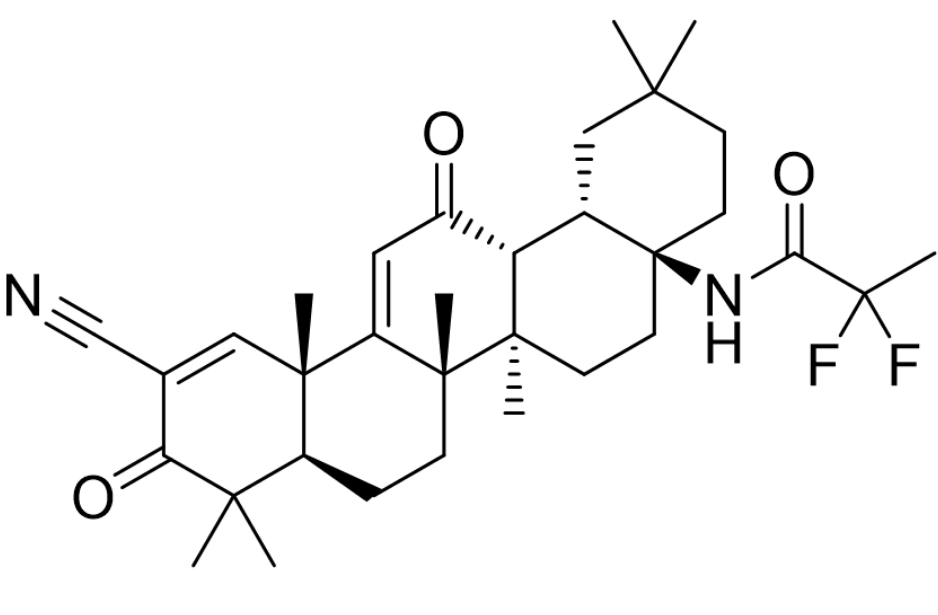
图1. NRF2激活剂Omaveloxolone的分子结构。
3/9/2023: Zavzpret (zavegepant)基本信息:Zavegepant是Pfizer研发的CGRP(降钙素基因相关肽)受体拮抗剂,适用于成人有或无先兆偏头痛的急性治疗。Zavegepant是第三代高亲和力、选择性和结构独特的小分子CGRP受体拮抗剂,也是临床开发中唯一具有鼻内和口服制剂的CGRP受体拮抗剂。在偏头痛发作时三叉神经血管激活过程中CGRP的浓度明显上升。美国有近4000万人患有偏头痛,世界卫生组织将偏头痛列为全球第二大致残原因。偏头痛的特征是持续4-72小时的虚弱发作并伴有多种症状,包括中度至重度疼痛强度的搏动性头痛,通常伴有恶心或呕吐,对声音敏感(畏声)和对光敏感(畏光)。CGRP受体是偏头痛最热的靶点之一,此前已经有4款CGRP单抗(只需要最多每月一次注射给药)和3款小分子CGRP受体拮抗剂上市。此前上市的小分子分别是Abbvie的ubrogepant和atogepant(都是2019年6月Abbvie以630亿美元收购Allergan所得,而Allergan的这两款药都是从默沙东购买),还有Biohaven的rimegepant(由BMS研发,后授权给Biohaven)。Ubrogepant和rimegepant都是用于治疗急性成人偏头痛,atogepant则是用作预防性治疗。Ubrogepant和atogepant原本是默沙东研发的,但默沙东临床在研药物telcagepant在2011年由于发现严重肝毒性而停止研发,最终把另外两款在研CGRP受体拮抗剂打包卖给了Allergan。BMS的rimegepant是telcagepant的me-too药物,但克服了肝毒性的问题。2021年,Pfizer与Biohaven公司就rimegepant和zavegepant达成协议,获得除美国外的全球商业化权利,交易总额达12.4亿美元(首付款5亿美元)。2022年,Pfizer以116亿美元收购Biohaven。
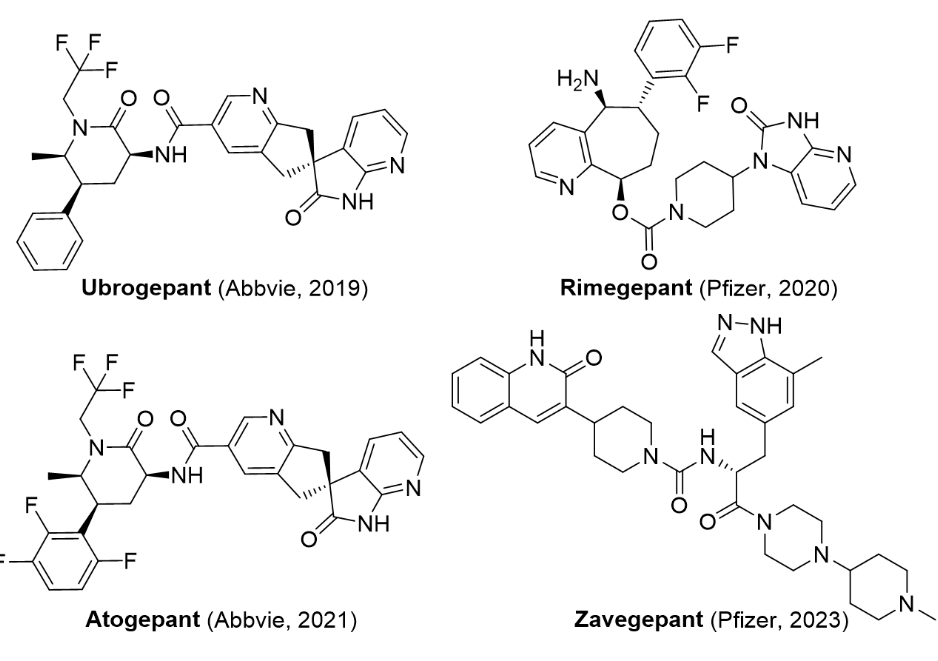
图2. FDA批准上市的四款小分子CGRP受体拮抗剂。
临床表现:FDA的批准基于基于两项关键的随机、双盲、安慰剂对照研究,确定了Zavegepant用于急性偏头痛治疗的疗效、耐受性和安全性。在17项预先指定的次要结果测量中的13项中,包括早期时间点终点(如15分钟和30分钟的疼痛缓解以及在30分钟时恢复正常功能),Zavegepant在统计学上显著优于安慰剂[3]。3/10/2023: Daybue (trofinetide)基本信息:Trofinetide是由Acadia Pharmaceuticals公司(与澳洲Neuren Pharmaceuticals合作)开发的第一个用于治疗2岁及以上的Rett综合征患者的药物(口服溶液)。Rett综合征是一种复杂、罕见的神经发育障碍,通常由MECP2基因的基因突变引起,该基因的缺陷已被证明会导致突触通讯受损。Rett综合征的特点是在6-18个月之前有一段正常发育期,随后出现显著的发育倒退,具体表现为失去获得的沟通技巧和有目的地用手,其它症状还可能包括出现手部刻板行为(如拧手和拍手)以及步态异常。Rett综合症在美国的确诊人数约为4,500。Trofinetide是IGF-1(胰岛素样生长因子1)的氨基末端三肽(甘氨酸-脯氨酸-谷氨酸,GPE)的合成类似物(脯氨酸上多了一个甲基取代)。Trofinetide对Rett综合征患者发挥治疗作用的机制尚不清楚。在动物研究中,trofinetide已被证明可以增加树突的分支和突触可塑性信号。
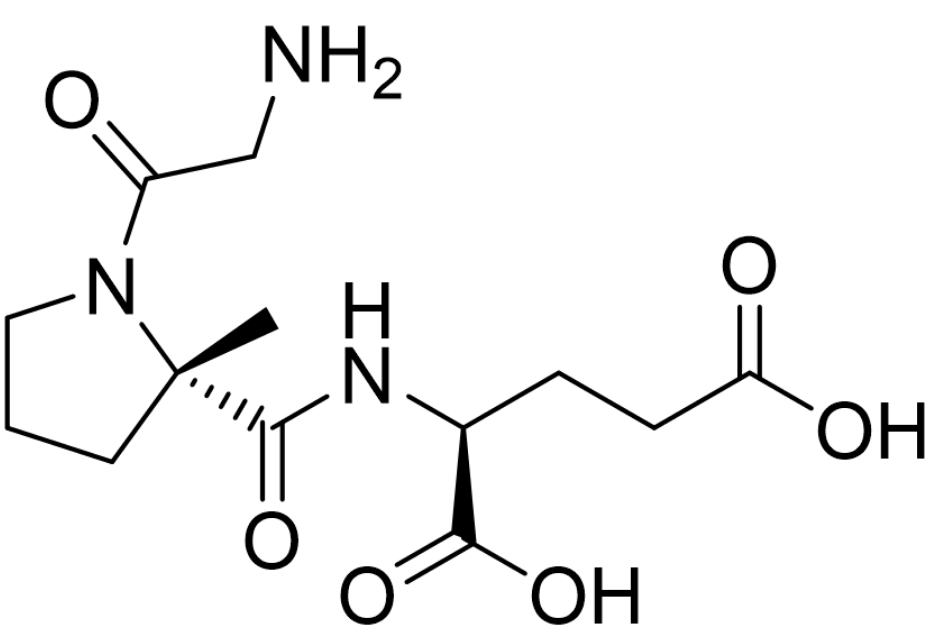
临床表现:FDA的批准基于trofinetide在两个主要疗效终点:Rett 综合症行为问卷 (RSBQ) 总分和临床总体印象-第12周时的改善 (CGI-I) 量表得分,与安慰剂相比具有统计学意义的显著改善。最常见的副作用是腹泻(82%)和呕吐(29%)[4]。3/22/2023: Zynyz (retifanlimab-dlwr)基本信息:Zynyz是由Incyte(从MacroGenics公司获得全球权益)开发的PD-1单抗,用于治疗患有转移性或复发性局部晚期 Merkel细胞癌(MCC)的成年患者。MCC 是一种罕见的侵袭性皮肤癌,经常表现为头部、颈部和手臂暴露于阳光下的单个无痛红紫色皮肤结节。MCC往往发展迅速并且具有高转移率,导致预后不良。出现远处转移性疾病的MCC患者的五年总生存 (OS) 率约为14% 。MCC的发病率不到十万分之一,患者年龄一般65岁以上。临床表现:FDA的批准基于POD1UM-201试验的数据,该试验是一项开放标签、多区域、单臂研究,评估zynyz在患有转移性或复发性局部晚期 MCC 且未接受过晚期疾病全身治疗的成人中的疗效。在未接受过化疗的患者 (n=65) 中,zynyz单药治疗的客观缓解率 (ORR) 为52%[5]。3/22/2023: Rezzayo (rezafungin)基本信息:Rezafungin是由Cidara Therapeutics开发的每周一次的棘白菌素(注射),用于治疗成人念珠菌血症和侵袭性念珠菌病。Rezafungin通过抑制(1→3)-β-D-葡聚糖合酶从而扰乱真菌细胞壁的完整性来发挥作用。
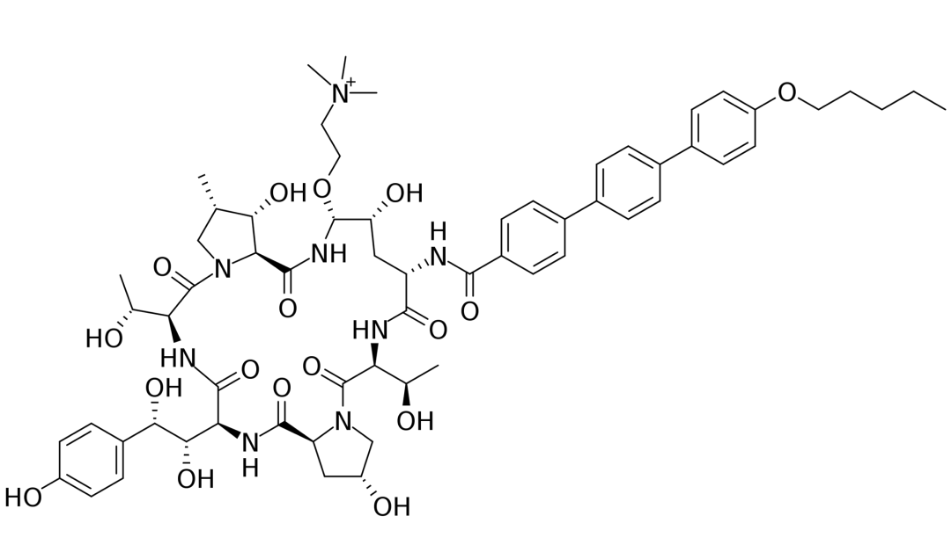
图1. Rezafungin的分子结构。图片来源:wikipedia临床表现:FDA的批准基于全球 ReSTORE 3 期试验的临床数据。在临床研究中,每周给药一次的Rezafungin达到了FDA和EMA的主要终点,证明与caspofungin(目前每天一次的护理标准,第一个上市的棘白菌素类药物)相比具有统计学上的非劣效性。此外,在接受Rezafungin和caspofungin治疗的患者中,不良事件和严重不良事件的总体发生率相当,而导致研究药物停药的不良事件发生率也相似[2]。3/24/2023: Joenja (leniolisib)基本信息:Leniolisib是由Pharming(从诺华获得许可)开发的口服PI3K-δ(活化磷酸肌醇3-激酶-δ)激酶抑制剂,用于治疗12岁及以上患者的PI3K-δ综合征 (APDS)。Leniolisib通过阻断 PI3K-δ的活性结合位点来抑制PI3K-delta。在酶活测定中,leniolisib对PI3K-delta的选择性高于PI3K-alpha(28 倍)、PI3K-beta(43 倍)和PI3K-gamma(257 倍),以及其它的激酶组。在细胞测定中,leniolisib降低了pAKT通路活性并抑制了B细胞和T细胞亚群的增殖和激活。Leniolisib是首个获批用于治疗 APDS 患者的疗法,APDS是一种罕见的原发性免疫缺陷病,由PIK3CD或 PIK3R1 基因(编码PI3K-δ蛋白)中的遗传变异引起,每百万人中有1-2 人患病。APDS患者会出现反复感染,尤其是鼻窦、耳朵和呼吸道。他们还会出现淋巴结、扁桃体和其他器官肿大,这些器官会导致气道和胃肠道阻塞。APDS患者更容易患上淋巴瘤等血细胞癌。PI3K在癌症和免疫失调中过度激活,在过去二十年一直是药物开发的热门靶点,但最近两年遭遇了退市风波。PI3K抑制剂的适应症以癌症(尤其是淋巴瘤)为主。2014年首个PI3Kδ抑制剂(from Gilead)idelalisib上市。2017年批准了Bayer的pan PI3K抑制剂copanlisib。但是,由于pan PI3K 和双重 PI3Kα/PI3Kδ 抑制剂缺乏临床益处且耐受性差(基本都有FDA黑框警告,包括肝毒性和感染相关的副作用),这些药物的进一步临床开发已停止[3]。2022年1月,Gilead撤回了idelalisib治疗FL和SLL的适应症。2022年6月,TG Therapeutics撤回了已上市的umbrlisib。
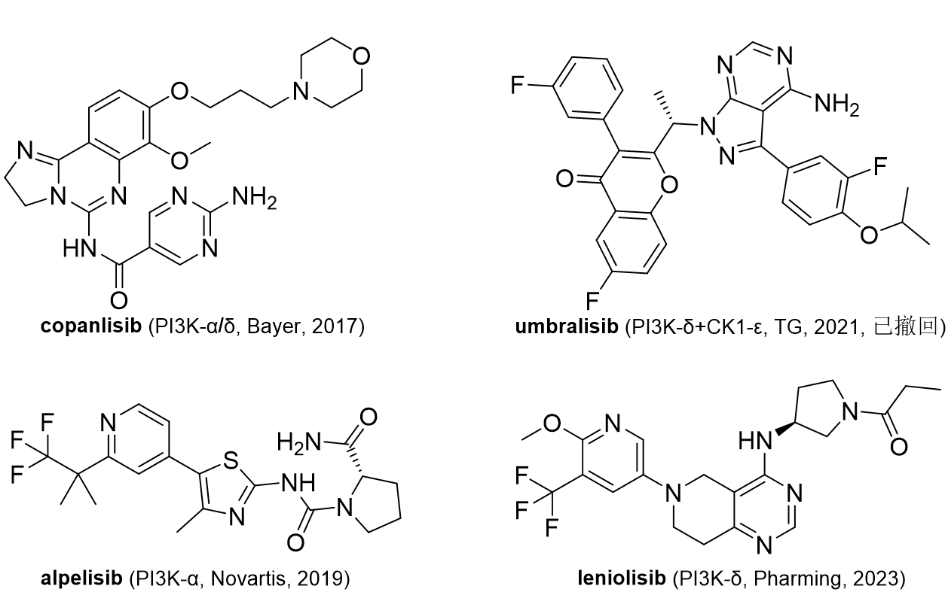
图2. 部分获批上市的PI3K抑制剂。
临床表现:FDA的批准基于一项为期12 周的双盲、随机、安慰剂对照研究,纳入了31名 12岁及以上APDS患者。21名患者接受了70 mg的leniolisib,10 名患者接受了安慰剂,每天两次,持续12 周。主要疗效终点是淋巴细胞增殖的改善(或淋巴结大小的减少)和免疫表型的正常化,通过幼稚 B 细胞占总 B 细胞的百分比来衡量的。到研究的第 85 天,与安慰剂相比,服用 leniolisib的患者淋巴结大小减少,幼稚 B 细胞计数增加37%,这表明潜在的免疫缺陷得到了纠正。Leniolisib最常见的副作用是头痛、鼻窦炎和特应性皮炎[4]。
参考文献:
[1] https://www.fda.gov/drugs/new-drugs-fda-cders-new-molecular-entities-and-new-therapeutic-biological-products/novel-drug-approvals-2023
[2] https://www.cidara.com/news/cidara-therapeutics-and-melinta-therapeutics-announce-fda-approval-of-rezzayo-rezafungin-for-injection-for-the-treatment-of-candidemia-and-invasive-candidiasis/
[3] https://www.nature.com/articles/s41573-021-00209-1










