关于CFT8919
CFT8919 是一种具有口服生物利用度的变构 BiDAC™ 降解剂,对携带EGFR L858R 突变具有良好的活性和选择性,通过与L858R突变的变构位点结合,展示出非常出色的选择性;同时,CFT8919对像T790M或C797S突变的EGFR继发耐药突变有效。
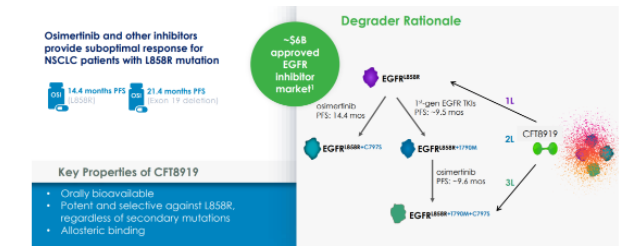
此外,CFT8919不仅对携带L858R单突变,且对奥希替尼、厄洛替尼耐药后产生的L858R继发耐药突变,均具有很好细胞增殖抑制活性,同时展示出良好的EGFR野生型选择性。
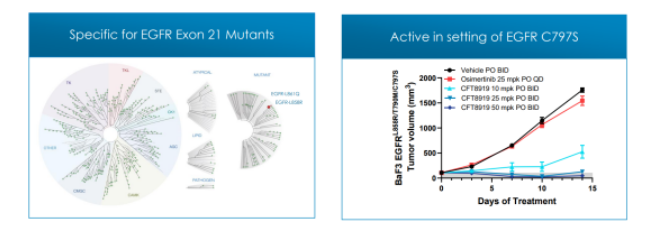
临床前研究显示,CFT8919在EGFR L858R驱动的NSCLC的体内外模型中具有活性,可靶向广泛的在靶耐药突变并有颅内活性,具有预防或治疗患者脑转移的潜力。
关于C4T
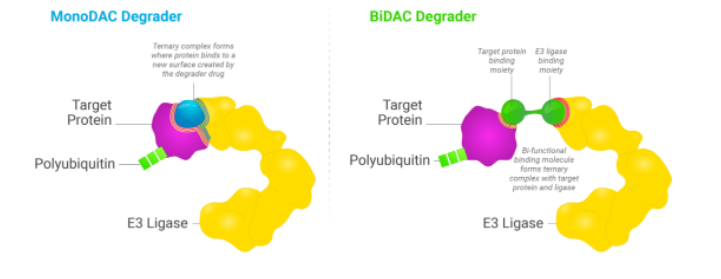
C4T创立于2015年,聚焦蛋白质降解剂研发领域,专注于利用人体对蛋白质水平的自然调节过程来开发新的治疗候选药物,用于治疗癌症、神经退行性疾病以及其他疾病。利用其核心技术平台TORPEDO 平台,开发了两种类型的蛋白质降解剂,分别是分子胶(MonoDAC)和PROTAC(BiDAC)。
Part.1
TORPEDO

Part.2
aTAG开源计划
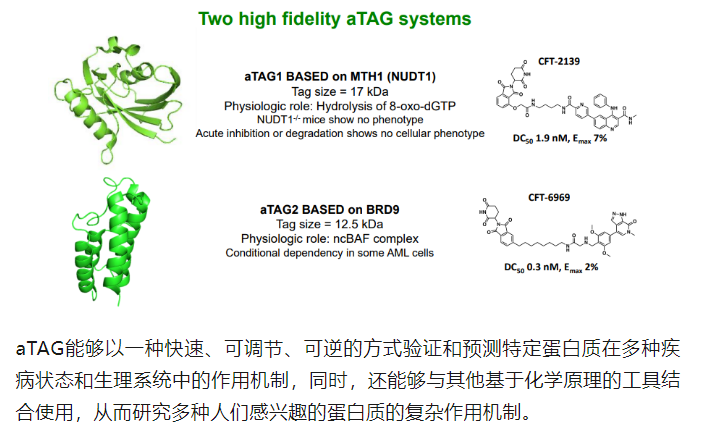
除了开创TORPEDO,C4T还创立了aTAG开源计划供众多研究人员使用,鼓励他们进行蛋白质降解剂领域的技术创新。aTAG全称为Achille’s TAG,是一种能够预测目标蛋白降解结果的系统工具,能够在体外和体内环境中剖析降解剂对目标蛋白质产生的生物学机制以及表型结果。
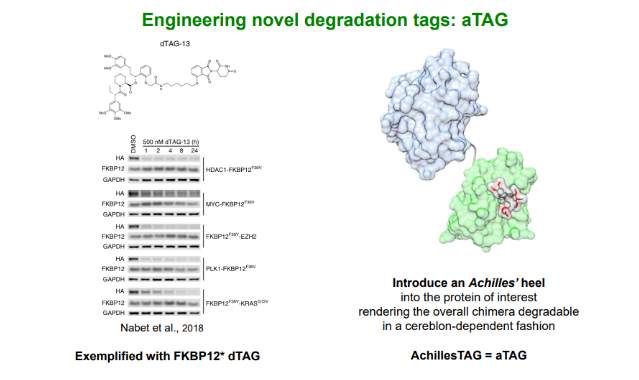
aTAG系统主要分为两部分,一部分是很容易与目标蛋白结合的小蛋白质结构域,以MTH1蛋白质为基础,呈现出结构紧凑、易于配体等优势;另一部分是三种经过精密筛选的BiDAC降解剂,具有出色的靶标结合能力和有效的药代动力学特性,能够选择性地靶向基于MTH1蛋白的降解标签。基于这一系统,研究人员能够使用自己感兴趣的蛋白质与aTAG融合,并用相应的降解剂对其进行降解,从而分析相关蛋白质在被降解后对其细胞机体的影响。
Part.3
公司管线及主要产品介绍
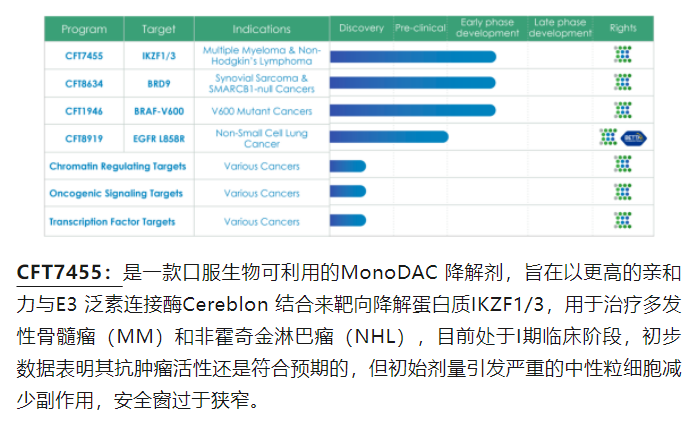
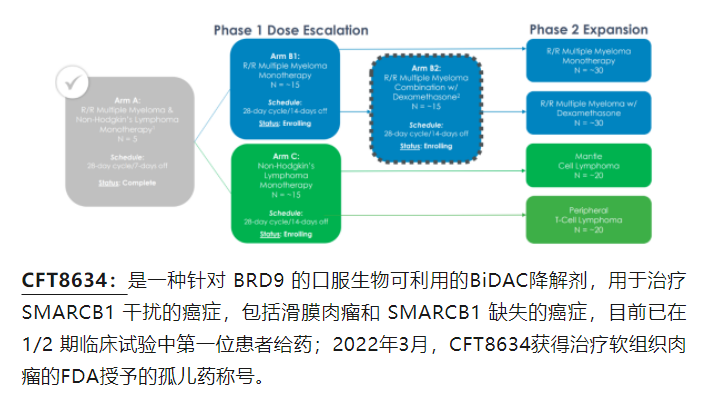
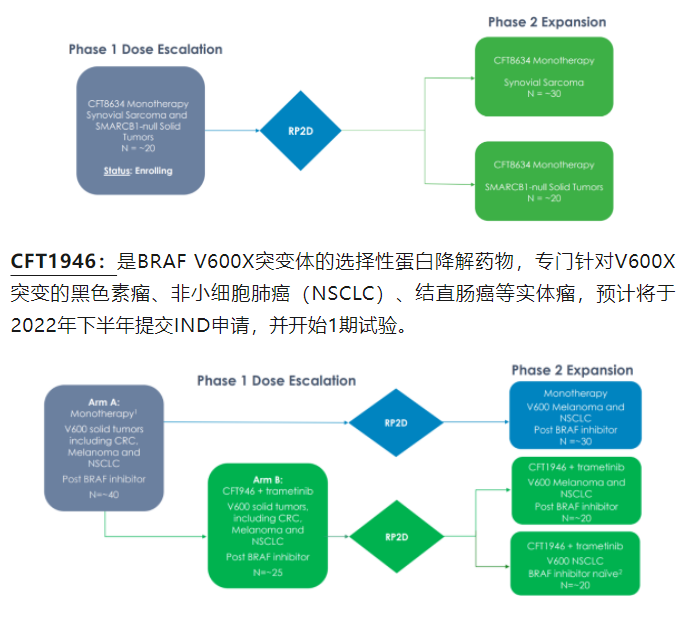
关于贝达药业

里程碑事件 ✦
2016年11月
贝达药业在深圳证券交易所挂牌上市,股票代码:300558.SZ。
2011年6月
公司自主研发了中国第一个小分子靶向抗癌药——盐酸埃克替尼(商品名:凯美纳®)获批上市。
2020年11月
公司和控股子公司Xcovery共同开发的全新的、拥有完全自主知识产权的创新药——盐酸恩沙替尼胶囊(商品名:贝美纳®)正式获批上市,成为中国第一个用于治疗ALK突变晚期非小细胞肺癌的国产1类新药,填补了同类药物国产空白。
2021年11月 公司与北京天广实生物技术股份有限公司合作开发的贝伐珠单抗注射液(商品名:贝安汀®)正式获批上市,获批适应症为转移性结直肠癌和晚期、转移性或复发性非小细胞肺癌。 2023年5月 2023年5月,NMPA批准甲磺酸贝福替尼胶囊上市,用于既往经EGFR-TKI治疗出现疾病进展,并且伴随EGFR T790M突变阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者的治疗。 ✦ 重点药物介绍 ✦
5、贝福替尼
贝福替尼是第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),能够选择性地抑制EGFR T790M突变。2018年12月,贝达与益方生物达成合作,获得贝福替尼在中国大陆、香港和台湾地区的权益,并可独家在合作区域内进行该产品的开发及商业化。2023年5月,NMPA批准甲磺酸贝福替尼胶囊上市,用于既往经EGFR-TKI治疗出现疾病进展,并且伴随EGFR T790M突变阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者的治疗。该产品是贝达药业第5款获批上市的创新药。
II期IBIO-102临床研究结果已于2022年7月10日发表在国际著名肿瘤学期刊《胸部肿瘤学杂志》上,影响因子20.121。在一项单臂、多中心II期临床试验中,评估贝福替尼在既往一代/二代EGFR-TKI耐药后产生T790M突变的局部晚期或转移性NSCLC患者中疗效和安全性。
结果显示:在ITT人群中,贝福替尼组经IRC评估的ORR为67.6%,DCR为94.8%,中位PFS为16.6个月,中位DOR为18.0个月。研究者评估的中位PFS为12.5个月。34例基线存在颅内靶病灶患者IRC评估的iORR为55.9%,颅内中位PFS目前尚未达到。安全性方面,绝大部分患者可耐受贝福替尼治疗,大多数不良反应为1级或2级,最常见的治疗相关不良事件是血小板减少、贫血、白细胞计数降低、头痛和皮疹等。
2023年5月,上海交通大学附属胸科医院陆舜教授领衔开展的贝福替尼一线临床研究在《柳叶刀·呼吸医学》发布,影响因子高达102.642。在一项多中心、开放、随机、平行对照的Ⅲ期临床研究,对比了贝福替尼和埃克替尼在既往未经治疗的EGFR敏感突变局部晚期或转移性NSCLC患者中的疗效和安全性。结果显示:
截止2022年7月30日,贝福替尼组和埃克替尼组的中位随访时间分别为20.7个月和19.4个月。IRC评估的中位PFS分别为22.1个月(17.9-NE)和13.8个月(12.4-15.2)(HR 0.49; 95%CI 0.36-0.68; P<0.0001)。与埃克替尼相比,贝福替尼将疾病进展或死亡的风险降低了51%。
IRC评估的亚组分析显示,在基线无脑转移的患者中,相比较埃克替尼治疗组,贝福替尼可降低51%的疾病进展或死亡风险(HR 0.49,95%CI 0.34-0.71;P=0.0001)。在基线脑转移患者中,贝福替尼相比较埃克替尼仍可降低52%的疾病进展或死亡风险(HR 0.48;95%CI 0.28-0.84;P=0.0086)。
在安全性上,贝福替尼治疗相关的不良事件(TRAEs)主要为1~2 级,血小板减少是最常见的TRAE。试验过程中未观察到新的安全性信号。
参考资料
1、公司官网
2、动脉网、医药投资部落、医悦汇、医药魔方
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 南京市江宁区科学园乾德路5号