多肽药物一般被定义为由少于40个氨基酸残基通过酰胺键组成的聚合物。由于多肽药物具有很高的受体活性和选择性,较低的毒副作用风险,制药行业对多肽产生了浓厚的兴趣。期间也出现了很多明星药物,他们大多集中在代谢疾病领域,如GLP-1类似物索马鲁肽,胃抑制多肽(GIP)和胰高血糖素样肽-1 (GLP-1)双受体激动剂替西帕肽等。此外,随着PDC,RDC药物的兴起。目前用于制备多肽药物的方法主要有化学合成法和生物发酵法。生物发酵法主要用于长肽的制备,其优势在于生产成本低,但无法在肽序中引入非天然氨基酸,也无法对肽链进行各种修饰,因此它的应用也受到了很大的限制。化学合成法包括固相合成法和液相合成法,其中固相合成法相比液相合成法有其显著的优点:可以使用过量的物料进行反应以确保完全偶联,通过简单的对洗涤操作就可以除去过量的氨基酸,缩合剂,副产物等,避免了复杂的后处理与纯化操作,提高生产效率等,因此固相合成法应用最为广泛。用于化学合成法合成多肽的原料包括起始物料,试剂,溶剂。他们的质量特别是起始物料的质量会对API的质量产生不同的影响。起始物料主要指的是保护的氨基酸衍生物,用于肽链修饰的脂肪酸,聚乙二醇等作为重要的结构片段并入原料药的结构中的物料,直接影响API的质量,因此应重点讨论对起始物料的控制。ICHQ11明确指出如果使用市售的化学品作为起始原料,申请人通常不需要对其合理化进行论证。市售化学品通常除了用作药物的起 始原料外,还已经在非药用市场进行销售。定制合成制备的 化学物质不属于市售化学品。虽然保护氨基酸没有非药用市场以满足ICHQ11对市售化学品的定义,但是他们结构简单,具有明确的化学特性和结构,易被分离和纯化,且能使用常见的分析手段进行鉴别、检测,化学性质稳定,易于储存、运输,合成路线成熟,且目前国内多家大型供应商能够持续生产质量稳定的保护氨基酸,为商业化容易获得的物料,因此他们能够被认定为起始物料。但对于保护氨基酸以外的特殊结构单元,可能需要额外的论证才能把它们定义为起始物料。前面提到保护氨基酸作为重要的结构片段并入到API的结构中,直接影响API的质量,因此我们要严格控制起始物料中杂质的含量,了解这些杂质在既定的工艺中发生的转化与清除,最终明确他们与API中杂质的关系。下面以Fmoc-Ala-OH为例,对保护氨基酸中的几种杂质进行说明:
在合成Fmoc-Ala-OH过程中,如果起始原料中含有D-Ala,按照工艺传递会生成相应的Fmoc-D-Ala-OH 图1。起始物料中一旦出现此类杂质,就会随着工艺一直传递到API中生成对应的单氨基酸消旋肽杂质,由于消旋肽杂质和API的结构极为相似,很难通过后续制备纯化除去,因此应严格控制对应的保护氨基酸中的异构体杂质。此外,对于有多个手性中心的保护氨基酸,如Fmoc-Ile-OH,Fmoc-Thr(tBu)-OH图2,除了需要研究α-C的构型之外,侧链的手性中心也要考虑表1。例如Fmoc-Thr(tBu)-OH,除了研究常规的保护氨基酸中的杂质之外,需要研究的异构体杂质有Fmoc-D-Allo-Thr(tBu)-OH,Fmoc- Allo-Thr(tBu)-OH,Fmoc-D-Thr(tBu)-OH。值得注意的是Fmoc-Thr(tBu)-OH与Fmoc-D-Thr(tBu)-OH,Fmoc-D-Allo-Thr(tBu)-OH与Fmoc- Allo-Thr(tBu)-OH互为对映异构体,使用普通的HPLC方法无法实现分离,可能需要用到手性柱。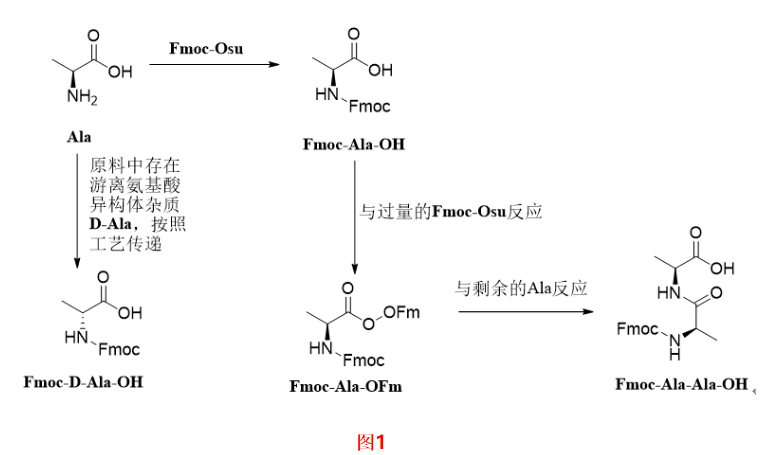
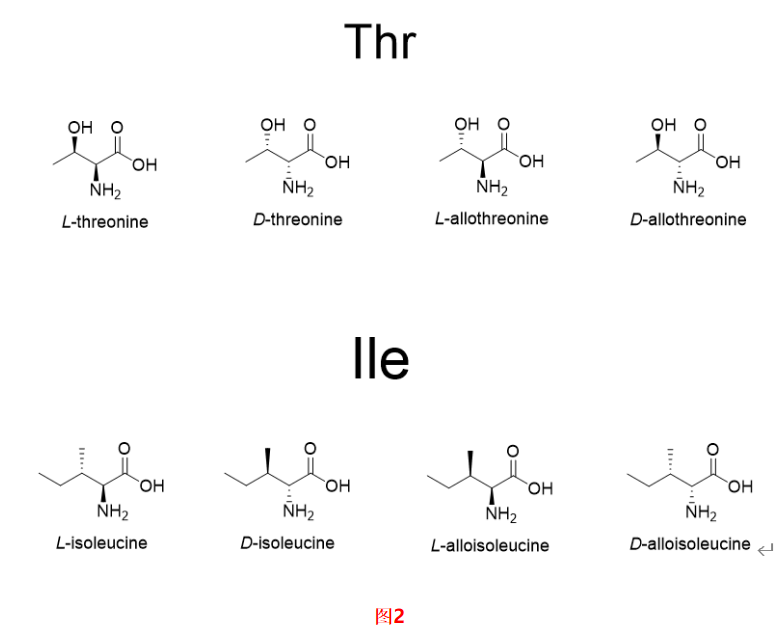
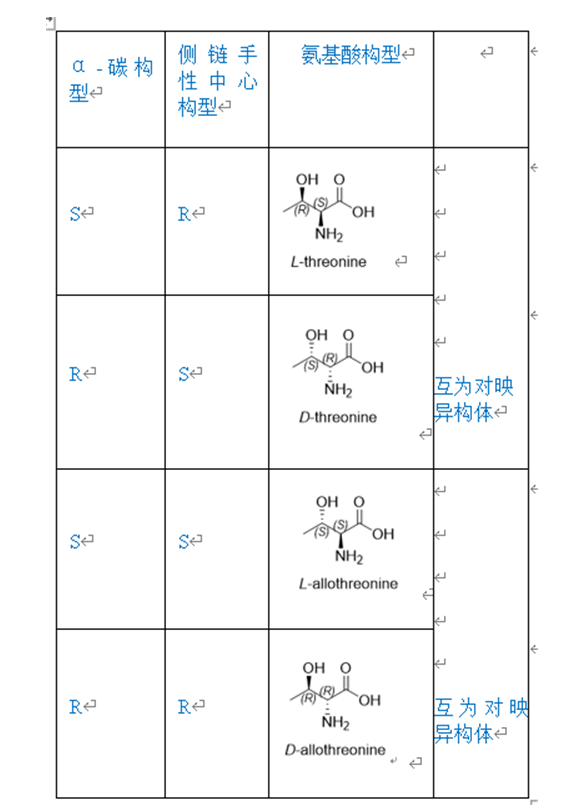
表1
在合成Fmoc-Ala-OH过程中,过量的Fmoc-Osu会与生成的Fmoc-Ala-OH反应得到Fmoc-Ala-OFm,再与剩余的Ala反应得到Fmoc-Ala-Ala-OH图1。此类杂质也会随着工艺一直传递到API中生成相应的插入肽杂质,应当严格控制。
机理见图3,在合成Fmoc-Osu过程中可能会生成β-Ala,β-Ala与过量的Fmoc-Osu反应生成Fmoc-β-Ala-OH。或者β-Ala与Ala、Fmoc-Osu依次反应得到Fmoc-β-Ala-Ala-OH。此类杂质也会随着工艺一直传递到API中生成相应的β-Ala替换肽和插入肽杂质应当严格控制。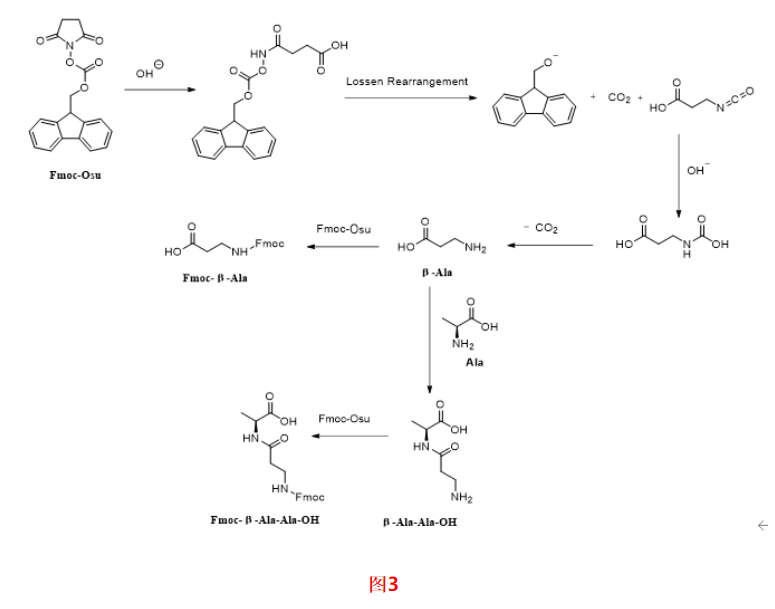
由于没有α-氨基或侧链保护基团,游离氨基酸在活化过程中会生成复杂的多聚杂质,应严格控制。但游离氨基酸没有保护基团,普通色谱柱不易保留且紫外吸收很弱,不适合使用HPLC控制。可以根据中国药典2020年版四部通则0502使用薄层色谱法进行控制。
主要指的是非手性的同分异构体,如Ile和Leu;或氨基酸侧链保护基团错位保护产生的异构体,如Fmoc-Glu(OtBu)-OH和Fmoc-Glu-OtBu,Fmoc-Asp(OtBu)-OH和Fmoc-Asp-OtBu。一般来说,考虑到多肽固相合成的特殊性,每步氨基酸偶联完成及脱保护后都会使用大量溶剂洗涤肽树脂,肽树脂裂解得到的粗肽还会使用HPLC制备,冻干,因此残留在保护氨基酸中的少量溶剂传递到最终API中的风险很小。但这里应特别注意乙酸,乙酸乙酯,醇类溶剂的残留,因为这些溶剂可能在氨基酸活化偶联过程与活化的氨基酸或肽链发生副反应,如残留的乙酸在氨基酸偶联过程中会与肽链上裸露的氨基反应导致肽链封端;残留的醇类溶剂可能在氨基酸活化过程中与活化的羧基反应造成活化的氨基酸被钝化,使氨基酸当量降低,最终可能导致氨基酸偶联不完全,产生缺失肽杂质。以郑源生化某氨基酸为例图4,该公司在COA中控制了乙酸乙酯,乙醇,甲醇,乙酸。其中乙酸乙酯的标准为≤0.5%,实际检出为0.10%。根据ICHQ3C,乙酸乙酯为3类溶剂,设定标准为≤0.5%符合的ICHQ3C要求,但是考虑到乙酸乙酯可能造成氨基乙酰化封端的风险,我们还应对乙酸乙酯进行加标研究,确定一个更加合适的标准。

根据ICHQ3D、USP<232>、USP<233>的要求,应对所有API的元素杂质进行评估。从ICHQ3D中的附图可知,药品中的元素杂质可能来自于API,而起始物料中的元素杂质也有传递到API中的风险。因此,应对起始物料中的元素杂质进行评估与控制,特别是对于那些在生产工艺中使用金属催化剂的起始物料。例如Fmoc-Thr(tBu)-OH的合成过程中需要用到金属钯催化脱除Cbz保护基图5,根据ICHQ3D的要求,金属钯属于2B类元素杂质,若在工艺中有意添加,无论何种给药途径都需要研究。
TSE(Transmissible Spongiform Encephalopathy)是一种可引起人和动物脑部病变的疾病,包括克雅氏症(Creutzfeldt-Jakob Disease (CJD)),变异克雅氏症(variant Creutzfeldt-Jakob Disease (vCJD)),人体库鲁病(Kuru in humans),疯牛病(Bovine Spongiform Encephalopathy (BSE) in cattle),羊痒病(Scrapie in small ruminants (sheep and goats)),鹿慢性消耗病(Chronic Wasting Disease (CWD) in cervids),以及貂慢性传染性脑病(Transmissible Mink Encephalopathy (TME) in minks)等。许多国家的现行法规要求必须对所有获得许可的药品进行含有传染性海绵状脑病的潜在风险评估,包括欧盟法规EMA/410/01 《降低人及兽药中的TSE风险指南》和EC No 999/2001 《制定预防、控制和消除某些TSE的规则》,FDA 21CFR 189.5《禁用的牛材料》,我国TSE污染风险小,目前无相关法规。用于合成保护氨基酸的游离氨基酸可能来自于动物组织毛发水解,存在TES风险,因此必须确认供应商提供的保护氨基酸的来源,评估TES风险。当然,更简便的方式就是直接购买非动物源的氨基酸,同时需要供应商提供一份TSE/BSE声明,声明内容应包括“XXX有限公司在此证明,我们生产的XXX产品符合以下要求:无动物源性成分;没有来自或接触到受影响的、或接受隔离的传播动物海绵状脑病/牛海绵状脑病的动物材料。我们的生产设备中没有使用动物或动物制品或动物副产品或兽用疫苗或动物病原体。”虽然目前没有法规要求起始物料需要在GMP条件下生产,但为了保证供应商能够提供质量合格且稳定的起始物料,建议供应商至少在“类GMP”的条件下生产,可以通过供应商进行审计来考察是否有良好的质量体系,生产文件体系和适当的控制来保证生产工艺稳定且可靠,是否有资质和能力保证起始物料的质量,长期稳定的供货。为了降低风险,还应与供应商签订质量协议,要求其供应的起始物料的生产工艺如果发生变更,必须提前通知我方,并且在获得我方批准后才能实施变更。为了进一步降低断货的风险,除了选定一家起始物料的主供应商之外,还建议选定至少一家辅供应商。供应商应提供相应的资质证明文件,包括营业执照、生产许可证、工艺路线、质量标准和COA。




