
工程化免疫细胞疗法,是一种将免疫细胞加以改造,让它们就能够识别疾病状态并做出适当反应。当工程化的免疫细胞被转输到患者体内时,它们就是一种“活着的药物”。基于工程化免疫细胞的疗法,如今已经进入临床应用,多种工程化T细胞疗法已被批准用于血液恶性肿瘤的治疗。正在进行的临床前和临床研究正在测试各种新的策略,通过改变免疫细胞的命运和功能,可用于治疗癌症、传染病和其他的多种疾病。
目前全球TOP
20药企均已布局细胞基因疗法,例如由诺华研发的Kymriah是一款慢病毒体外基因治疗药物,是全球首款获批上市的CAR-T疗法,靶向CD19,采用了4-1BB的共刺激因子。吉利德公司也先后上市了两款细胞治疗药物,分别是用于治疗复发或难治性大B细胞淋巴瘤的Yescarta,以及用于治疗复发或难治性套细胞淋巴瘤Tecartus。百时美施贵宝和蓝鸟生物共同开发用于治疗复发或难治性多发性骨髓瘤的Abecma是全球首款靶向BCMA的CAR-T细胞疗法,是FDA批准的第五款CAR-T疗法。辉瑞、礼来等其他医药巨头也都有相应的药物上市,就此也足矣看出细胞治疗的潜力。
截至2022年,全球肿瘤免疫在研管线中有2756种处于活跃研发中的细胞治疗产品,在不同细胞治疗类别中,CAR-T细胞疗法仍是管线最多的种类。2022年共有1432个CAR-T在研管线,同比增长24%。基于NK细胞的疗法数量达到283个,同比增长55%。各种非T细胞或NK细胞的其他细胞疗法,如树突状细胞、干细胞或骨髓细胞等,2022年增长了129%,达到422种。
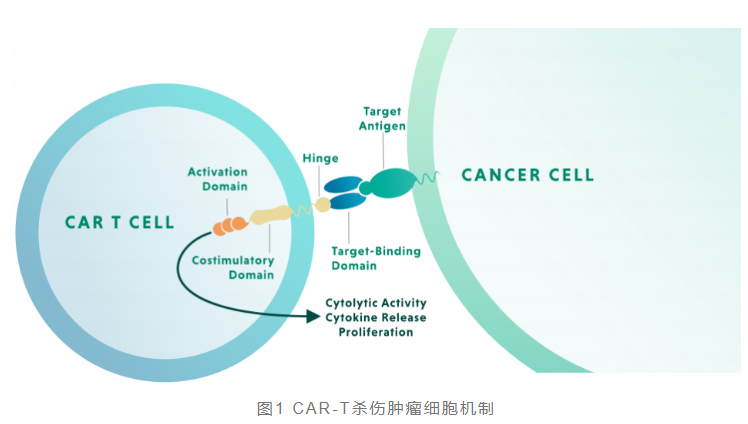
CAR-T通过基因工程手段修饰人的T细胞,将识别肿瘤相关抗原(TAA)的单链抗体(scFv)、跨膜的共刺激结构域(如CD28和CD4-1BB)和T细胞的活化基序(如CD3复合物(ζ链)胞内结构域)结合为一体,通过基因转导方法转染T淋巴细胞。经基因修饰的T细胞通过表达单链抗体增强结合肿瘤细胞的能力,同时通过共刺激信号和活化基序的表达,激活T细胞的增殖和细胞毒活性。随后将构建好的CAR-T细胞回输到患者体内,从而进行肿瘤细胞的免疫杀伤。
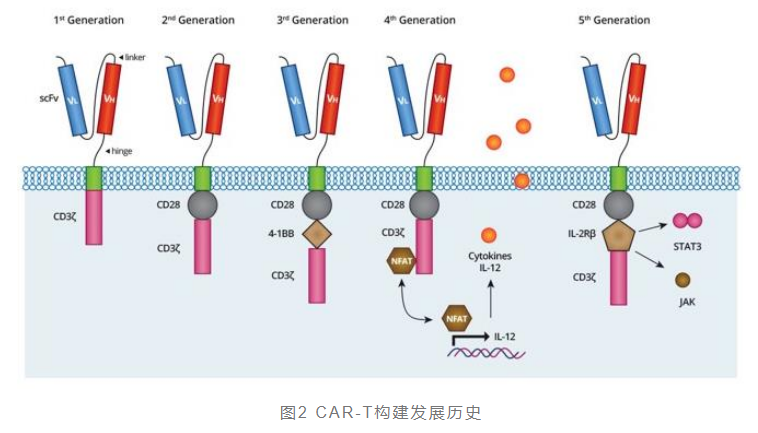
1989年,以色列科学家Prof. Zelig Eshhar首次提出了嵌合抗原受体即CAR的概念,并与Dr. Rosenberg实验室合作,成功构建了3个不同癌症标靶的嵌合抗原受体,诞生了第一代CAR-T。
然而第一代CAR-T面临着抗体和共刺激信号(CD28-B7)的问题。CAR-T细胞在无法获得共刺激信号的情况下,无法有效的在体内自我增殖,从而难以持久发挥其肿瘤杀伤作用。2003年,第二代CAR-T在嵌合抗原受体上创建了共刺激结构域,一种基于CD28,另一种则基于CD137
(4-1BB)。CD28在激活CAR-T细胞杀伤活性上优于CD137,而CD137在持久性上则强于CD28。2012年,宾夕法尼亚州科学家Dr.
CARl June使用第二代CD19
CAR-T细胞治愈7岁的急性淋巴白血病女孩儿Emily。Emily成为首个通过细胞免疫疗法治愈的白血病儿童患者,用于治疗Emily的二代CAR则是使用CD137的共刺激信号。
2017年,FDA批准CAR-T细胞治疗药物Kymriah和Yescarta上市,标志着人类正式进入CAR-T细胞治疗的新时代。
2021年中国第一款国产CAR-T药物复星凯特的阿基伦赛注射液获批上市,标志着中国CAR-T细胞治疗元年。三个月后药明巨诺研发的瑞基奥仑赛注射液也相继获批上市。
CAR-T研发进入了第五代,但第二代CAR-T凭借较多的临床数据支持,稳定性高且工艺较为成熟,目前全球获批的CAR-T细胞治疗药物都是基于第二代CAR-T技术。第三、四、五代CAR-T技术仍处于研发阶段,还需在科研、临床和转化等方面投入更多的努力。
CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。作为全球首个针对Claudin18.2的CAR-T细胞疗法,科济药业的CT041截至2021年4月8日总体ORR为48.6%,后线治疗胃癌ORR可达61.1%,CT041此次在后线胃癌患者中取得的疗效远远优于标准疗法,在2022年ASCO大会上,CT041的两项研究成果同样振奋人心,后线治疗胰腺癌ORR为33.3%,DCR为80%;2023年美国癌症研究协会(AACR)年会上,西比曼生物科技公司的自体靶向GPC3 CAR-T细胞(编号:C-CAR031)治疗晚期肝细胞癌患者的首次人体研究受到广泛关注,此次入组患者均为经组织学证实的全身治疗失败的GPC3阳性的晚期HCC患者,在多例晚期肝细胞癌的探索剂量组中3例受试者达到了确认的部分缓解(PR)、2例受试者达到了疾病稳定;斯丹赛GCC19 CART获得FDA批准的治疗对常规疗法无效的复发或难治转移性结直肠癌的快速通道资格,ORR可达50%,3个月内疾病控制率(DCR)为100%。
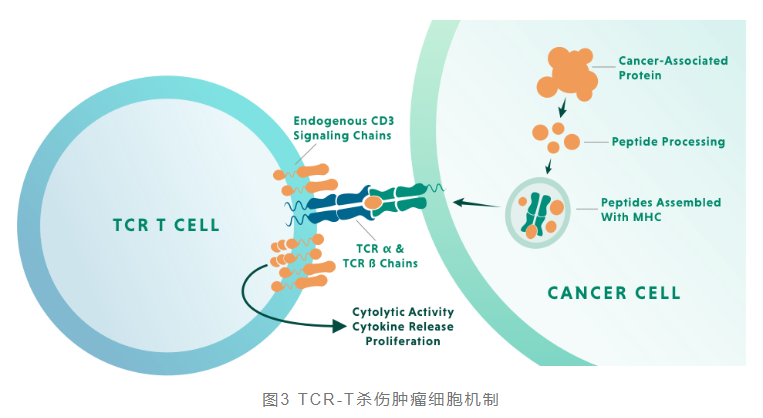
TCR-T工程化改造首先需鉴定出一种或多种肿瘤抗原作为治疗靶点,获得特异识别肿瘤抗原的TCR序列;然后采用基因工程技术,将编码抗原特异的TCR基因序列导入患者自身T细胞中,从而获得特异识别肿瘤抗原的TCR-T细胞。将改造后的TCR-T细胞通过体外培养进行大量扩增之后,回输到患者体内以杀死肿瘤细胞。
TCR-T行业发展经历了1999-2005年的探索期和从2006年开始发展期。最早的TCR-T疗法研究报道是1999年Clay等在研究黑色素瘤的治疗方法时,发现TCR基因转导至患者外周血淋巴细胞后,可在体外产生具有肿瘤反应性的细胞毒性T淋巴。此后,TCR-T技术在发展过程中经历了四次迭代:
第一代TCR-T是从患者T细胞中分离出肿瘤抗原特异性识别的T细胞亚群,经体外扩增后回输治疗。由于这种T细胞克隆数量极少,个体差异很大,因此很难产业化。
第二代TCR-T是通过克隆上述肿瘤抗原特异性识别的T细胞,获取其TCR基因序列,再转导至患者的外周T细胞上,这种方法使得TCR-T产业化成为可能。
第三代TCR-T是通过优化TCR的亲和力,使其能够更好地识别肿瘤抗原,再将其转导至患者T细胞上,整体提高TCR-T的成药性。
第四代TCR-T是靶向肿瘤新抗原的高特异性细胞疗法,肿瘤应答和安全性大幅提高,但由于个体突变差异,治疗可及性还有待进一步研究。
2022年1月25日,FDA批准Kimmtrak(tebentafusp-tebn,IMCgp100)用于HLA-A*02:01 阳性的无法切除或转移性葡萄膜黑色素瘤成人患者。这是一种双特异性gp100 肽-HLA导向的CD3-T细胞接合剂,成为全球首个上市的TCR-T药物。
2021年12月24日,FDA授予来恩生物医药有限公司(Lion TCR)研发的LioCyx-M004快速通道指定,这是一种T细胞受体T细胞疗法,用于治疗乙肝病毒相关的成人肝细胞癌(HCC),在接受治疗的患者中没有出现细胞因子释放综合征(CRS),也没有神经毒性的迹象,疾病控制率为60%,缓解持续时间为27.7个月,患者的中位OS为33.1个月。
2022年3月10日,星汉德生物的SCG101自体T细胞注射液获得临床试验默示许可,用于治疗乙型肝炎病毒(HBV)相关的肝细胞癌(HCC),2022年6月23日,在伦敦举行的国际肝病大会(ILC) 2022年会上,星汉德生物公司首次公布了其靶向乙肝病毒表面抗原(HBsAg)的TCR-T疗法SCG101的临床试验中期数据,在3例HLA-A*02:01阳性的晚期乙肝病毒相关性肝细胞癌患者中,三分之二的观察到病灶缩小的患者的肿瘤生长得到控制,疾病控制率可达66%。
香雪生命科学自主研发的第一个TCR-T细胞药物TAEST16001,适应症为软组织肉瘤,Ⅰ期临床研究肿瘤客观缓解率(ORR)达到41.7%,已进入临床Ⅱ期,第二个产品TAEST1901,已获得IND许可,适应症为原发性肝癌。
2023年5月,恒瑞源正自主研发的ReGET平台转化的首个TCR-T产品HRYZ-T101获得CDE的IND批件,该产品是全球首个中国人群高频HLA的TCR-T产品,拥有中美专利授权及广泛的PCT覆盖,具有全新的TCR序列,于治疗人乳头瘤病毒18亚型阳性 (HPV18+)的实体瘤。
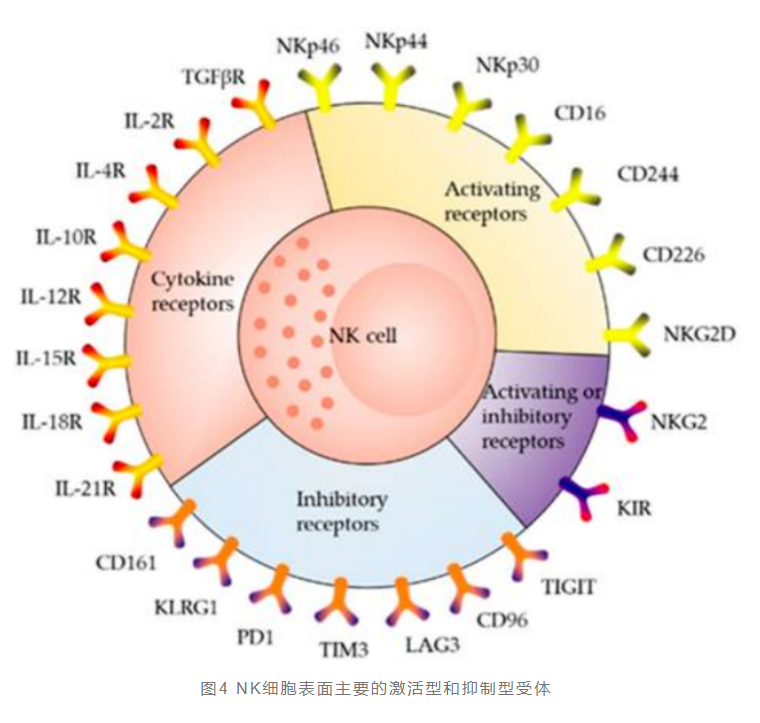
NK细胞可表达多种膜蛋白,其中CD56(介导同型粘附的粘附分子)和CD16(一种低亲和力Fc受体FcyRIIIA,与NK细胞介导的ADCC效应有关)是NK细胞的表面标志物。根据表面蛋白CD56和CD16的相对表达水平,NK细胞通常被分类为:CD56 bright CD16 low/-(免疫调节、细胞因子产生)和CD56 dim CD16+(细胞毒性)。NK细胞的表面受体主要分为两类:激活型受体和抑制性受体。两类受体均能识别正常细胞上经典或非经典的人MHC-I类分子。其中MHC-I类分子与抑制性受体的结合是细胞向NK细胞释放“Do not eat me”的信号,即逃避NK细胞的杀伤作用。
工程化改造的NK细胞主要是为了增强NK细胞靶向杀伤肿瘤的活性与持久性。当下CAR-NK逐渐兴起,原代NK细胞、NK细胞系可以直接“加装”CAR,对于iPSC/HSC-NK细胞而言,其技术路径可以分为两种:(1)先“加装”CAR,再定向分化为可以表达CAR的NK细胞;(2)先定向分化为NK细胞,再改造“加装”CAR。
CAR-NK在一定程度上借鉴和传承了CAR-T的基本结构框架和转导方式。据弗若斯特沙利文《中国细胞治疗产业发展白皮书》显示,CAR结构目前已开发至第四代,第四代也称为装甲CAR,包含分子有效载荷,赋予CAR工程细胞额外的特性和功能。
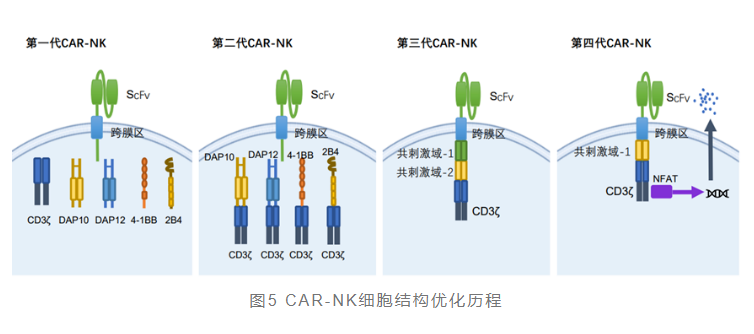
CAR-NK疗法的研究目前处于起步阶段,临床前和临床研究的数量逐年增加。2021年11月11日,国健呈诺生物科技有限公司研发的针对“靶向间皮素嵌合抗原受体NK细胞注射液”临床申请获批,适应症为晚期上皮性卵巢癌,这也是国内首个获批临床的“现货型”异体来源的CAR-NK产品。2023年1月19日,苏州迈德通医药科技有限公司(下称“迈德通医药”)的“PB103异体自然杀伤(NK)细胞制剂”三项临床申请获得受理。2023年1月31日,英百瑞IBR854细胞注射液获得国家药监局临床试验默示许可,为国内首个针对实体肿瘤的非基因修饰方法的CAR-raNK细胞疗法。2023年5月6日,国家药品审评中心(CDE)受理了启函生物的同种异体CD19 CAR-NK的IND申请。
截至2022年1 2月,全球在研的CAR-NK细胞疗法进展最快的已进入临床Ⅱ期研究,共有11个,临床Ⅰ期研究的疗法有23个,临床前和药物发现阶段的疗法共有81个。我国在研的CAR-NK细胞疗法中,已有18个进入临床研究中,其中临床Ⅱ期6个,临床Ⅰ期12个。
Fate Therapeutics、Nakarta、NansKwest等公司是CAR-NK领域最早一批“弄潮儿”。Fate是一家利用克隆工程诱导多功能干细胞iPSC系开发“现货型”细胞免疫疗法的生物技术公司,拥有多款CAR-NK候选产品,包括FT500、FT516、FT596等。公司专利的iPSC平台不但可生产具有无限扩增及分化潜力的CAR-NK细胞,而且有望大幅降低NK细胞的生产成本。公司的一项生产周期为44天、规模300剂(FT500)的GMP生产数据显示,每剂CAR-NK的成本约3000美元,出厂价为2-3万美元,较CAR-T细胞疗法近40万美元的费用大幅降低。Fate Therapeutics公布了旗下拳头产品FT596和FT516的最新临床进展,14名血液瘤受试者接受剂量超过9000万细胞单剂FT596或单剂FT596联用利妥昔单抗的治疗,结果显示,ORR达71.43%(10/14),CR达50%(7/14)。其中,完全缓解包括两名先前接受过CD19 CAR-T治疗的患者,方案为FT596联用利妥昔单抗(CD20 mAb)。安全性方面,未发现DLT、ICANS和GvHD,但出现两例低级别CRS。从ORR的角度,FT596的应答率有限,且应答持续时间较短。
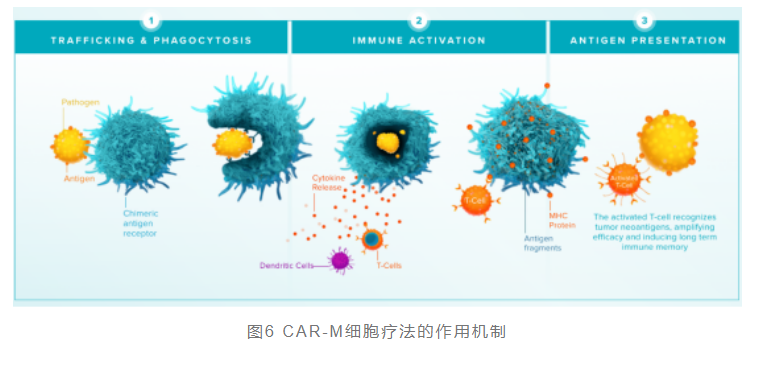
CAR-M是指将经过编辑的特定CAR基因植入巨噬细胞,以装备巨噬细胞能够通过特异性抗原与肿瘤细胞表面结合并随后激活巨噬细胞的活性,进而实现肿瘤杀伤功能。
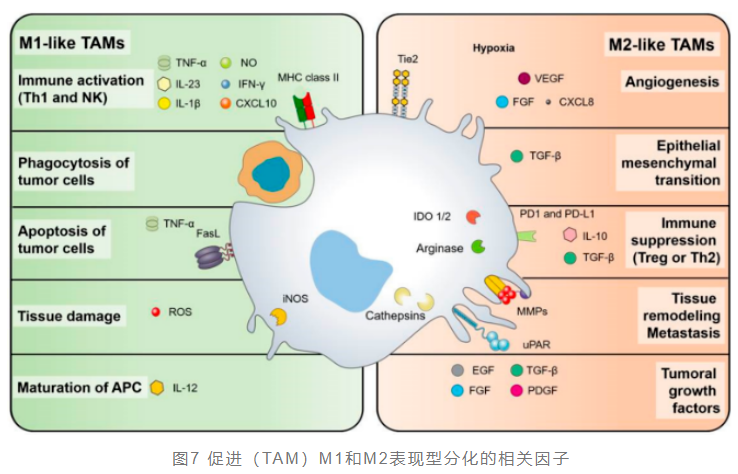
巨噬细胞是在肿瘤微环境里浸润率最高的先天免疫细胞,具有高度可塑性,在不同的微环境中会表现出明显的功能差异,主要具有两种极化状态:M1表型和M2表型。其中,M1型巨噬细胞被TLR或Th1细胞因子激活,具有很高的抗原呈递能力的同时,还分泌活性氧(ROS)及促炎性细胞因子,与癌症良好预后相关。相反,M2样巨噬细胞被Th2衍生的细胞因子极化,促进组织修复。同时,M2样巨噬细胞可通过分泌肾上腺髓质素和血管上皮生长因子(VEGF)支持血管生成并表达免疫抑制分子,从而促进肿瘤生长。TAM可以渗透到实体瘤组织中并且与肿瘤微环境中几乎所有细胞成分相互作用,一般为M2型,因此,将M2型肿瘤相关巨噬细胞逆转为M1型巨噬细胞,对于逆转肿瘤免疫抑制状态、杀伤肿瘤细胞至关重要。
通过基因编辑技术开发的巨噬细胞可以逆转免疫状态,实现这种转变。用特异性CAR修饰人巨噬细胞,可以提高巨噬细胞抗肿瘤的吞噬活性和抗原呈递能力,并且通过分泌促炎症细胞因子改变肿瘤附近的微环境。
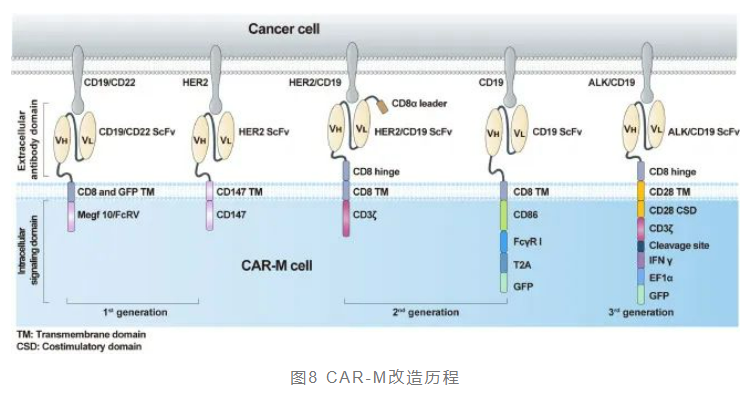
与CAR-T类似,CAR-M的核心成分包含一个细胞外结构域,通过单链可变片段(scFv)(例如CD19和HER2),一个铰链结构域,一个跨膜结构域(主要是CD8)和一个细胞内结构域,提供专用的下游信号传导(例如CD3ζ,FcyR)。第一代CAR-M细胞用编辑过的CAR修饰靶向特定抗原来识别肿瘤细胞并提高其吞噬能力。然而,CAR-M结构仅仅利用了巨噬细胞独特的特性,主要是吞噬作用。
第二代CAR-M除了保持第一代CAR-M技术的特点外,还包括改善肿瘤相关抗原呈递和T细胞活化,在CAR结构中加入胞内细胞质结构域。其次,必须考虑诱导和维持抗癌表型以克服TAM的可塑性。
通过非病毒载体在体内重新编程CAR-M的新概念已被用于第三代的设计,第三代CAR-M技术广泛增强抗癌功效。细胞因子受体结构域的适应性进一步提高CAR-M产物的免疫调节和肿瘤杀伤能力。
2016年,宾夕法尼亚大学的CAR-T细胞治疗专家Saar Gill和Michael Klichinsky成立CARISMA Therapeutics,致力于开发CAR-M疗法。2021年3月,CARISMA宣布完成CAR-M细胞疗法CT-0508(靶向HER2,针对实体瘤)的首例受试者给药,这是全球首次将CAR-M应用于临床研究中。另一个已获FDA批准的CAR-M治疗产品来自Maxyte的候选药物MCY-M11。
当下主流免疫细胞疗法发展格局以纳斯达克上市Biotech为主,处于内圈商业化或关键临床阶段的企业寥寥,绝大部分企业的管线尚处于开发早期阶段(外圈),同时形成多种细胞类型与技术路径百花齐放的格局。
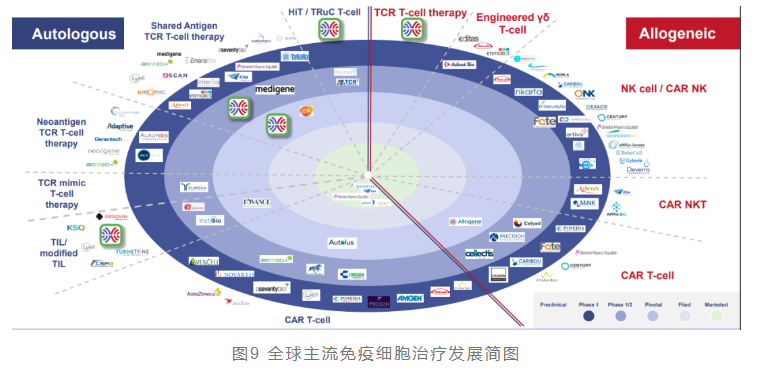
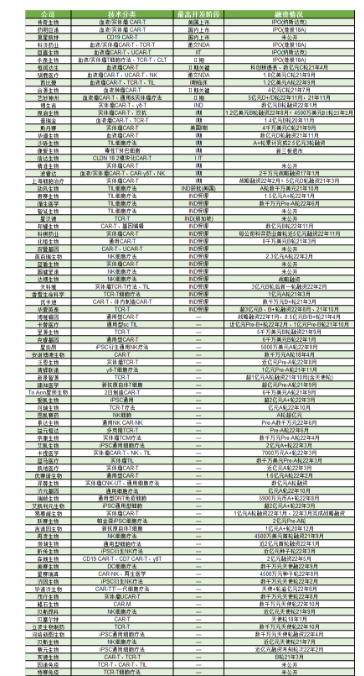
目前国内细胞治疗领域的发展现状如下表所示。
表1 国内87家免疫细胞治疗企业管线技术与最新融资情况汇总
目前,细胞疗法在2017年激增的研发热度由于商业化能力不及预期等原因已回归理性,血液瘤赛道参与者众多且市场有限,因而实体瘤市场备受关注,但目前并未有实质进展。从整体生物医药研发融资看,细胞疗法的融资在本年度是当之无愧的老大,约占总量20%。融资轮数分布上,排名一二位的Pre-A~A+轮、种子轮天使轮。其中,约有50%在Pre-A~A+轮,占比颇大,可见该赛道新入局企业数量庞大。而格局未现且研发热度高,预计未来几年仍会在整体生物医药研发投融资中占据重要地位。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 南京市江宁区科学园乾德路5号