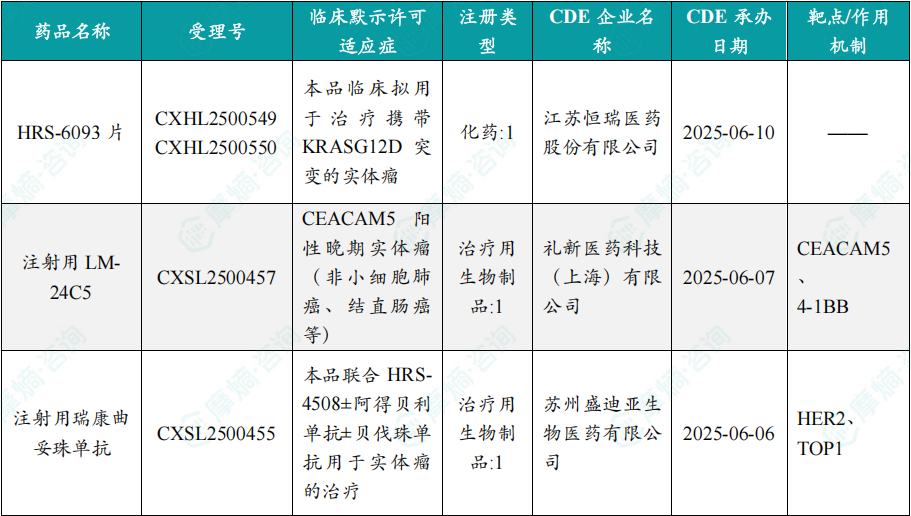
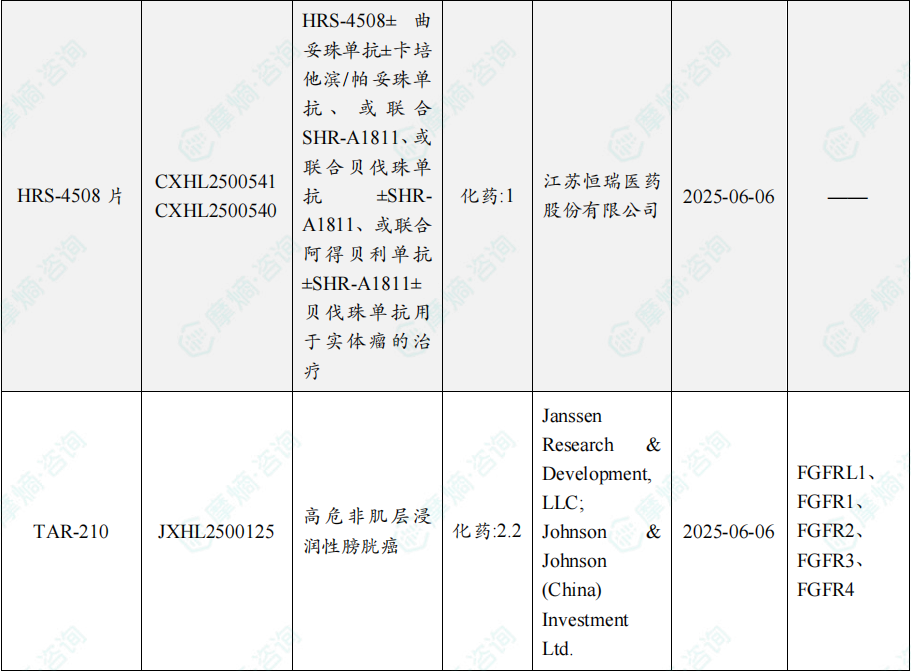
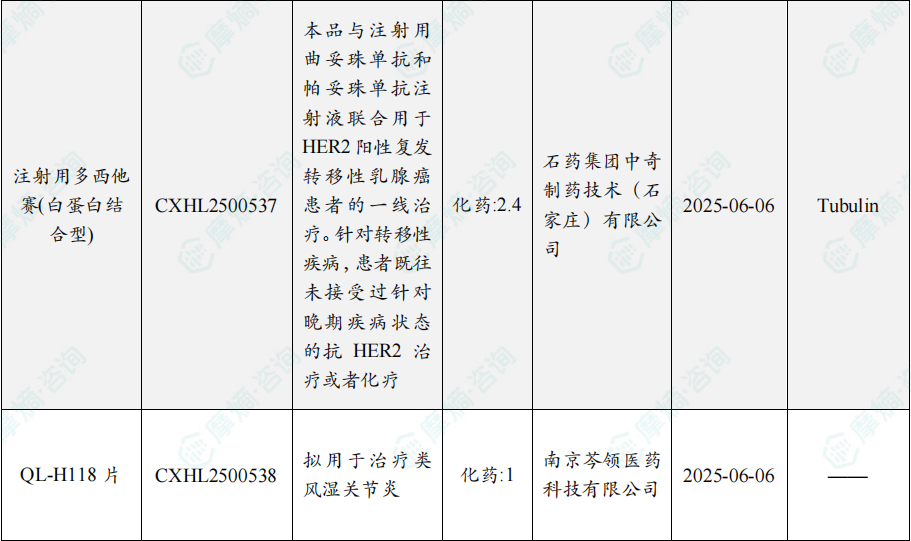
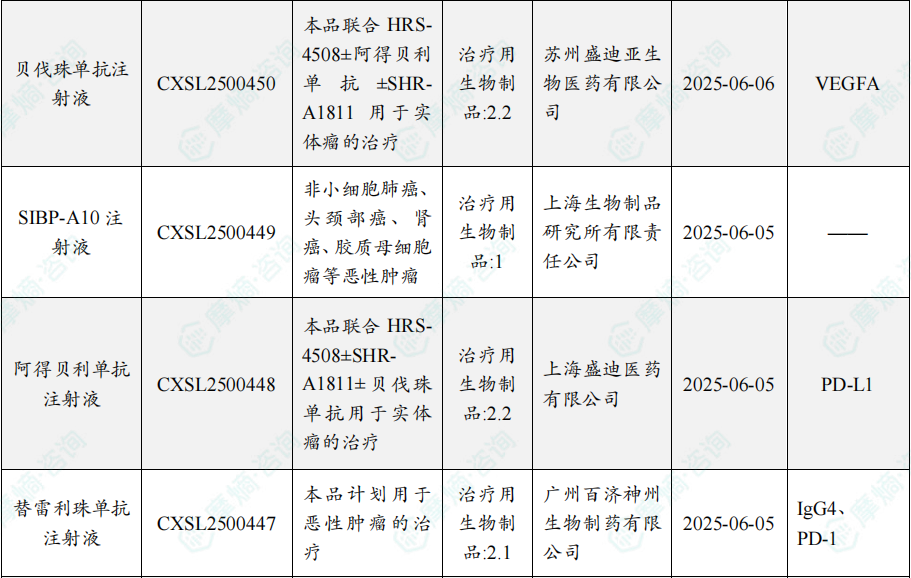
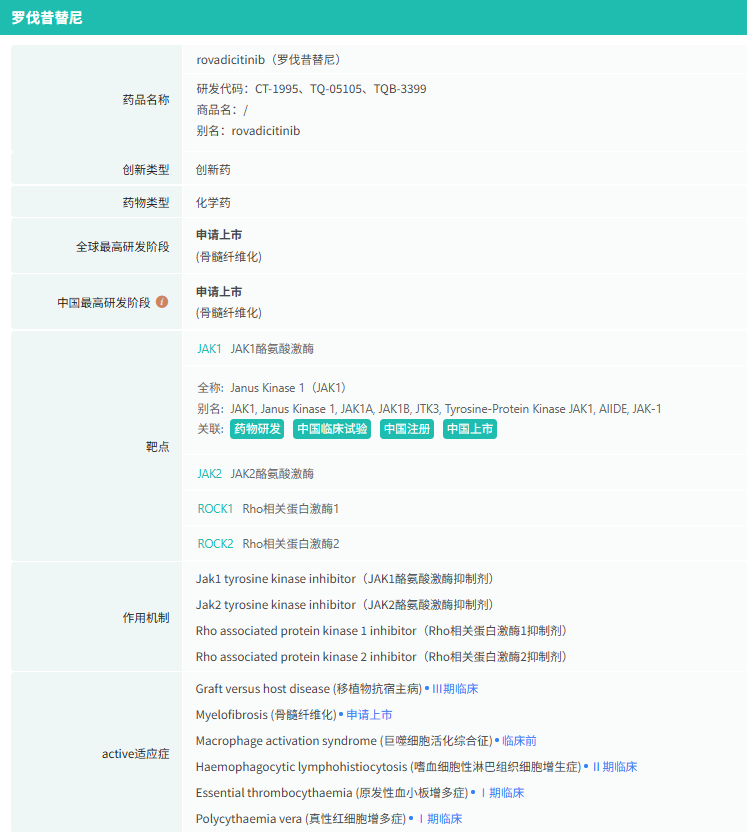
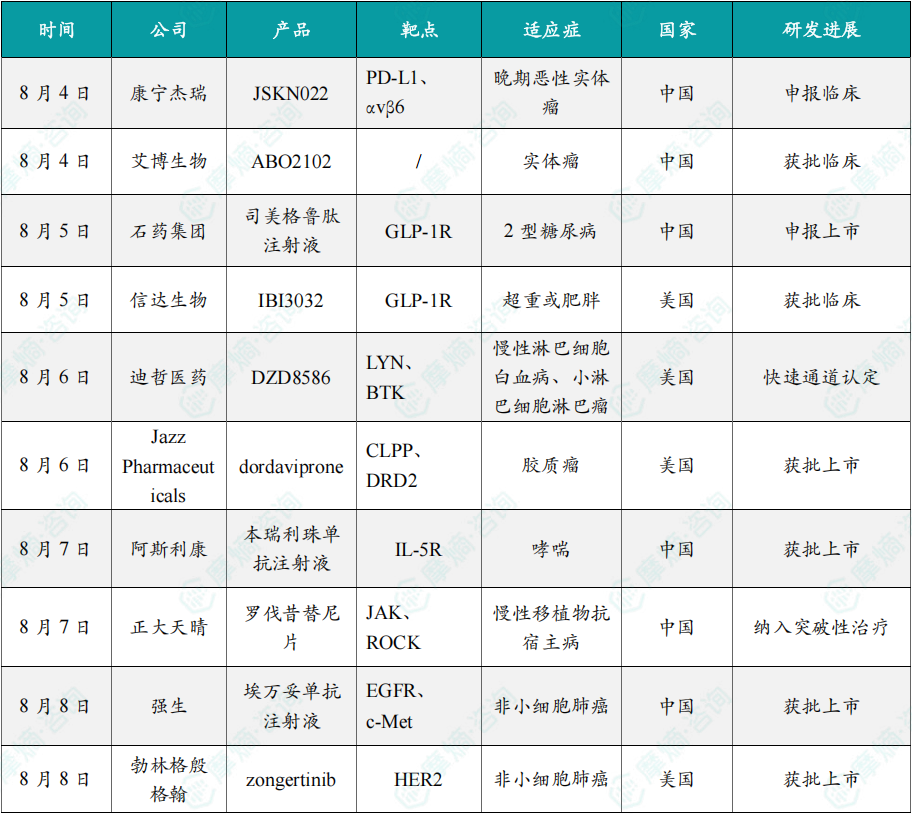
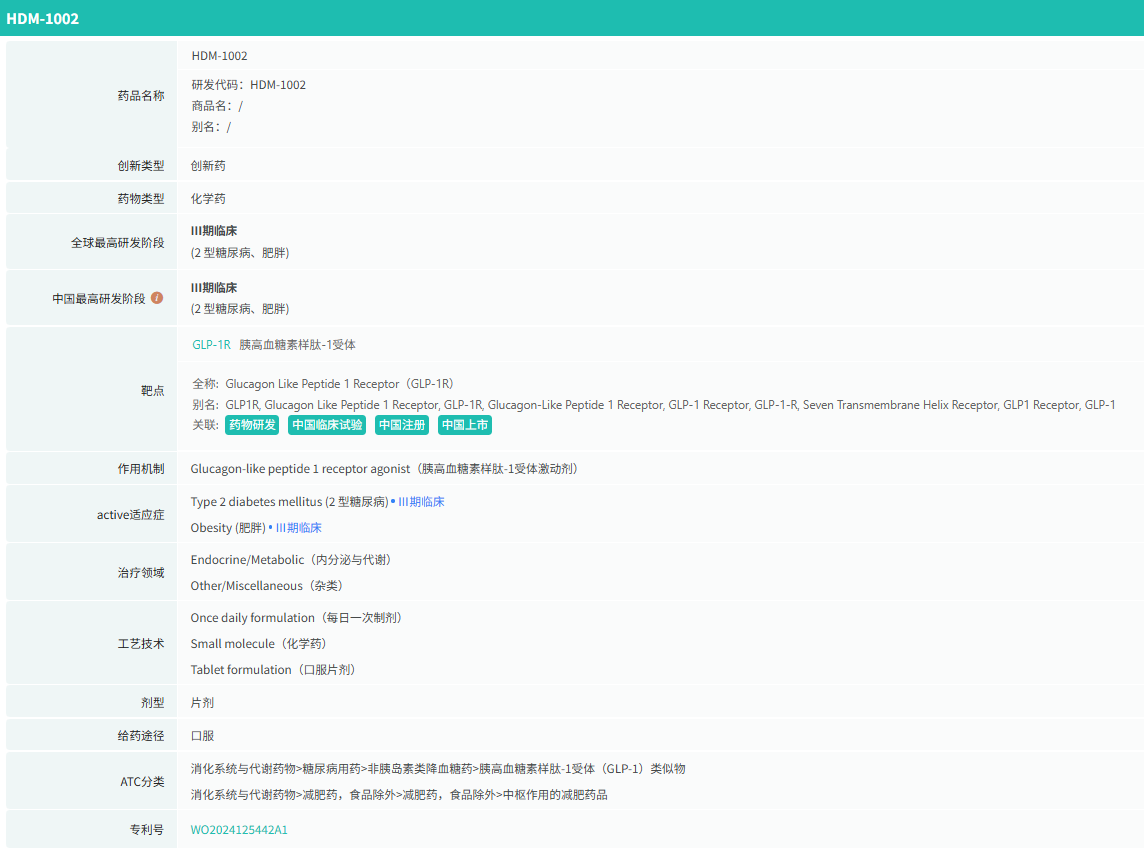
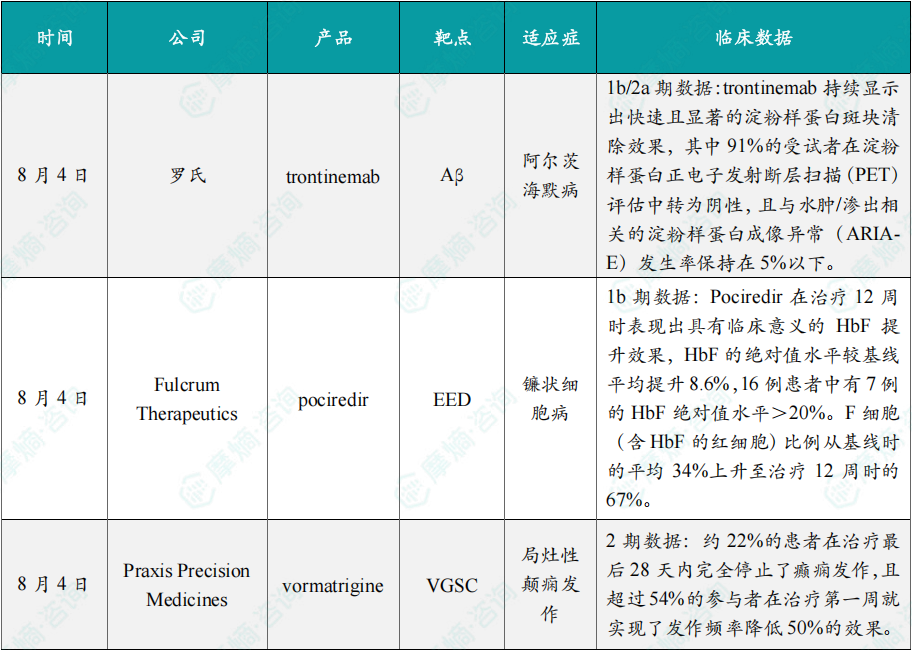
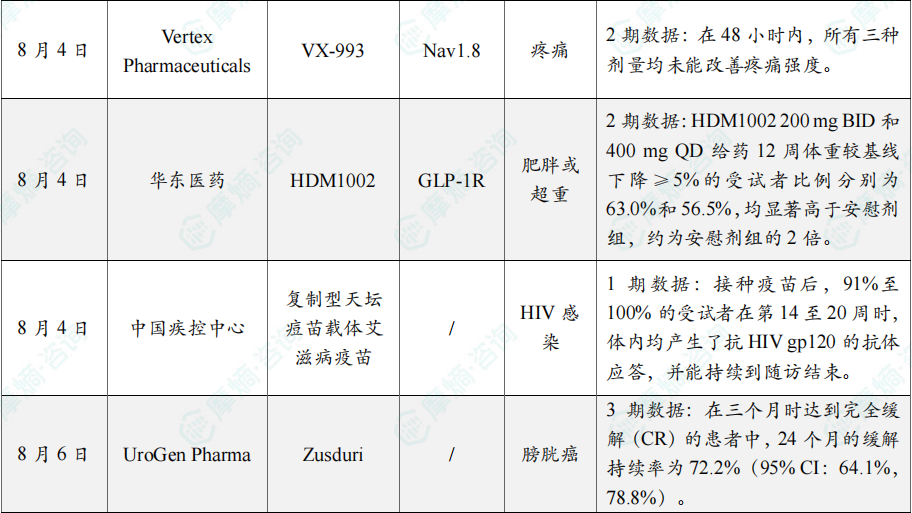
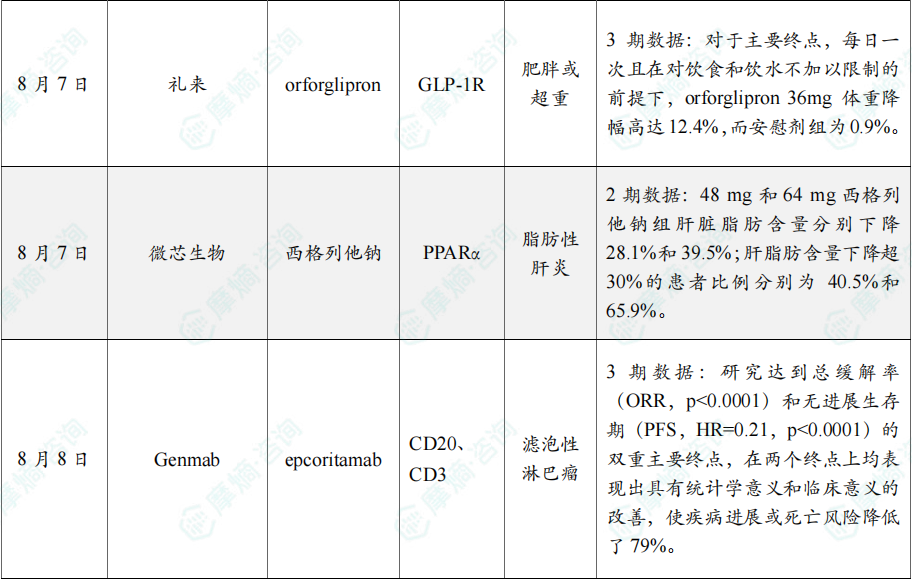
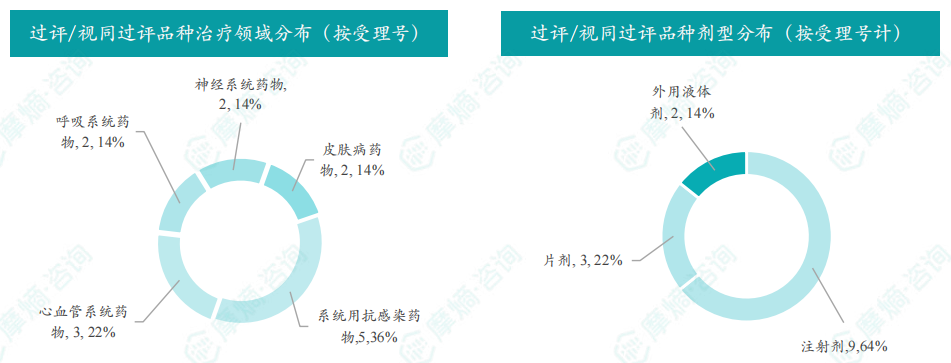
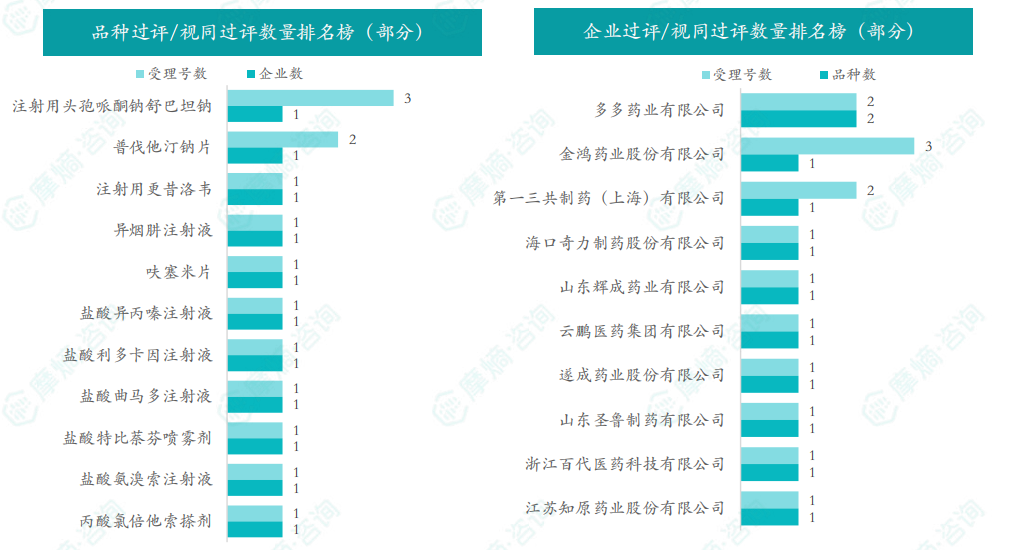
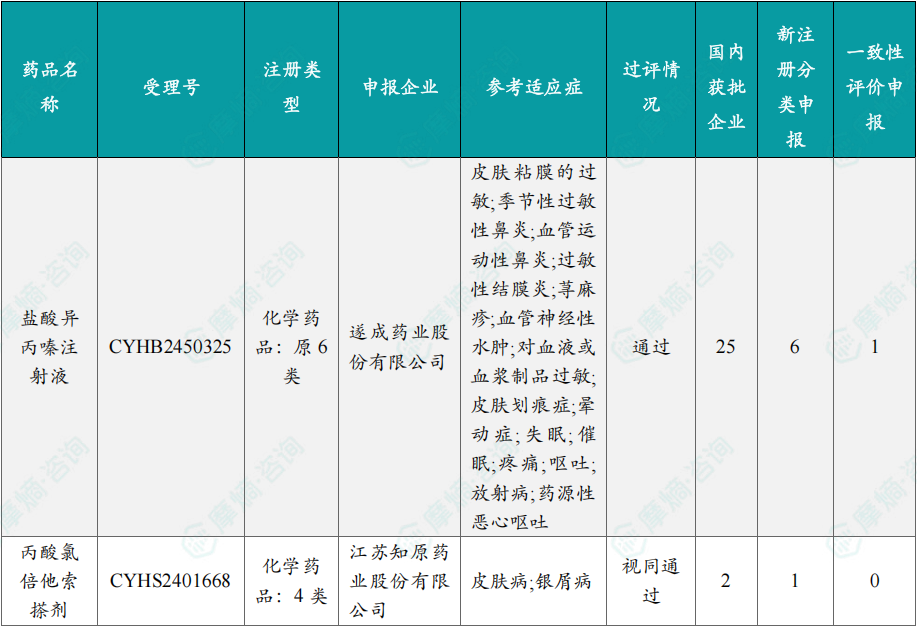
随着全球医药行业的快速发展,新药研发与创新已成为推动行业进步的重要动力。近期,根据摩熵医药数据统计,新药申请与审批获批频繁,显示出医药创新领域的活跃态势。 本文将深入分析2025年8月4日至8月10日期间,国内外新药申请、临床试验批准、仿制药一致性评价等多个方面的最新进展,为用户提供全面的行业资讯。 根据摩熵医药数据库统计,2025年8月4日至8月10日期间共有82个创新药/改良型新药临床申请/上市申请获国家药品监督管理局药品审评中心(CDE)承办(按受理号统计,不含补充申请)。其中国产药品受理号74个,进口药品受理号8个。 注:完整数据可识别“文末”二维码下载查看 在全球创新药研发领域,8月5日,中国国家药监局药品审评中心(CDE)官网公示,石药集团以化药注册分类2.2类申报的司美格鲁肽注射液上市申请已获得受理。根据石药集团公开资料介绍,这款司美格鲁肽产品的原料完全通过化学合成法制备。2024年8月和9月,该产品先后在中国完成治疗2型糖尿病和用于体重管理的3期临床试验全部受试者入组。 根据石药集团公开资料介绍,该公司开发的化药2.2类司美格鲁肽注射液使用的原料完全通过化学合成法制备,制备出的原料纯度更高,避免了生物发酵过程引入的宿主蛋白等免疫原性物质,并保证了杂质水平不高于DNA重组技术制备的司美格鲁肽。临床前研究结果显示,该产品与DNA重组技术制备的司美格鲁肽注射液具有相似的生物活性和减重效果、体内降糖效果。 8月7日,正大天晴宣布其1类新药罗伐昔替尼片(rovadicitinib,TQ05105)被中国国家药监局药品审评中心(CDE)纳入突破性治疗品种,用于慢性移植物抗宿主病(cGVHD)的治疗。罗伐昔替尼为一款JAK/ROCK双重小分子抑制剂。目前,其用于治疗中高危骨髓纤维化(MF)在中国处于上市审评阶段;慢性移植物抗宿主病的治疗在中国处于3期临床研究阶段,在美国已获准开展2期临床。 罗伐昔替尼片是一款潜在“first-in-class”新药,能够抑制JAK家族激酶活性及ROCK激酶活性,抑制JAK/STAT通路的持续异常活化,同时抑制ROCK2减轻STAT3的磷酸化,进而重建免疫平衡。该产品具有JAK(抗炎)和ROCK(抗纤维化)的双重抑制特性,在治疗慢性移植物抗宿主病、骨髓纤维化、急性移植物抗宿主病(aGVHD)、噬血细胞综合征等疾病中展现出广阔的治疗潜力。 截图来源:摩熵咨询周报 本周全球TOP10临床结果中,8月4日,华东医药自主研发的1类创新药口服小分子GLP-1受体激动剂 HDM1002 的减重Ⅱ期研究结果发布。HDM1002片用于超重或肥胖人群的体重管理的中国Ⅱ期临床试验是一项为期16周(包含4周安全性随访期)的多中心、随机、双盲、双模拟、安慰剂对照、平行入组试验(n=185例),旨在评估 HDM1002片(100 mg BID/200 mg BID/400 mg QD,口服)在不伴糖尿病的肥胖或超重受试者中的安全性和有效性。该研究的主要终点为治疗第12周时受试者的体重相对于基线的百分比变化。 研究结果显示:HDM1002 100 mg BID组、HDM1002 200 mg BID组、HDM1002 400 mg QD组及安慰剂组给药12周后体重较基线变化百分比分别为-4.63%、-6.08%、-6.83%和-2.88%。其中HDM1002 200 mg BID组和400 mg QD组与安慰剂组比较均具有统计学显著性差异。 敏感性分析结果显示HDM1002 100 mg BID、200 mg BID、400 mg QD和安慰剂组给药12周后体重较基线变化百分比分别为-5.39%、-7.01%、-8.46%和-2.87%,与主分析结果一致。HDM1002 200 mg BID和400 mg QD给药12周体重较基线下降≥5%的受试者比例分别为63.0%和56.5%,均显著高于安慰剂组,约为安慰剂组的2倍。 除此之外,给药12周后 HDM1002 各剂量组均可以观察到腰围、BMI、收缩压、HbA1c、谷丙转氨酶水平较基线值下降。 截图来源:摩熵医药全球药物研发数据库 同日(8月4日),中国疾控中心艾防中心联合北京协和医院等团队宣布,我国首个复制型天坛痘苗载体艾滋病疫苗顺利完成I期临床试验。在全球超过300次艾滋病疫苗试验折戟后,这一突破不仅终结了我国无原创艾滋病疫苗技术的历史,更为人类终结这场40年的健康之战带来曙光。在严格控制的I期临床试验中,48名18-45岁健康志愿者分成两组:一组单独接种rTV,另一组先注射DNA疫苗再加强接种rTV。安全性方面:88%志愿者出现轻微反应,主要是注射部位红肿、腋下淋巴结肿大,所有症状均在3天内自行消退,无任何严重不良事件。疫苗的安全性良好,出现的不良反应主要为接种部位的红肿、淋巴结肿大等,症状轻微且可自行恢复。 有效性方面:高剂量组成功诱导HIV gp120特异性IgG抗体,更激活多功能CD4+ T细胞——这两种免疫反应正是阻击艾滋病的关键武器。接种疫苗后,91%至100% 的受试者在第14至20周时,体内均产生了抗HIV gp120的抗体应答,并能持续到随访结束。 根据摩熵医药数据库统计,2025年8月4日至8月10日期间共有119项仿制药申报上市/申报临床获CDE承办,其中新注册分类上市申请受理号112项(包括化药3类,4类,5.2类),新注册分类临床申请受理号3项(包括化药3类),一致性评价申请4项。本周8个品种通过一致性评价(按受理号计11项),本周3个品种视同通过一致性评价(按受理号计3项)。本周有3项生物类似物注册申报动态,分别是广东安普泽生物医药股份有限公司的西妥昔单抗注射液、信立泰的特立帕肽注射液、恒敬合创生物医药的精蛋白重组人胰岛素混合注射液(30R)。 本周过评/视同过评品种主要为系统用抗感染药物;过评/视同过评产品剂型主要为注射剂。 截图来源:摩熵咨询周报 本周注射用头孢哌酮钠舒巴坦钠品种过评/视同过评受理号数量达到3个,本周各品种过评/视同过评企业均为1家;本周过评/视同过评企业共包括多多药业有限公司、金鸿药业股份有限公司和第一三共制药(上海)有限公司等14家企业,其中多多药业有限公司过评/视同过评品种数最多,达2种。 本周首次过评/视同过评品种
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 南京市江宁区科学园乾德路5号