目前,对更可靠的药物筛选设备的需求使得科学家和研究人员开发出新的潜在方法,提供动物研究的替代方法。器官芯片是药物筛选和疾病代谢研究的新平台。这些微流控装置试图利用人类来源的细胞来概括不同器官和组织的生理和生物学特性。最近,增材制造和微流体的协同结合在改进广泛的生物模型方面显示出了良好的影响。来自加拿大卡尔加里大学的Keekyoung Kim教授团队对利用生物打印对不同的方法进行了分类,以实现器官芯片中相关的仿生模型,提高了这些设备的效率,为药物研究提供了更可靠的数据。除了组织模型外,还讨论了增材制造对微流控芯片制造的影响,并综述了其生物医学应用。
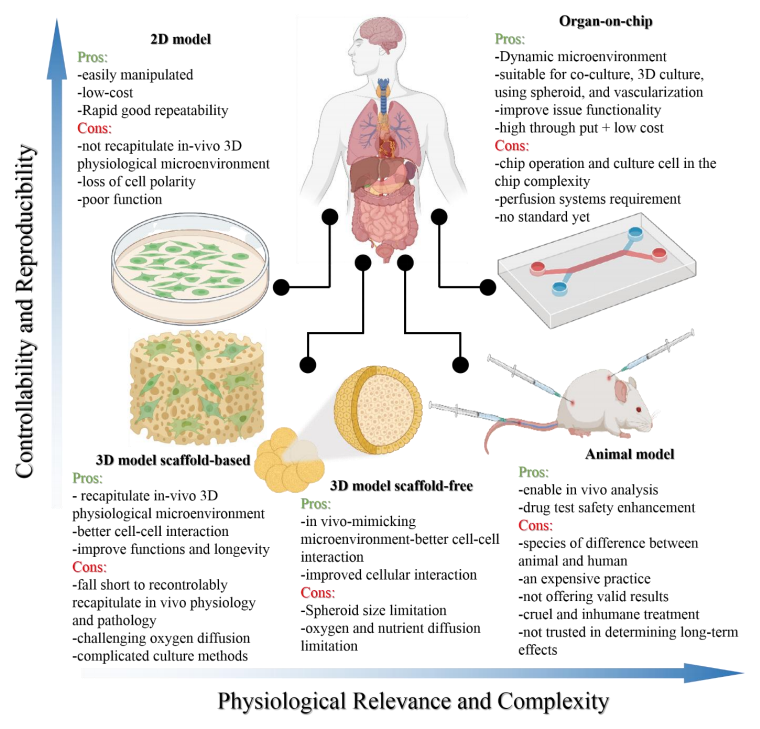
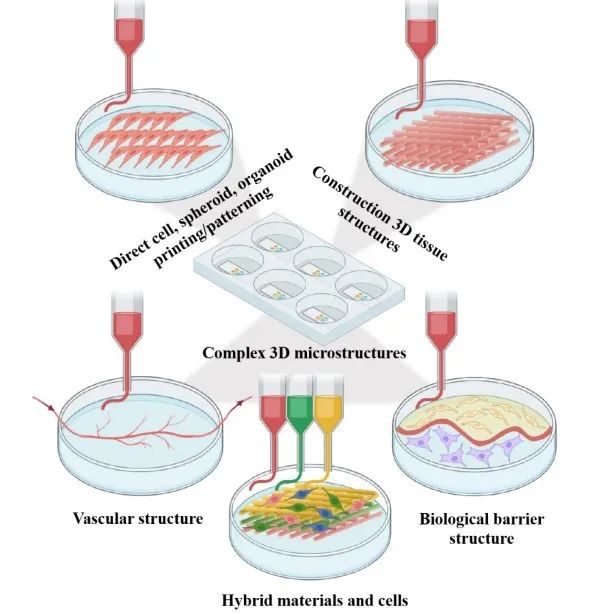
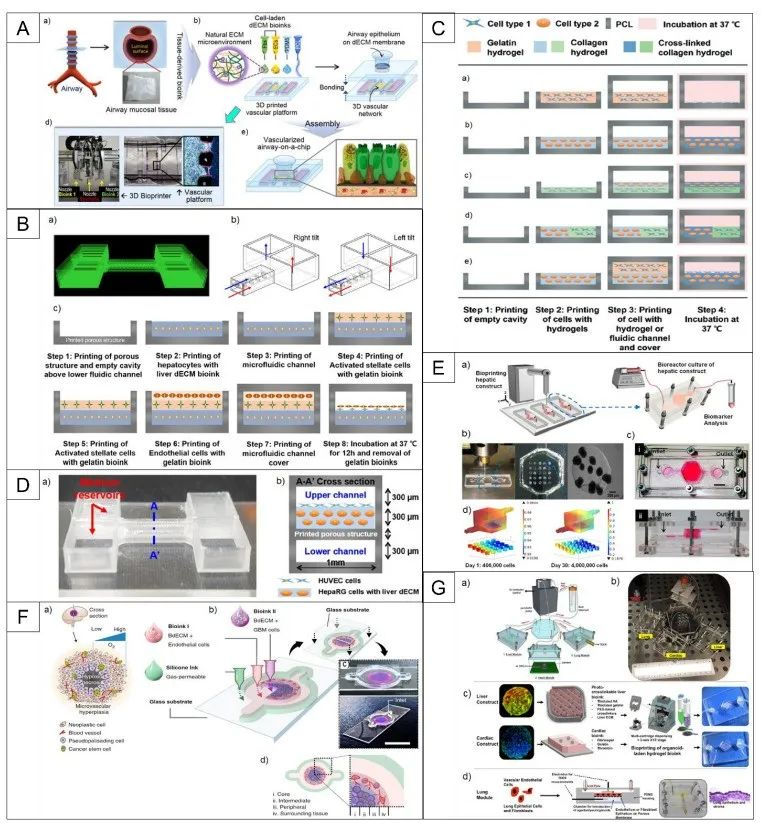
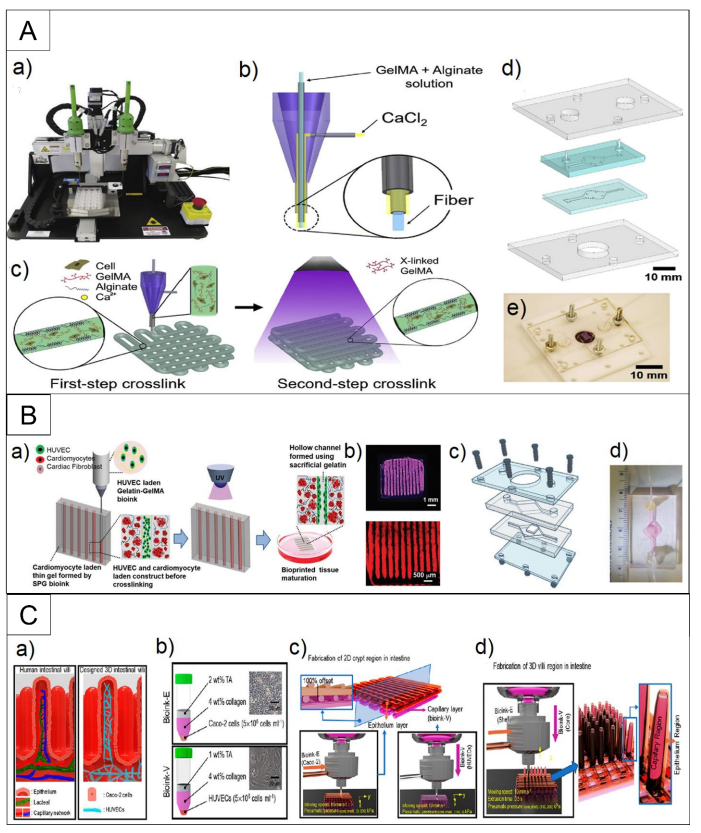
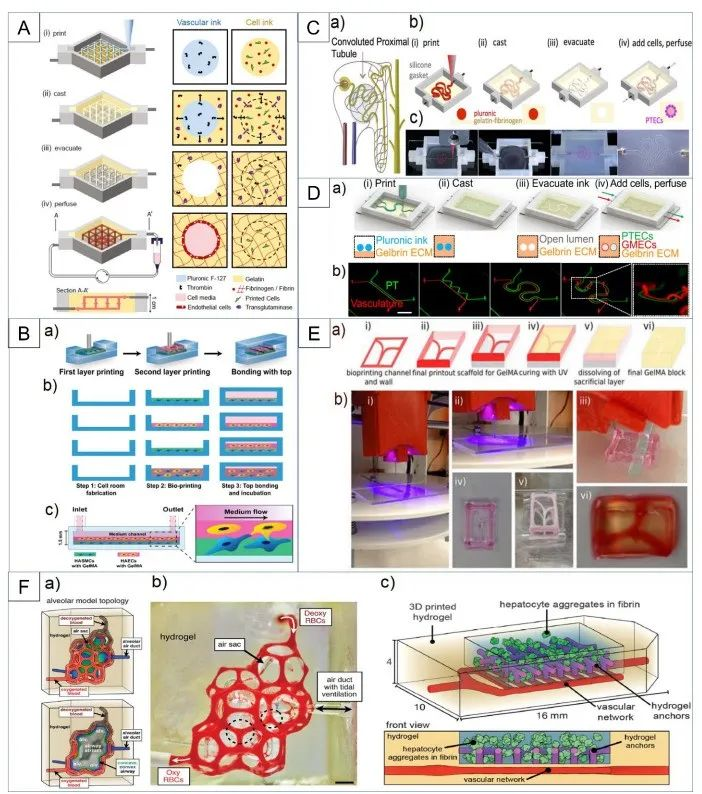
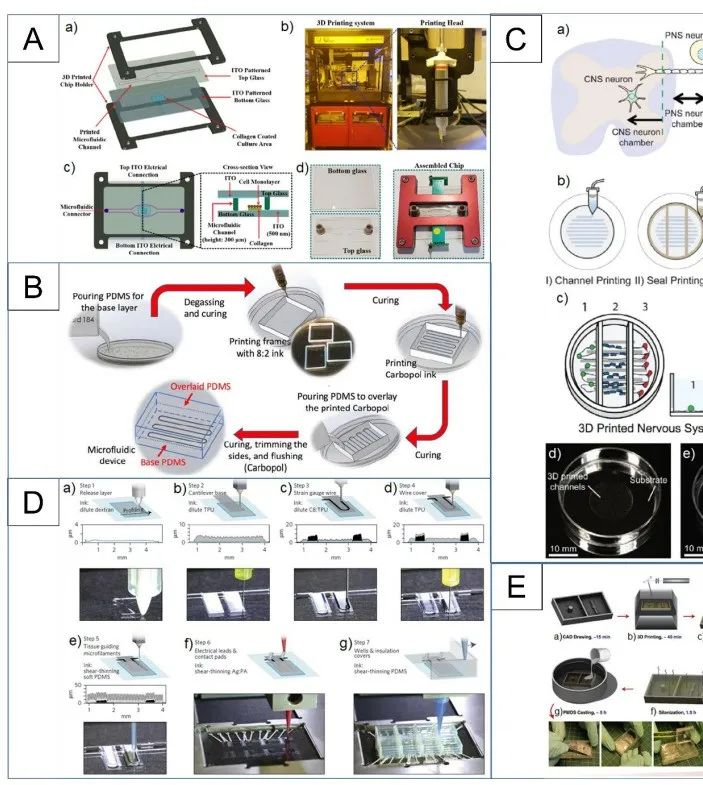
相关内容以“Recent advances in organ-on-chips integrated with bioprinting technologies for drug screening”为题与2023年3月27日发表在《Adv Healthcare Mater》期刊上。各种平台已被用于研究新药的开发和疾病机制:2D细胞模型、3D细胞模型、器官芯片(OOCs)和动物模型。这些平台都有其优缺点,在根据其使用的上下文选择特定的平台设计时扮演着至关重要的作用,如图1所示。如图所示,2D细胞模型的重复性很高,但与其他模型相比,复杂度更低。3D细胞培养更复杂,但这些模型在真实的组织相关性上存在不足,因为它们是在一个与人体的流体动力学不同的静态环境中培养的。动物研究是目前用来进行药物筛选和疾病建模的最复杂的方法之一。然而,这一领域的研究存在一些挑战,如伦理问题、动物物种之间的差异以及动物和人类生理之间的内在不匹配。OOCs可能是满足这些需求的一种潜在体外模型,因为它们能够在类似于人体条件的动态环境中利用人类源性组织模型。为了成功地用OOCs取代动物研究和人体试验,需要可以容纳芯片内大多数仿生组织或器官模型的先进的生物制造技术。随着3D生物打印和OOC制造工艺的融合,可以创建更复杂的人工组织,具有适当的微结构的机械和化学刺激。有几种主要的方法用于集成3D生物打印和OOC制造过程,如图2所示。通过生物打印机直接进行多细胞打印或模式化,可提高精度和再现性,同时确保高通量。作为集成3D生物打印和OOCs最直接的方法之一,细胞打印和模式已被用于各种研究。利用气管粘膜脱细胞的细胞外基质,将内皮细胞和成纤维细胞封装并打印在一个指定的聚己内酯框架内,逐渐驱动内皮细胞的重新定位,并提供了一个模拟体内条件的生态位(图3A)。利用细胞打印技术共培养三种肝细胞类型:肝细胞、活化的星状细胞和内皮细胞,每种非实质肝细胞类型都被打印为一个多层结构,如图3B所示,它们的位置与天然的肝脏微结构相似。异型细胞类型和生物材料被使用并定位在所需的位置,以制造各种芯片上的肝脏,促进对肝脏自然条件的预期模拟,如图3C所示。与没有胆道系统的芯片相比,包含胆道流体通道的芯片可诱导更优越的肝脏特异性基因表达和功能。图3D展示了在本工作中制造的芯片的结构。球状体可以在生物打印过程中使用单个细胞打印,利用3D生物打印技术,制备了包裹在光交联明胶甲基丙烯酰基(GelMA)中的球状体的肝脏结构。通过监测30天培养期间的白蛋白、α-1抗胰蛋白酶、转铁蛋白和铜蓝蛋白的分泌率进行评估(图3E)。在癌症芯片(COC)的案例中,生物打印胶质母细胞瘤的肿瘤间质同心环结构,包含患者来源的肿瘤细胞、血管内皮细胞和脑组织脱细胞细胞外基质(图3F)。OOC技术研究的最终目标是将它们集成到人芯片(HOC)中,利用相关ECM中的类器官制备了肝、心脏和肺,然后将它们结合起来研究器官间对给药的反应(图3G)。除了打印和模式化细胞外,3D结构也可以利用3D生物打印来制造。如图4A所示。利用制造的内皮化心肌芯片上的结构用于心血管药物测试和内皮化人心肌芯片上,作为个性化医疗的一步。一种支持水凝胶用于封装人诱导多能干细胞来源的心脏球状体(hiPSC-CSs),并通过嵌入式生物打印技术创建可灌注的血管化通道,所构建的组织被用于生成一个内皮化的心肌组织芯片,作为一个潜在的个性化医疗药物筛选平台。图4B展示了其打印原理图和芯片结构。使用3D生物打印技术建立了肠绒毛模型,包括上皮层和毛细血管结构:利用两种含有Caco-2细胞和人脐静脉内皮细胞的胶原基生物墨水,制作了3D模型的表位基质体和毛细血管网络,如图4C所示。图5 解决与组织模型相关的血管化挑战的3D生物打印方法的总结(1)使用含有多元性和凝血酶的难捕捉墨水和细胞装载墨水作为可灌注通道的基质进行3D血管化组织制造(图5A)。(2)在微流控芯片上生物打印两层细胞,说明了使用细胞负载水凝胶的分层结构芯片上的容器模型(图5B)。(3)3D卷曲的肾近端小管在制作三维卷曲、可灌注的近端小管的不同步骤的图像(图5C)。(4)3D血管化近端小管模型的设计与制作(图5D)。(5)利用打印的多胶模板在GelMA基质中制造空心通道图5E。(6)带血管化肺泡模型拓扑的水凝胶的潮汐通气和氧合(图5F)。图6A所示是微流控玻璃芯片制造说明扩展原理图和最终芯片。图6B示意图说明了使用卡波波尔凝胶作为牺牲油墨在多步骤过程中制造微流控装置的概念。多个器件可以在一个培养皿上以一种吞吐量的方式制造。图6C为神经系统示意图,建模有四个主要组成部分:中枢神经系统神经元、PNS神经元、轴突相关的雪旺细胞和上皮细胞,以及它如何在芯片上建模。图6D展示了心脏芯片的器件原理及微尺度3D打印工艺。图6E是3D打印树脂模具的表面处理方案。总之,OOCs是一种很有前途的体外药物筛选的生物医学工具。然而,它们目前仍面临着阻碍其广泛临床应用的挑战,如在实现与人体组织和器官具有足够的复杂性和相似性方面。与微流控系统集成的3D打印组织有潜力提供一种动物研究的替代方法。因此,本文综述了使用3D生物打印技术创建开发良好的仿生组织模型的不同策略,以及在微流控装置制造中的应用。下一代OOCs将不仅能够利用高质量的生物打印技术和微流体,而且它们与人类来源的原代细胞和诱导多能干细胞的整合将有助于推进精确医学领域。