在2023年12月,美国FDA发布了针对多肽药物产品的关键指南——《多肽药物产品的临床药理学考量》(访问链接:www.fda.gov/media/171901/download;或点击“阅读原文”查看原文链接),其中特别强调了在多肽仿制药出海申报过程中,免疫原性风险评估的不可或缺性。
随着多肽药物专利保护期的结束,多肽仿制药的出海也正加速推进。然而,通过ANDA途径申请的多肽仿制药,虽无需重复进行临床试验,却面临着无法直接评估临床免疫原性风险的挑战。在多肽生产过程中,因为工艺的不稳定性或新技术的应用,可能引入与原研药不同的杂质,或导致杂质含量有区别,进而触发免疫反应,影响药物安全性。 FDA对多肽仿制药中的新杂质含量设定了严格的界限——不得超过0.5%。对于未超标的新杂质,申请人必须提供充分的数据支持,证明这些杂质不会对药物的免疫安全性构成威胁。这一要求凸显了杂质控制及免疫原性评估在仿制药研发中的重要性。 通常,在免疫原性风险评估方面,采用T细胞测定的方法,包括固有免疫(innate response)和适应性免疫(adaptive response)。对于T细胞免疫原性分析,FDA也指出了常见的问题,例如不足的HLA目标人群覆盖率、没有验证方法灵敏度、缺乏足够的方法优化等。 作为全球领先的生物制药服务提供商,Lonza在英国剑桥与美国波士顿的实验室拥有卓越的免疫原性评估能力。依托高质量、多样化的PBMC细胞库,结合先进的in silico与in vitro 评估体系,为抗体、ADC、多肽、mRNA等多种分子类型提供全方位的检测服务。 在多肽领域,Lonza已助力多个产品成功或正在推进FDA申报流程,其中完成或正在进行申报的产品包括了司美格鲁肽、利拉鲁肽、替尔泊肽、替度鲁肽、兰瑞肽、奥曲肽、抗利尿激素、降钙素等。Lonza公司的免疫学负责人Noel Smith博士,作为体外免疫原性检测领域的资深专家,频繁受邀与美国食品药品监督管理局(FDA)就免疫原性议题进行深入交流。他凭借深厚的专业知识,对FDA针对多种多肽的最新免疫原性要求有着全面而深入的理解。 选择Lonza,将助力您获得专业的免疫原性评估服务,有效降低产品申报风险,加速多肽仿制药的国际化步伐。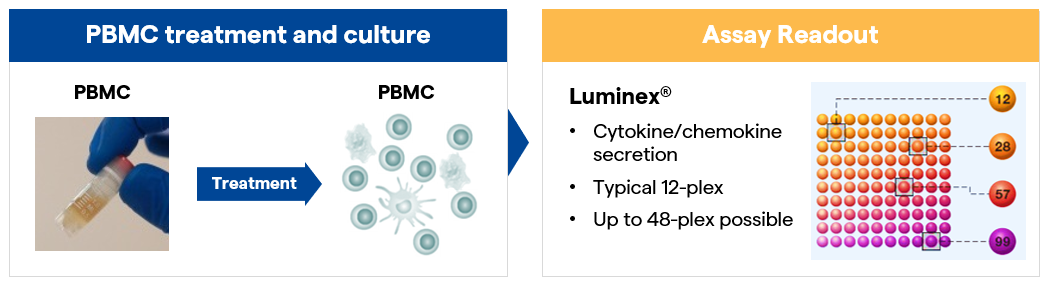
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 南京市江宁区科学园乾德路5号