提到类器官,许多研究人员脑海中浮现的关键词便是:前沿、高级、好发文章等。
作为当下最为火热的研究方向之一,类器官为广大研究人员在体外真实模拟体内器官发育、疾病机制研究、靶点药物开发提供了便利。其具有的诸多优点已经被各类文章相继报道。
尽管近10年来类器官研究如火如荼,各种类器官相继被开发出来。但是,缺乏血管化结构、缺乏免疫细胞、器官系统化程度低等问题限制了类器官研究的进一步发展。
今天,我们就从最新的研究文献入手,逐步破局类器官研究的“三大挑战”。
血管化
在所有的类器官研究中,脑类器官应该是最为特殊的,不仅因为其临床样本的珍贵性,还得益于其重要的临床价值。然而,长久以来,脑类器官的发展并不顺利,这其中最主要的障碍在于脑类器官系统缺乏体内脑组织的微环境、神经元回路、血管和免疫系统。
尤其是血管,其对于脑组织的营养供应和神经细胞分化都发挥着促进作用。血管的缺乏导致脑类器官中心坏死,进一步干扰其正常发育和神经元迁移路线。尽管与血管干细胞的共培养为上述问题提供了一定解决方案,但营养供应和真实血液微环境的问题仍然存在。
2019年,来自耶鲁大学的研究团队在国际顶刊Nature Methods在线发表了题为《Engineering of human brain organoids with a functional vascular-like system》的研究性论文。文中使用表达人类 ETS 变体 2 ( ETV2 )的人类胚胎干细胞 (hESCs)成功构建了具有血管样结构的脑皮质类器官(hCOs),该类器官具有类血脑屏障结构,包括紧密连接、营养转运蛋白和跨内皮电阻的表达增加,填补了脑类器官缺失血管的问题,丰富了脑类器官的研究应用。
ETV2转录因子是机体发育时期内皮细胞分化的关键基因。在这项研究中, 研究人员使用含有赛默飞Gibco B-27添加剂的培养基中,添加ETV2诱导产生了脑皮质类器官 (hCOs),并通过改变了ETV2的比例(5%、10% 和 20%)和诱导时间,确定了在 hCOs 中形成血管样结构的最佳条件:20% ETV2,18天诱导。通过免疫荧光,研究人员在该条件下可以显著观察到hCOs高表达的EC 标记CDH5、CD31、KDR、TEK、vWF和CD34。同时研究人员将具有血管样结构的 hCOs 命名为 vhCO。
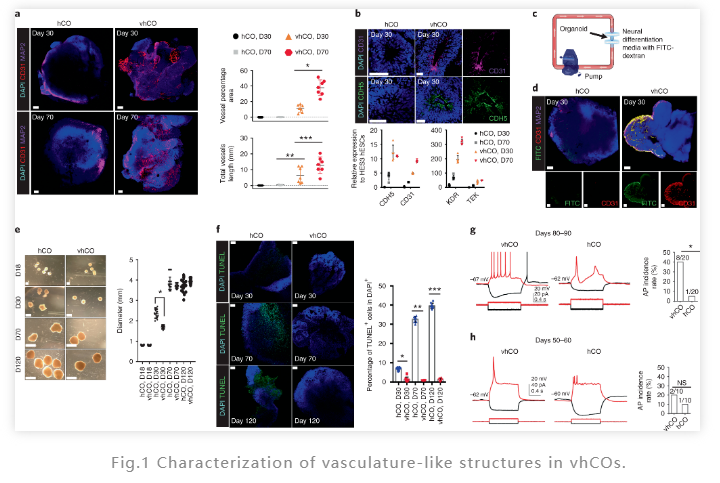
为了评估vhCO的血管样结构是否具有相应的功能,研究人员又分别在30、70 和 120 天评估了心室 (VZ) 样区、心室下 (SVZ) 样区和皮质层的分化情况。免疫荧光结果显示hCOs 和 vhCOs 在管腔周围都表现出高表达 SOX2的VZ 和 TBR1的SVZ。这些结果表明 hCOs 和 vhCOs 分化程度相似,都具有大脑皮层结构的区域和形态特征。
同时,使用CD31分子的整体免疫荧光染色,研究人员对内皮和血管样网络的组织也进行了评估。结果发现在30天时,vhCOs具有血管样结构,而hCOs则没有。在70天时, vhCOs中形成更加复杂的血管样结构网络。这些结果表明了ETV2可以成功诱导的血管样结构类器官的产生。
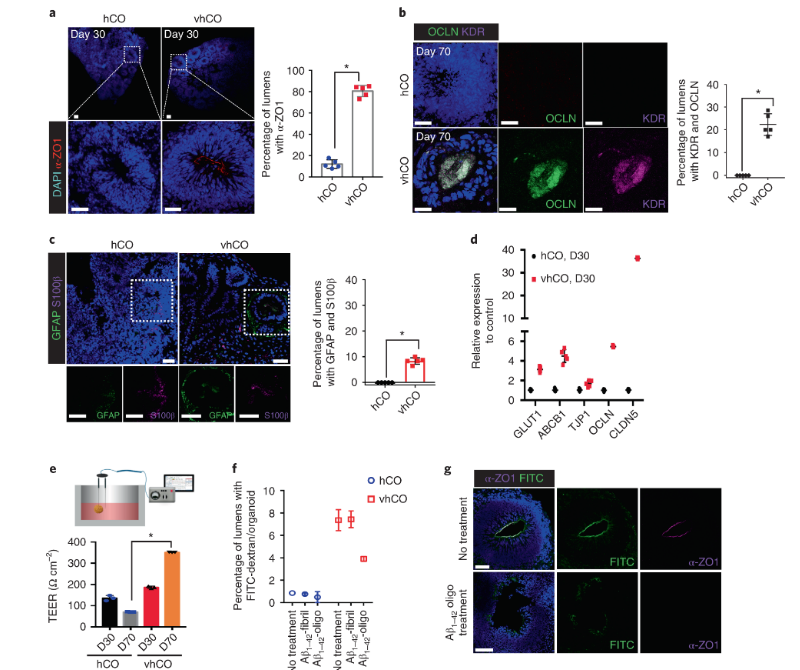
结构和功能是相辅相成的两个有机组成。在分析了vhCOs中血管样结构的形成后,研究人员又对其功能进行了评估。
首先通过灌注FITC-葡聚糖,研究人员确定了vhCOs中血管具有可灌注的功能。其次,通过对hCOs 和 vhCOs生长情况的对比,研究人员发现vhCOs中血管具有运送氧气的功能。最后,通过对分化神经元的分析,研究人员确定了表明 vhCOs中的血管样结构对于神经元成熟起着关键作用。
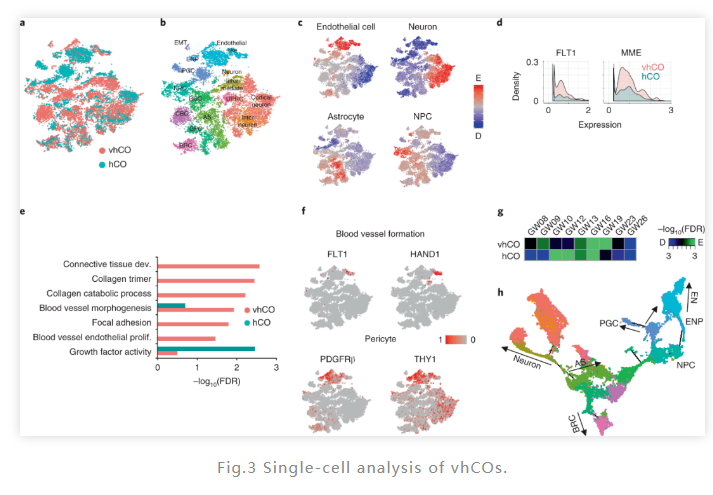
进一步地,通过单细胞测序,研究人证明了ETV2对 vhCO 中的血管 EC成熟和血管形态发生至关重要。同时,与发育中的人类大脑 (GW08-23) 的单细胞转录组谱进行比较后,研究人员证明了vhCOs 衍生的神经元类对应妊娠期16-19 周的神经元发育,进一步证明其向内皮谱系分化的潜力。
总的来说,这项研究通过结合转录因子ETV2与脑类器官,首次构建了具有血管样网络结构及类血脑屏障结构的脑类器官,为解决脑类器官乃至其他类器官培养过程中缺失血管这一关键问题提供了对策,推动了类器官研究的发展。
免疫化
免疫治疗的兴起极大推动了肿瘤研究的发展,然而由于种属特异性、人源化体系的复杂性、免疫系统的部分或无效重组建等问题,致使免疫肿瘤模型面临着巨大的挑战,临床上迫切需要能够用于个体化验证疗效的体外模型。类器官的出现给肿瘤免疫治疗提供了新的契机,然而,现有的类器官中缺乏免疫细胞限制了其发展。

一项发表于顶刊Cell题为《Generation of Tumor-Reactive T Cells by Co-culture of Peripheral Blood Lymphocytes and Tumor Organoids》的研究性论文为这个问题的解决提供了新的策略。
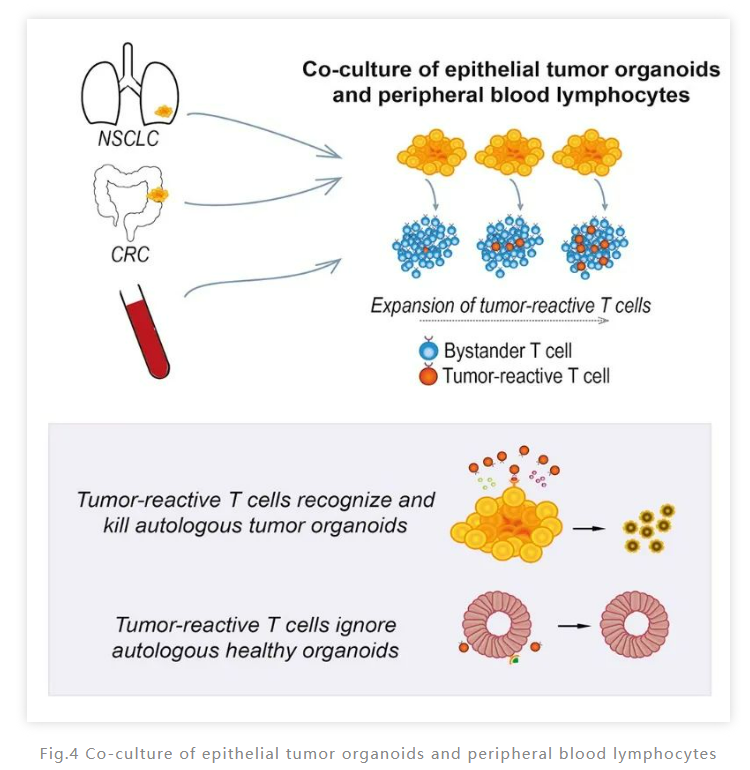
在这项研究中,研究人员通过来自患者的自体肿瘤类器官和外周血淋巴细胞共培养建立一个能够特异性诱导分析肿瘤免疫反应的平台,为分离评估肿瘤免疫中T细胞提供了新的方法。
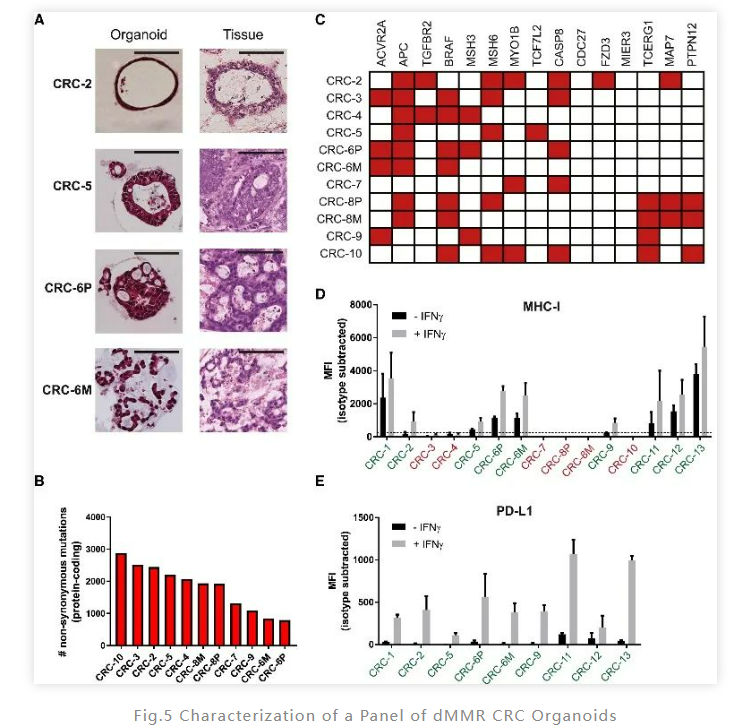
首先,研究人员从13 名错配修复基因缺陷型(dMMR)结直肠癌患者(dMMR CRC)体内分离15 个肿瘤类器官,成功率为60%,并使用含有赛默飞Gibco B-27添加剂的培养基按照1:2 至 1:5进行传代培养。随后,研究人员对着15个肿瘤类器官的特点进行了分析。通过全外显子组测序 (WES)、免疫组织化学染色分析发现MHC-1类分子的缺失不是类器官的一般特征。
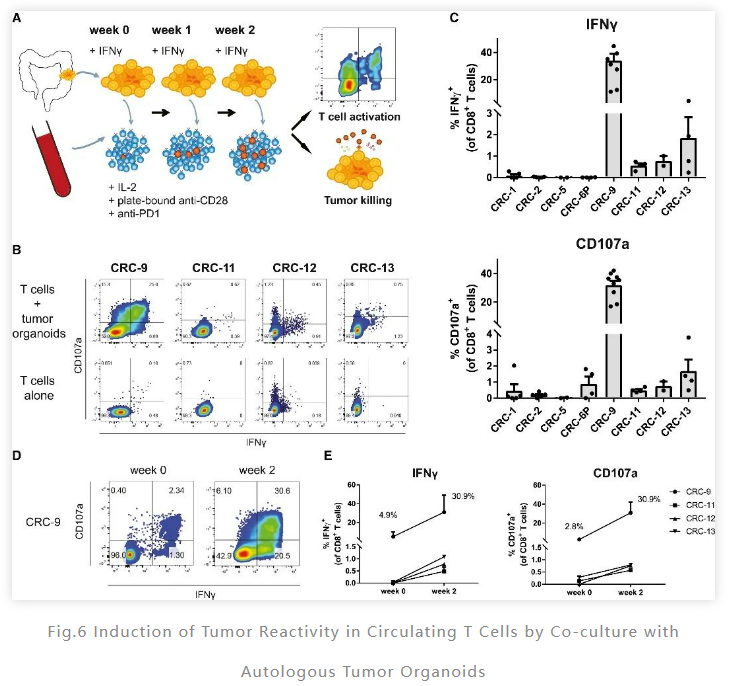
进一步地,为了评估该肿瘤类器官是否可用于获得肿瘤特异性 T 细胞。研究人员构建了“肿瘤类器官-外周血淋巴细胞”共培养模型。其中,外周血单个核细胞(PBMC) 从 dMMR CRC 患者中分离出来,并每周使用自体肿瘤类器官刺激。通过对CD8+ T 细胞效应分子 IFNγ 和CD107a进行染色分析,在共培养 2 周后评估CD8 + T 细胞对肿瘤的识别情况。
结果表明在 8个MHC-1 阳性肿瘤类器官中,有 4 个(50%)在共培养 2 周后,IFNγ 和CD107a发生了上调。而在MHC I 类缺陷类器官中没有发生上调,并且与类器官刺激前相比,CD8+ T 细胞群增加了10倍。这些结果表明了该系统可以用于产生评估肿瘤特异性 T细胞亚群。
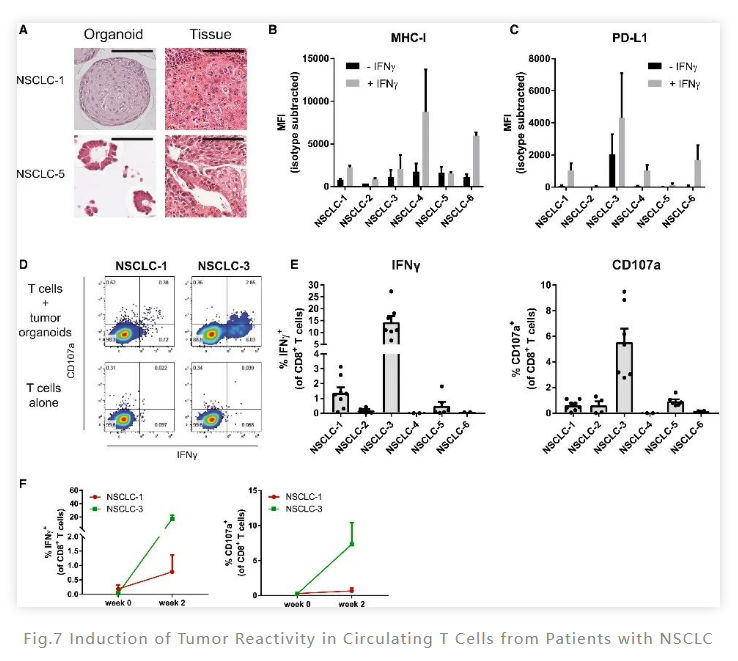
进一步地,研究人员又使用非小细胞肺癌对该系统的广谱性进行了分析。通过前述类似的方法,研究人员在培养两周后也观察到了CD8+ T 细胞群进行了扩大。
综上,这些结果表明:通过肿瘤类器官与免疫细胞共培养可以有效诱导肿瘤特异性T细胞的产生。这一研究也极大拓展了类器官在肿瘤免疫中的应用,为解决类器官免疫细胞缺失问题提供了新的策略。
系统化
许多疾病的发生都是多器官系统共同作用完成的,而传统的单个类器官虽然能够较为真实的模拟体内单个器官的环境,但是对于多系统发生的疾病,仍然存在一定的缺陷。因此,构建多系统协同作用的类器官就成为解决这个问题的一个研究方向。
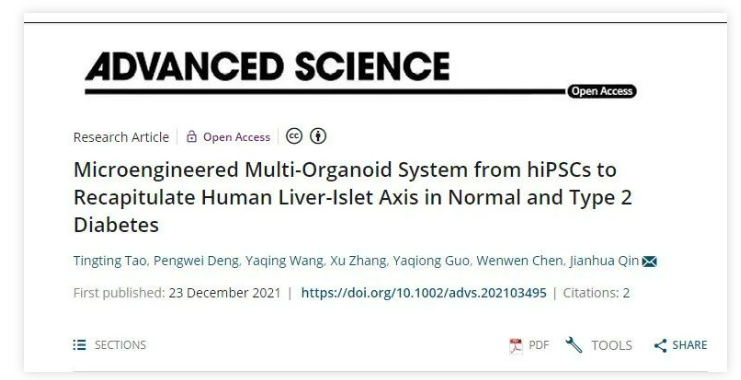
2021年11月,一项发表于著名期刊ADVANCED SCIENCE的研究《Microengineered Multi-Organoid System from hiPSCs to Recapitulate Human Liver-Islet Axis in Normal and Type 2 Diabetes》中,就通过构建肝脏和胰岛类器官共培养构建了2型糖尿病(T2DM)疾病模型,这种多类器官系统可以在生理和病理条件下体外模拟肝胰岛轴,为今后 T2DM 发病机制研究和药物开发提供了独特的研究平台。

2型糖尿病(T2DM)的发病率逐年攀升,并且治疗费用昂贵,极大加重了社会的疾病负担。T2DM 的特点是高血糖和胰岛素抵抗,通常伴有胰腺β细胞功能障碍和肝脏中的胰岛素抵抗。肝脏和胰岛在维持血糖正常方面表现出双重功能,两者的功能紊乱导致了T2DM的发生。
目前研究葡萄糖代谢和 T2DM依赖于动物模型,或使用原代动物肝细胞和胰岛β细胞或其细胞系的混合物。但是,这些模型不能准确模拟人类生理功能和代谢反应,尤其各个不同器官间的相互作用。类器官的出现给解决上述问题带来了转机。
在这项研究中,研究人员开发了一种微流控多类器官系统,用于研究人类肝胰岛轴在正常和疾病环境中的胰岛素和葡萄糖调节。
为了模拟体内肝脏和胰岛之间的葡萄糖调节,研究人员构建了一套微流控控制的多类器官系统,包括类器官共培养芯片、蠕动泵和灌注装置。微流控芯片由平行微通道网络连接的两个隔室组成。每个隔室都包含一系列微孔,以维持肝脏和胰岛类器官的 3D 培养。相互连接的微通道促进了两种类器官之间的介质交换和分泌代谢产物,由此实现了肝脏和胰岛类器官的共培养。
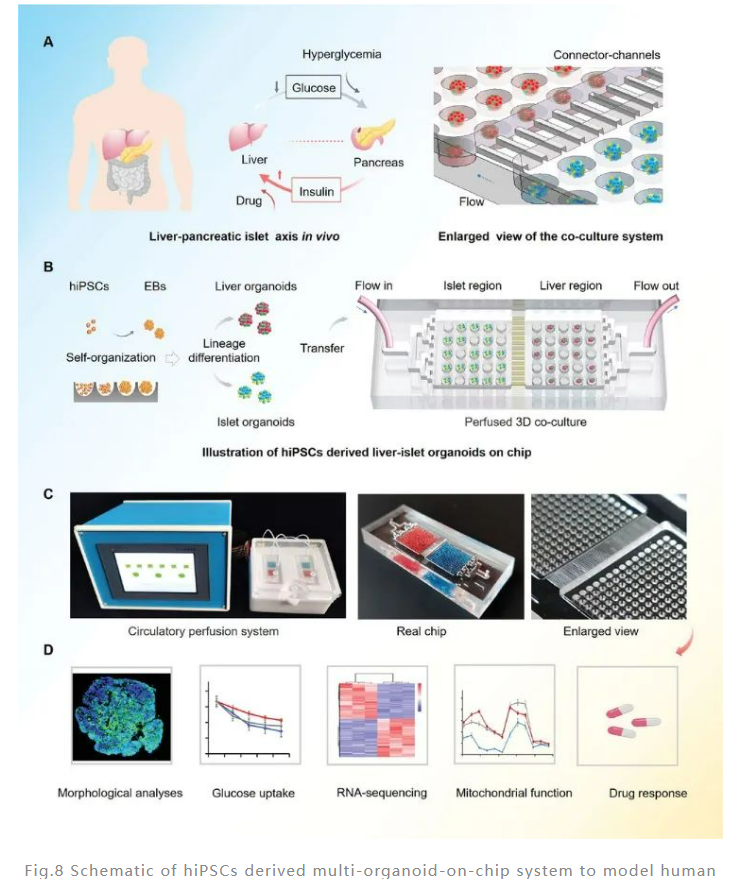
其中,肝脏和胰岛类器官是通过微孔阵列中 hiPSCs 的产生的,并使用含有赛默飞Gibco B-27添加剂的培养基进行培养,最终在微孔中形成了具有均匀尺寸和形态(直径 200 µm)的拟胚体 (EB)。
此外,通过向培养基中添加特定的生长因子和小分子,EB 分化为内胚层细胞,并分别在第 20 天和第 23 天分化为肝脏或胰腺谱系。随后,将肝脏和胰岛类器官转移到芯片装置中进行长期共培养。
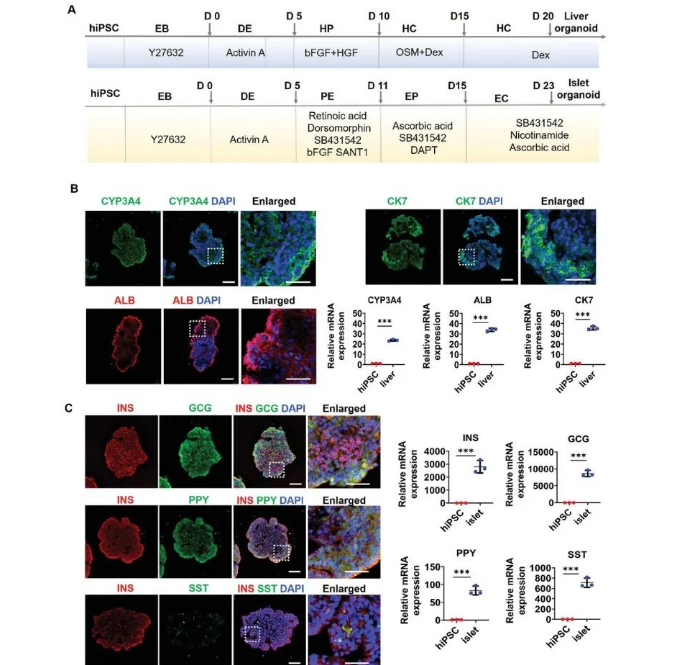
Fig.9 Identification of organ-specific protein and gene expressions in liver and islet organoids prior to co-culture assay.
在共培养系统构建完成后,研究人员在第 0、5、11、20 和 23 天分别观察肝脏和胰岛类器官的形态和大小分布。结果表明在培养诱导分化过程中,肝脏和胰岛类器官的平均大小逐渐增加,形态保持良好。此外,通过活流式细胞术检测细胞活力后发现99.03%的肝脏类器官和96.11%的胰岛类器官细胞保持了良好的细胞活力。
为了进一步验证该共培养类器官的功能,研究人员在第 20 天使用免疫荧光和实时聚合酶链反应 (RT-PCR) 鉴定了肝脏特异性细胞类型和蛋白质分泌。结果表明,hiPSC 诱导分化的肝类器官具有代谢药物的能力并含有天然肝脏的关键细胞成分。同样,通过免疫组织化学分析和 RT-PCR 证实了 hiPSC 诱导分化的胰岛类器官是含有四种类型 ECs 的典型多细胞组织。
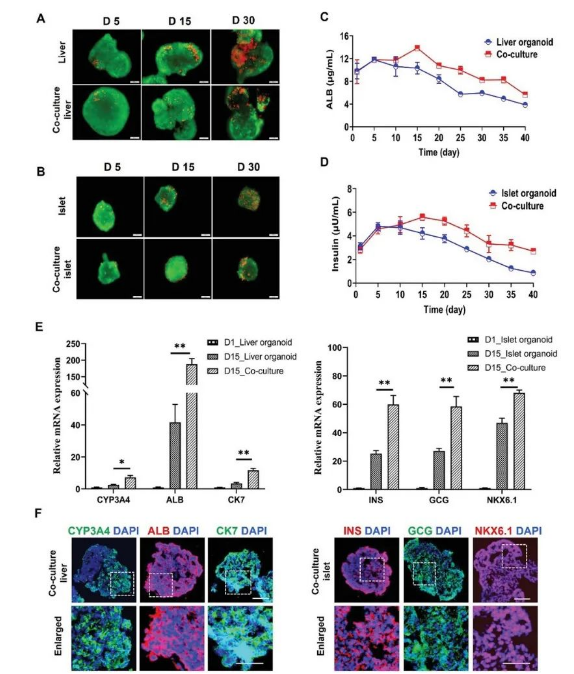
Fig.10 Comparison of cell viability and functionality of liver and islet organoids under mono- and co-culture conditions.
同时,研究人员又对该共培养类器官系统进行了长达30天的功能研究。与单独的类器官培养相比,共培养系统中类器官在长期培养过程中表现出了更高的细胞活力,并显著提高了胰岛类器官的存活率和胰岛素分泌功能。
综上,这项研究构建的多类器官芯片系统为研究多器官疾病发生提供了新的研究策略,并填补了单个类器官无法模拟多系统相互作用的空白。同时,这项研究也让我们看到了结合不同的技术手段丰富类器官培养的可能发展方向。
总结
总的来说,对于火热了10年的类器官研究来说,其存在的“血管化、免疫化、系统化”三大问题近年来已有不同研究团队提出了不同的解决方案。虽然这些研究方案尚不圆满,但是让我们看到类器官研究上的更多可能。
尽管类器官研究仍有诸多问题需要解决,但是全球范围内不断的学术突破也让我们看到这些问题终将被一步步解决。而无论采用什么样的解决方案,研究人员都需要高质量的试剂支持。
参考文献: 1.Cakir, B., Xiang, Y., Tanaka, Y. et al. Engineering of human brain organoids with a functional vascular-like system. Nat Methods 16, 1169–1175 (2019). 2.Dijkstra, Krijn K., et al. "Generation of tumor-reactive T cells by co-culture of peripheral blood lymphocytes and tumor organoids." Cell 174.6 (2018): 1586-1598. 3.Tao, Tingting, et al. "Microengineered Multi‐Organoid System from hiPSCs to Recapitulate Human Liver‐Islet Axis in Normal and Type 2 Diabetes." Advanced Science 9.5 (2022): 2103495.
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 南京市江宁区科学园乾德路5号