2022年8月1日,Gamida Cell宣布其异体干细胞移植疗法Omidubicel的上市申请获得FDA受理,并获得优先审评资格,PDUFA日期为2023年1月30日。如果顺利获批,Omidubicel将成为首款异体干细胞移植疗法。

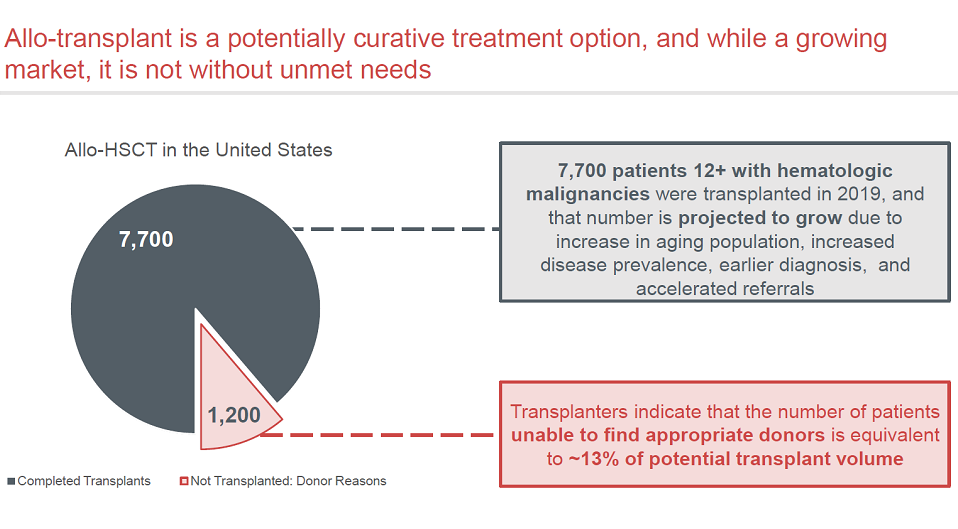
2019年全球有7700例12岁以上的血液瘤患者需要接受造血干细胞移植,其中1200例缺乏合适的骨髓捐献者。
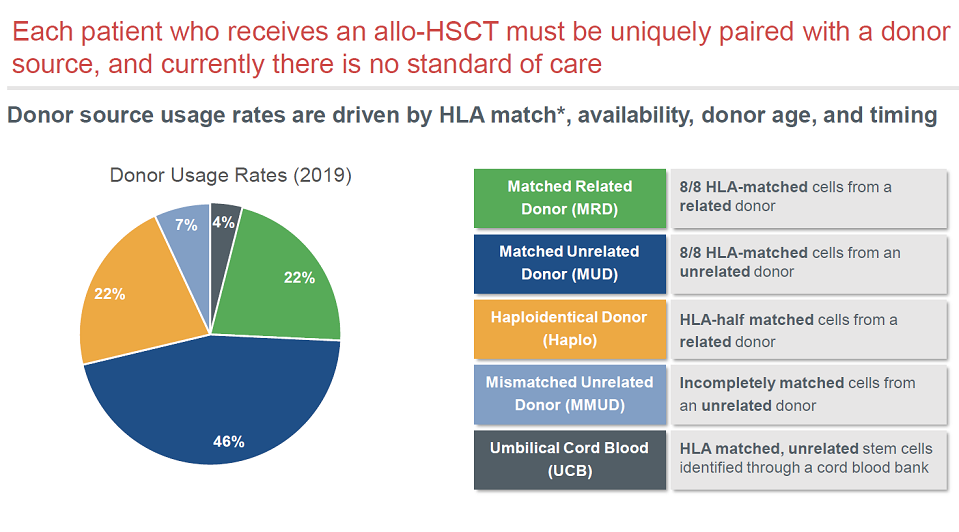
长期以来,造血干细胞移植需要做个性化的匹配,目前仍然缺乏标准疗法。
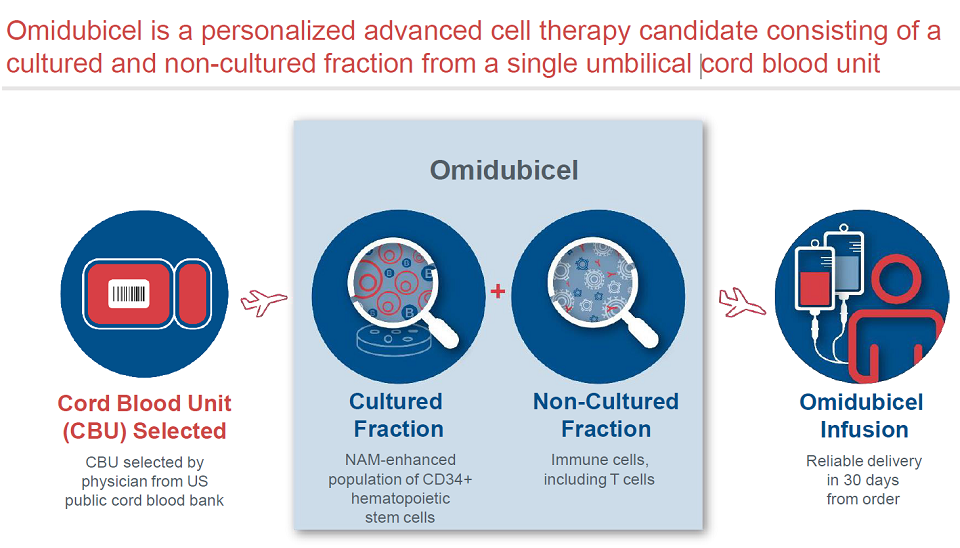
如果获批,Omidubicel可以满足造血干细胞移植领域许多未满足的临床需求。

Omidubicel基于Gamida的NAM技术开发,通过美国公共脐带血库的脐带血细胞,经过扩增的CD34+ HSC与免疫细胞进行混合。
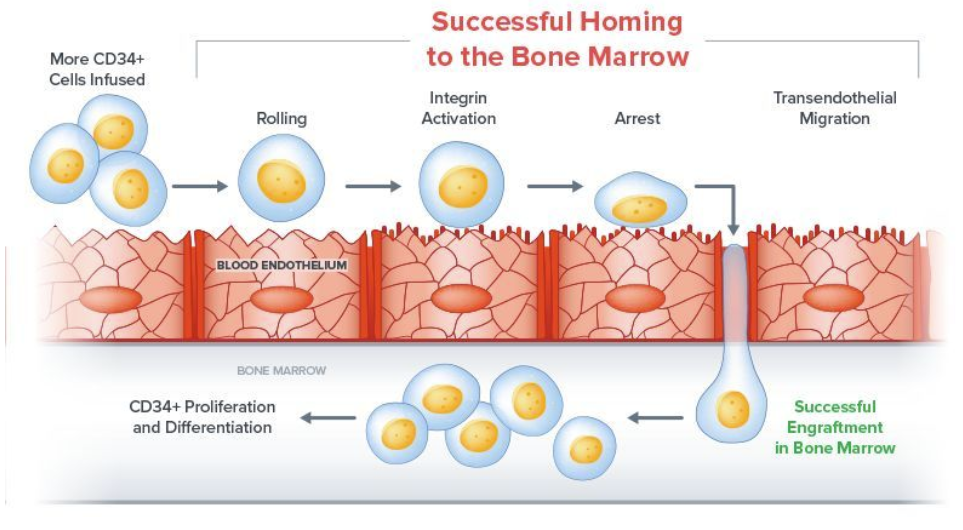
使用NAM技术就不需要另外一单位未处理脐带血,且该平台所扩增出的细胞在移植中更持久,归巢更加迅速。
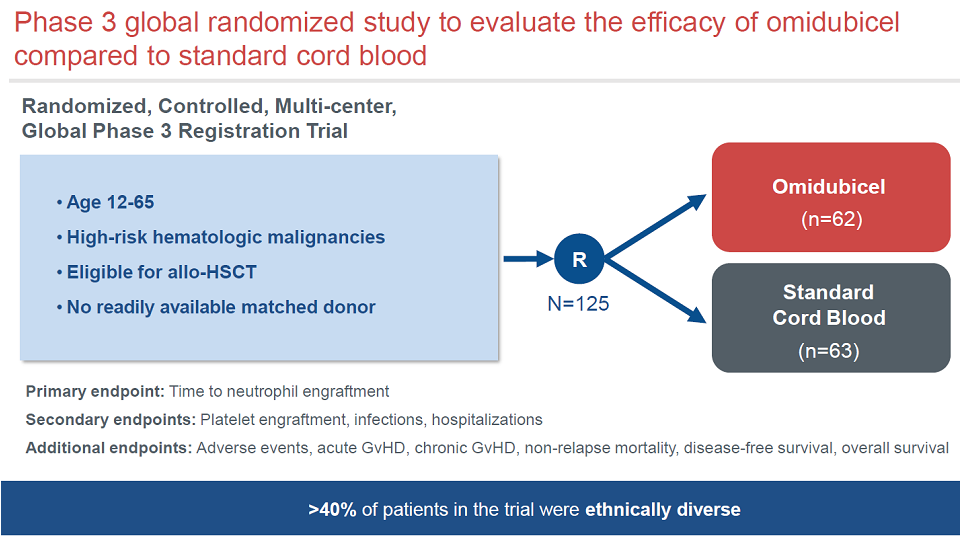
Omidubicel的获批基于关键三期临床数据,入组125例患者,对照组为标准的脐带血造血干细胞移植。
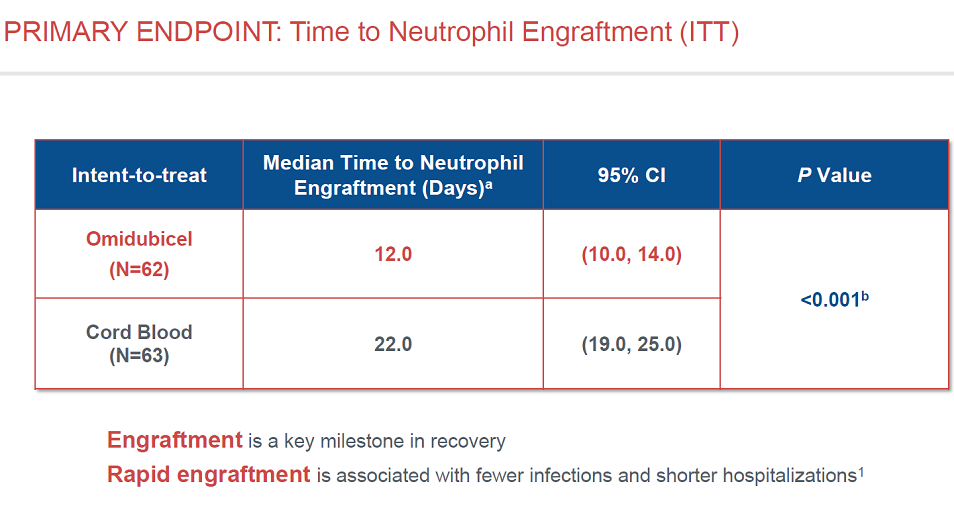
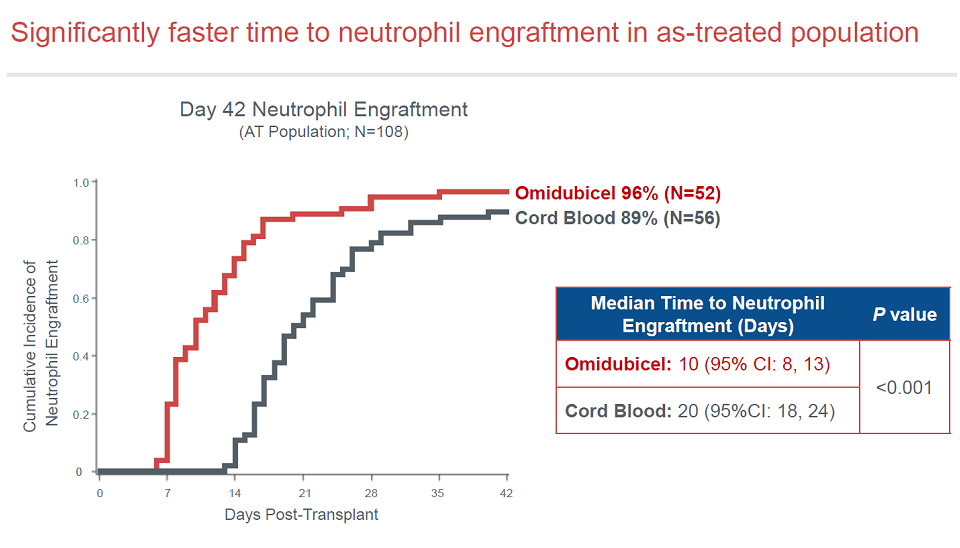
对于主要终点,Omidubicel组的中性粒细胞重建平均时间仅12天,对照组则为22天,p值小于0.001。
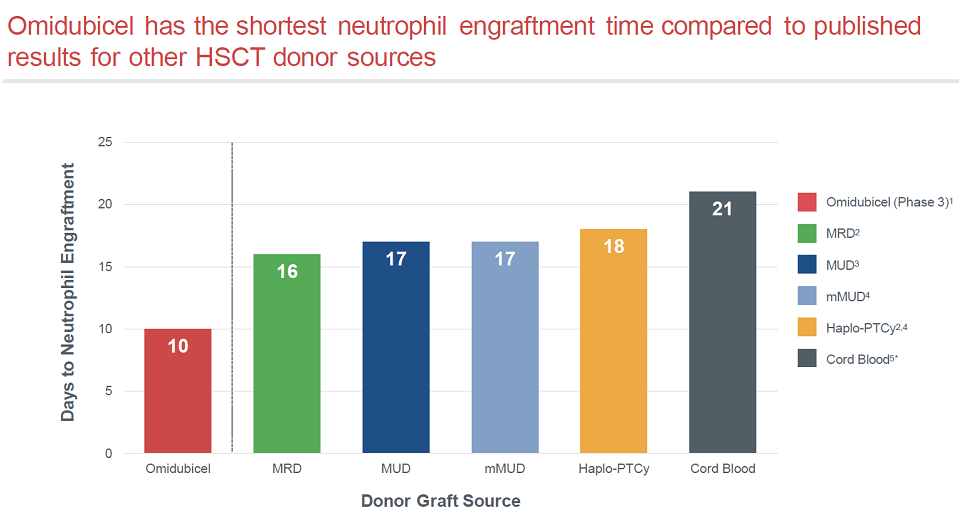
与其他移植方式的历史数据相比,Omidubicel的中性粒细胞重建时间是最短的。
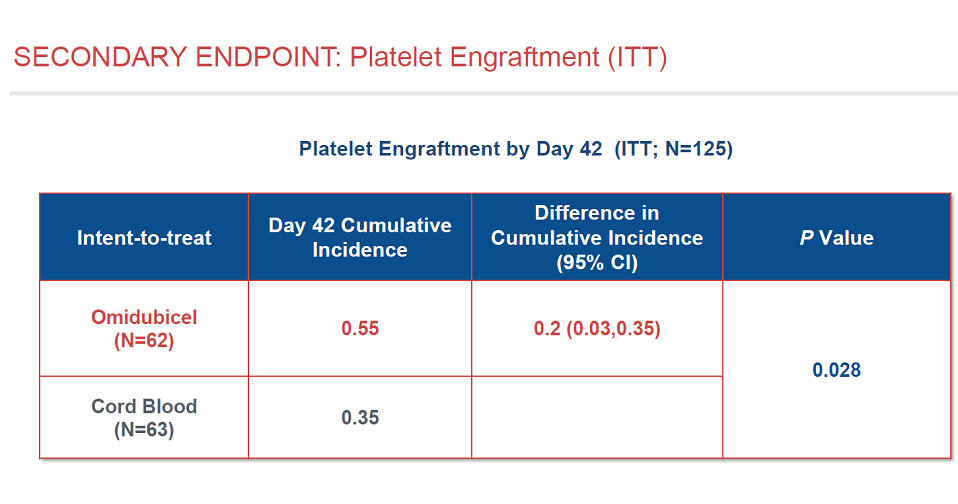
对于次要终点,血小板重建方面,Omidubicel也优于对照组。
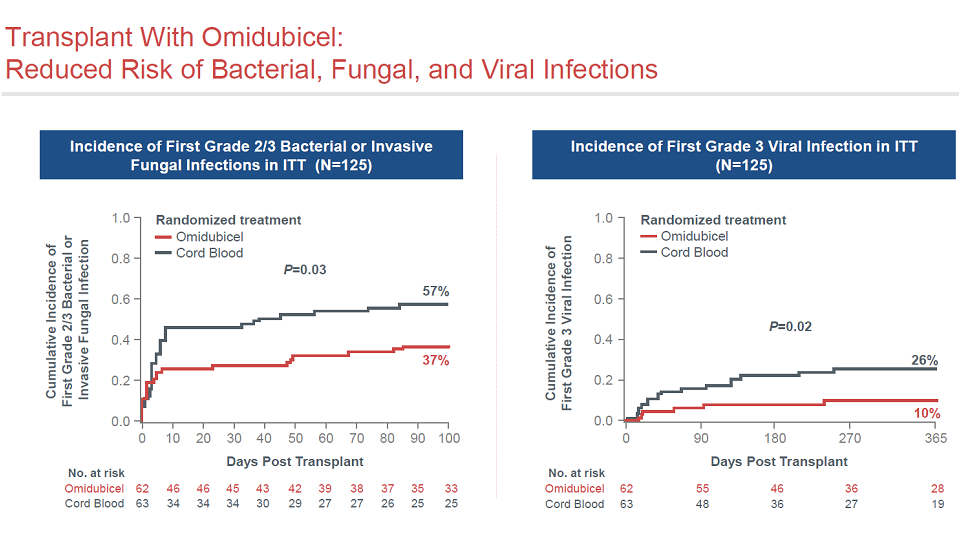
Omidubicel移植显著减少了细菌和病毒感染的风险。
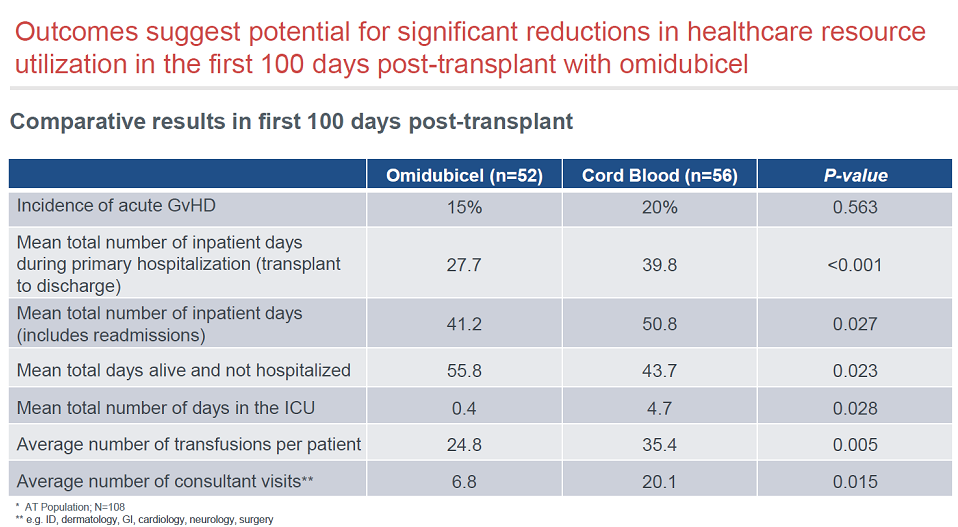
Omidubicel显著减少了住院时间。
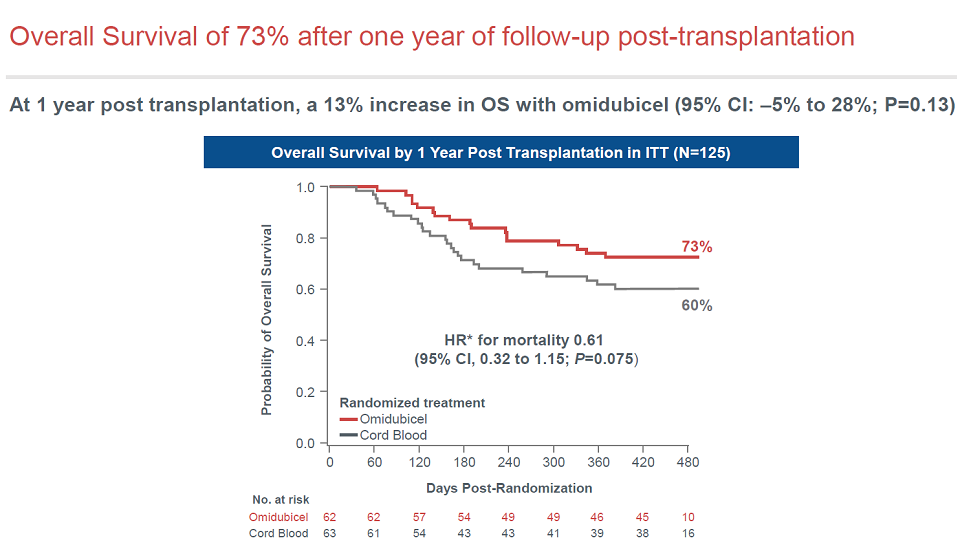
Omidubicel改善了生存数据,但未达到统计学显著。
骨髓移植领域,北大人民医院的半相合移植技术“北京方案”已经一定程度上扩大了造血干细胞移植的个性化匹配的范围。Omidubicel如果成功获批,将大幅提高造血干细胞移植的通用化程度,同时也显著提高了疗效,减少了感染风险,将为更多患者带来更好的临床选择。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 南京市江宁区科学园乾德路5号